据国际能源署预测,2050年氢燃料电池汽车的比重将提高至15%。
Ⅰ.天然气(CH4)和H2O重整制氢
反应①: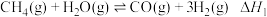
反应②:
(1)已知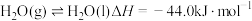 ,相关物质的燃烧热如下表,则
,相关物质的燃烧热如下表,则
___________ 。
(2)700℃时,向一恒容容器中投入1MPaCH4和3MPaH2O,达到平衡时CO、CO2的分压分别为aMPa和bMPa,则反应①的平衡常数
___________ 。
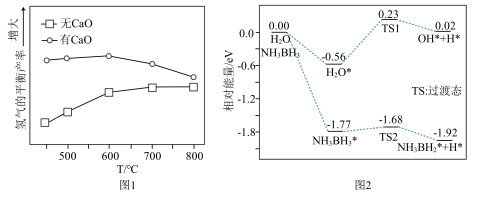
(3)H2的平衡产率随反应温度的变化关系如图1所示。请从平衡移动的角度解释T>600℃时,H2的平衡产率几乎不变的原因___________ 。
(4)已知反应③: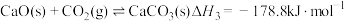 。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。
。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。
Ⅱ.氨硼烷(NH3BH3,熔点104℃)水解制氢
(5)1molNH3BH3完全水解可以生成3molH2和一种可溶性的含氧酸盐(N、B均未变价),请写出NH3BH3完全水解的离子反应方程式___________ 。
(6)吉林大学于吉红院士团队研究发现Pt催化剂上NH3BH3的水解速度主要受H2O和NH3BH3脱氢反应的影响,如图2所示。请写出决速步的化学反应方程式___________ 。
Ⅰ.天然气(CH4)和H2O重整制氢
反应①:
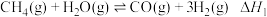
反应②:

(1)已知
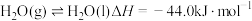 ,相关物质的燃烧热如下表,则
,相关物质的燃烧热如下表,则
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热( ) ) | 890.3 | 282.8 | 285.8 |

(3)H2的平衡产率随反应温度的变化关系如图1所示。请从平衡移动的角度解释T>600℃时,H2的平衡产率几乎不变的原因
(4)已知反应③:
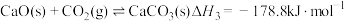 。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。
。研究发现加入适量CaO有利于重整制氢,如图1所示。加入CaO的优点有___________(填字母)。| A.促进反应②平衡正向移动,提高H2的平衡产率 | B.消耗CO2,提高H2的纯度 |
| C.反应③放热,为重整体系提供能量 | D.减少CO2排放,有利于碳中和 |

Ⅱ.氨硼烷(NH3BH3,熔点104℃)水解制氢
(5)1molNH3BH3完全水解可以生成3molH2和一种可溶性的含氧酸盐(N、B均未变价),请写出NH3BH3完全水解的离子反应方程式
(6)吉林大学于吉红院士团队研究发现Pt催化剂上NH3BH3的水解速度主要受H2O和NH3BH3脱氢反应的影响,如图2所示。请写出决速步的化学反应方程式
更新时间:2023-05-31 06:51:57
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】丙烯是仅次于乙烯的有机化工原料,可由丙烷脱氢氧化制取。丙烷脱氢氧化工艺包含的反应有:
主反应:①C3H8(g) C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
②H2(g)+ O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
副反应:③C3H8(g) CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
④C2H4(g)+H2(g) C2H6(g) △H4=-136.94 kJ·mol-1
C2H6(g) △H4=-136.94 kJ·mol-1
⑤C3H8(g)+H2(g) CH4(g)+C2H6(g) △H5
CH4(g)+C2H6(g) △H5
回答下列问题:
(1)△H5=____ kJ·mol-1。
(2)图1是制备工艺中一些反应平衡常数的对数值与温度的关系图,欲提高丙烯的产率,能否尽可能的提高反应温度?_________ ,其原因是__________________ 。除温度外,下列还可提高丙烯产率的措施有_________ (填序号)

A 降低压强 B 增大压强
C 采用选择性优良的催化剂 D 选择性的氧化消除部分氢气
(3)实际脱氢工艺中常常通入水蒸气,以改变丙烷的平衡转化率。图2为常压、600~1000K时,不同水烃比M下丙烷脱氢反应的平衡转化率变化图。由图可知,常压、温度恒定时水烃比对平衡转化率的影响规律为____________ 。设某温度、1 atm(记为p0)下丙烷的脱氢转化率为y,加入反应体系的水蒸气与原料丙烷的物质的量之比为M,则脱氢反应的平衡常数Kp=____ (Kp为以分压表示的平衡常数,写出表达式即可)。
(4)当反应温度为923K时,计算可知脱氢反应的反应热为+115.66 kJ·mol-1,烧氢反应的反应热为-237.75 kJ·mol-1,为保证烧氢所放热量完全满足脱氢吸热之用(假设脱氢率为100%),则烧氢率应大于_____ ;由此可见,烧氢过程不仅可以提高丙烷脱氢的转化率,还可以_________ 。
主反应:①C3H8(g)
 C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)
C3H6(g)+H2(g) △H1=+124.27 kJ·mol-1(脱氢反应)②H2(g)+
 O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)
O2(g)=H2O(g) △H2=-241.82 kJ·mol-1(烧氢反应)副反应:③C3H8(g)
 CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1
CH4(g)+C2H4(g) △H3=+81.30 kJ·mol-1④C2H4(g)+H2(g)
 C2H6(g) △H4=-136.94 kJ·mol-1
C2H6(g) △H4=-136.94 kJ·mol-1⑤C3H8(g)+H2(g)
 CH4(g)+C2H6(g) △H5
CH4(g)+C2H6(g) △H5回答下列问题:
(1)△H5=
(2)图1是制备工艺中一些反应平衡常数的对数值与温度的关系图,欲提高丙烯的产率,能否尽可能的提高反应温度?

A 降低压强 B 增大压强
C 采用选择性优良的催化剂 D 选择性的氧化消除部分氢气
(3)实际脱氢工艺中常常通入水蒸气,以改变丙烷的平衡转化率。图2为常压、600~1000K时,不同水烃比M下丙烷脱氢反应的平衡转化率变化图。由图可知,常压、温度恒定时水烃比对平衡转化率的影响规律为
(4)当反应温度为923K时,计算可知脱氢反应的反应热为+115.66 kJ·mol-1,烧氢反应的反应热为-237.75 kJ·mol-1,为保证烧氢所放热量完全满足脱氢吸热之用(假设脱氢率为100%),则烧氢率应大于
您最近一年使用:0次
【推荐2】水煤气变换[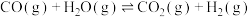 ]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。回答下列问题。
]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。回答下列问题。
(1)在800℃、2L密闭容器中,若充入3molCO和2mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成1.2mol ,则5min内该反应的速率
,则5min内该反应的速率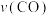 为
为_____ ,该温度下的平衡常数K为_____ ,CO平衡转化率为_____ 。
(2)Shibata曾做过下列实验:721℃下,分别用氢气和一氧化碳还原氧化钴(CoO),反应如下。请回答问题:
i、

ii、

①反应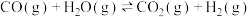

_____ (用 、
、 表示);
表示);
②反应i和ⅱ分别达到平衡后,若气体中 和CO的体积分数分别为0.025、0.02,则反应
和CO的体积分数分别为0.025、0.02,则反应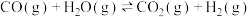 的平衡常数
的平衡常数
_____ (计算并保留两位小数)。
③一氧化碳和水蒸气的反应历程(反应A、反应B)如图,下列说法正确的是_____ 。
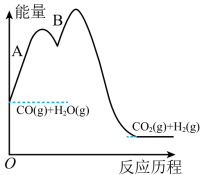
a、该反应经过两步基元反应完成
b、反应为放热反应,其中反应B活化能大于反应A
c、使用催化剂,可以改变反应的过程,反应速率加快
d、升高温度,可以使反应A、反应B活化能变大
(3)800℃下,将CO和水蒸气混合气体充入容积相等的三个恒温、恒容密闭容器中,获得如下数据。
①表中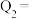
_____ 。
②关于3组实验,下列说法正确的是_____ 。
a、实验开始时,起始反应速率最快的是实验3
b、平衡时 浓度:实验3是实验2的2倍
浓度:实验3是实验2的2倍
c、平衡时,实验1与实验3中CO的转化率相同
d、平衡常数,实验3是实验1的两倍
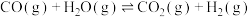 ]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。回答下列问题。
]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域。回答下列问题。(1)在800℃、2L密闭容器中,若充入3molCO和2mol水蒸气进行反应,保持温度不变,5min反应达平衡,测得生成1.2mol
 ,则5min内该反应的速率
,则5min内该反应的速率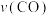 为
为(2)Shibata曾做过下列实验:721℃下,分别用氢气和一氧化碳还原氧化钴(CoO),反应如下。请回答问题:
i、


ii、


①反应
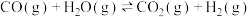

 、
、 表示);
表示);②反应i和ⅱ分别达到平衡后,若气体中
 和CO的体积分数分别为0.025、0.02,则反应
和CO的体积分数分别为0.025、0.02,则反应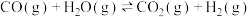 的平衡常数
的平衡常数
③一氧化碳和水蒸气的反应历程(反应A、反应B)如图,下列说法正确的是

a、该反应经过两步基元反应完成
b、反应为放热反应,其中反应B活化能大于反应A
c、使用催化剂,可以改变反应的过程,反应速率加快
d、升高温度,可以使反应A、反应B活化能变大
(3)800℃下,将CO和水蒸气混合气体充入容积相等的三个恒温、恒容密闭容器中,获得如下数据。
| 实验编号 | 各物质起始量/mol | 平衡时能量变化/kJ | |||
| CO |  |  |  | ||
| 实验1 | 1 | 1 | 0 | 0 |  |
| 实验2 | 0 | 0 | 1 | 1 |  |
| 实验3 | 2 | 2 | 0 | 0 | 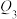 |
①表中
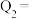
②关于3组实验,下列说法正确的是
a、实验开始时,起始反应速率最快的是实验3
b、平衡时
 浓度:实验3是实验2的2倍
浓度:实验3是实验2的2倍c、平衡时,实验1与实验3中CO的转化率相同
d、平衡常数,实验3是实验1的两倍
您最近一年使用:0次
【推荐3】“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳、硫及其化合物的综合利用成为研究的热点。
(1)下列事实中,能用来比较碳元素和硫元素的非金属性强弱的是____________ (填字母)。
A.SO2具有漂白性而CO2没有
B.少量H2SO3可与Na2CO3反应生成NaHCO3
C.SO2能使酸性KMnO4溶液褪色而CO2不能
D.Na2CO3溶液显碱性,而Na2SO4溶液显中性
(2)通过热循环进行能源综合利用的反应系统的原理如下图所示。

系统(Ⅱ)制取氢气的热化学方程式为________________________ ;
两个系统制得等量的H2时所需能量较少的是________________________ 。
(3)向10L恒容密闭容器中充入2 molCO和1molSO2,发生反应2CO(g)+SO2(g) S(g)+2CO2(g)。CO和CO2的平衡体积分数(
S(g)+2CO2(g)。CO和CO2的平衡体积分数(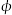 )与温度(T)的变化关系如下图所示。
)与温度(T)的变化关系如下图所示。

①图中表示CO的平衡体积分数与温度的变化关系的曲线为_____________ (填“L1”或“L2”)。
②T1℃时,SO2的平衡转化率a1=_____________ ,反应的平衡常数K1=_____________ 。
③只改变下列条件,既能加快该反应的反应速率,又能增大CO的平衡转化率的是_____________ (填字母)。
A.增大压强
B.充入一定量的H2S
C.充入一定量的SO2
D.加入适当催化剂
④向起始温度为T1℃的10L绝热容器中充入2molCO和1molSO2,重复实验,该反应的平衡常数K2___ (填“>”“<”或“=”)K1,理由为______________________ 。
(1)下列事实中,能用来比较碳元素和硫元素的非金属性强弱的是
A.SO2具有漂白性而CO2没有
B.少量H2SO3可与Na2CO3反应生成NaHCO3
C.SO2能使酸性KMnO4溶液褪色而CO2不能
D.Na2CO3溶液显碱性,而Na2SO4溶液显中性
(2)通过热循环进行能源综合利用的反应系统的原理如下图所示。

系统(Ⅱ)制取氢气的热化学方程式为
两个系统制得等量的H2时所需能量较少的是
(3)向10L恒容密闭容器中充入2 molCO和1molSO2,发生反应2CO(g)+SO2(g)
 S(g)+2CO2(g)。CO和CO2的平衡体积分数(
S(g)+2CO2(g)。CO和CO2的平衡体积分数(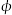 )与温度(T)的变化关系如下图所示。
)与温度(T)的变化关系如下图所示。
①图中表示CO的平衡体积分数与温度的变化关系的曲线为
②T1℃时,SO2的平衡转化率a1=
③只改变下列条件,既能加快该反应的反应速率,又能增大CO的平衡转化率的是
A.增大压强
B.充入一定量的H2S
C.充入一定量的SO2
D.加入适当催化剂
④向起始温度为T1℃的10L绝热容器中充入2molCO和1molSO2,重复实验,该反应的平衡常数K2
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】“低碳经济”已成为全世界科学家研究的重要课题,二氧化碳甲烷化是其中重要反应之一,根据所学知识回答下列问题:
I.主反应1:CO2(g)+4H2(g) CH4(g)+2H2O(g) ΔH1
CH4(g)+2H2O(g) ΔH1
副反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2>0
CO(g)+H2O(g) ΔH2>0
已知:①常温常压下,H2和CH4的燃烧热(ΔH)分别为-285.5kJ·mol-1和-890.0kJ·mol-1:
②H2O(l)=H2O(g) ΔH3=+44.0kJ·mol-1。
(1)ΔH1=___________ kJ·mol-1。
(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、30kPa,加入催化剂并加热使其发生主反应1,研究表明CH4的反应速率 (CH4)=2×10-6p(CO2)·p4(H2)kPa·s-1,某时刻测得H2O(g))的分压为10kPa,则该时刻
(CH4)=2×10-6p(CO2)·p4(H2)kPa·s-1,某时刻测得H2O(g))的分压为10kPa,则该时刻 (H2O)=
(H2O)=___________ 。
(3)研究发现主反应1前三步历程如图甲所示,其中吸附在Pt/SiO2催化剂表面的粒子用“·”标注,Ts表示过渡态。从粒子吸附在催化剂表面到形成过渡态过程会___________ (填“放出”或“吸收“)热量;反应历程中最小能垒(活化能)步骤的化学方程式为___________ 。
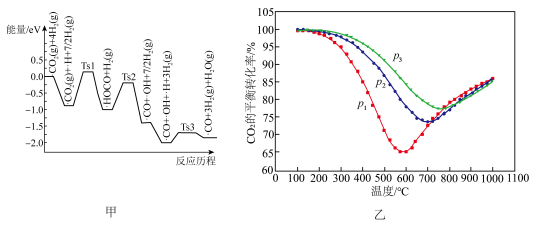
(4)不同条件下,按照c(CO2):c(H2O)=1:4投料同时发生主反应1和副反应2,CO2的平衡转化率如图乙所示。
①压强p1、p2、p3由大到小的顺序是___________ 。
②压强为p1时,随着温度升高,CO2平衡转化率先减小后增大的原因是_________ 。
Ⅱ.某研究团队经实验证明,CO2在一定条件下与H2O发生氧再生反应:CO2(g)+2H2O(g) CH4(g)+2O2(g) ΔH=+802.3kJ·mol-1。
CH4(g)+2O2(g) ΔH=+802.3kJ·mol-1。
(5)恒压条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度关系如图。350°C时,A点的平衡常数K=___________ (填计算结果)。为提高CO2的转化率,除改变温度外,还可采取的措施为___________ 。

I.主反应1:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) ΔH1
CH4(g)+2H2O(g) ΔH1副反应2:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2>0
CO(g)+H2O(g) ΔH2>0已知:①常温常压下,H2和CH4的燃烧热(ΔH)分别为-285.5kJ·mol-1和-890.0kJ·mol-1:
②H2O(l)=H2O(g) ΔH3=+44.0kJ·mol-1。
(1)ΔH1=
(2)在某一恒容密闭容器中加入CO2、H2,其分压分别为15kPa、30kPa,加入催化剂并加热使其发生主反应1,研究表明CH4的反应速率
 (CH4)=2×10-6p(CO2)·p4(H2)kPa·s-1,某时刻测得H2O(g))的分压为10kPa,则该时刻
(CH4)=2×10-6p(CO2)·p4(H2)kPa·s-1,某时刻测得H2O(g))的分压为10kPa,则该时刻 (H2O)=
(H2O)=(3)研究发现主反应1前三步历程如图甲所示,其中吸附在Pt/SiO2催化剂表面的粒子用“·”标注,Ts表示过渡态。从粒子吸附在催化剂表面到形成过渡态过程会

(4)不同条件下,按照c(CO2):c(H2O)=1:4投料同时发生主反应1和副反应2,CO2的平衡转化率如图乙所示。
①压强p1、p2、p3由大到小的顺序是
②压强为p1时,随着温度升高,CO2平衡转化率先减小后增大的原因是
Ⅱ.某研究团队经实验证明,CO2在一定条件下与H2O发生氧再生反应:CO2(g)+2H2O(g)
 CH4(g)+2O2(g) ΔH=+802.3kJ·mol-1。
CH4(g)+2O2(g) ΔH=+802.3kJ·mol-1。(5)恒压条件下,按c(CO2):c(H2O)=1:2投料,进行氧再生反应,测得不同温度下平衡时体系中各物质浓度关系如图。350°C时,A点的平衡常数K=

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】空气中 含量的控制和
含量的控制和 资源利用具有重要意义。回答下列问题:
资源利用具有重要意义。回答下列问题:
Ⅰ.利用 制备甲醇
制备甲醇
(1)利用铟氧化物催化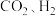 制取甲醇:
制取甲醇: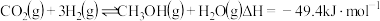 。将固定比例的
。将固定比例的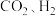 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如图示。
转化率随气体流速变化曲线如图示。 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者________ 后者(填“大于”“小于”或“等于”)。保持气体流速不变,反应管内温度从 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是__________________ ;
(2) 催化加氢制甲醇过程中的主要反应有:
催化加氢制甲醇过程中的主要反应有:
反应i: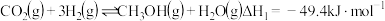
反应ii: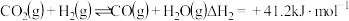
反应iii: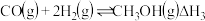
①反应iii的
_____________ ,反应iii_____________ 正向自发进行(填标号);
A.任何温度下都能 B.任何温度下都不能 C.高温下能 D.低温下能
②已知反应i的速率方程为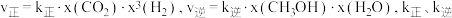 均为速率常数且只与温度有关,x为物质的量分数。则反应i用物质的量分数表示的平衡常数
均为速率常数且只与温度有关,x为物质的量分数。则反应i用物质的量分数表示的平衡常数
_________ (用 表示);
表示);
③反应iii在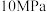 下,将
下,将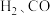 按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图所示。曲线c代表的物质为
按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图所示。曲线c代表的物质为_________ (填化学式)。温度为 时,反应ii的平衡常数
时,反应ii的平衡常数
_________ 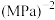 (结果用分数表示);
(结果用分数表示);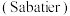 反应合成甲烷
反应合成甲烷
(3)空间站必须给航天员提供基本的生存条件,涉及氧气供给、二氧化碳清除、水处理等.电解水技术除用于供氧外,生成的氢气通过萨巴蒂尔反应,实现了二氧化碳的清除,同时将氢气转化为更安全的甲烷,反应原理为 。在恒容密闭容器中加入等物质的量的
。在恒容密闭容器中加入等物质的量的 和
和 ,分压均为
,分压均为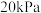 ,一定温度下发生萨巴蒂尔反应,随着反应的进行,
,一定温度下发生萨巴蒂尔反应,随着反应的进行, 的物质的量分数
的物质的量分数________ (填“逐渐增大”“逐渐减小”或“保持不变”).某时刻测得 的分压为
的分压为 ,若
,若 的反应速率
的反应速率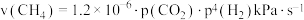 ,则同时刻
,则同时刻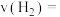
_________  (保留2位小数)。
(保留2位小数)。
 含量的控制和
含量的控制和 资源利用具有重要意义。回答下列问题:
资源利用具有重要意义。回答下列问题:Ⅰ.利用
 制备甲醇
制备甲醇(1)利用铟氧化物催化
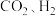 制取甲醇:
制取甲醇: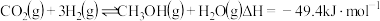 。将固定比例的
。将固定比例的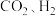 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如图示。
转化率随气体流速变化曲线如图示。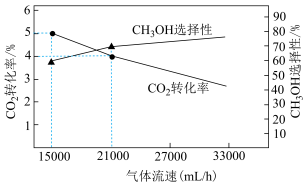
 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是(2)
 催化加氢制甲醇过程中的主要反应有:
催化加氢制甲醇过程中的主要反应有:反应i:
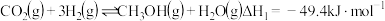
反应ii:
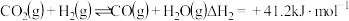
反应iii:
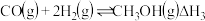
①反应iii的

A.任何温度下都能 B.任何温度下都不能 C.高温下能 D.低温下能
②已知反应i的速率方程为
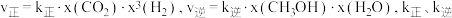 均为速率常数且只与温度有关,x为物质的量分数。则反应i用物质的量分数表示的平衡常数
均为速率常数且只与温度有关,x为物质的量分数。则反应i用物质的量分数表示的平衡常数
 表示);
表示);③反应iii在
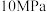 下,将
下,将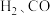 按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图所示。曲线c代表的物质为
按一定比例投料,恒压下平衡状态时各组分的物质的量与温度的关系如图所示。曲线c代表的物质为 时,反应ii的平衡常数
时,反应ii的平衡常数
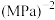 (结果用分数表示);
(结果用分数表示);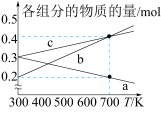
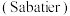 反应合成甲烷
反应合成甲烷(3)空间站必须给航天员提供基本的生存条件,涉及氧气供给、二氧化碳清除、水处理等.电解水技术除用于供氧外,生成的氢气通过萨巴蒂尔反应,实现了二氧化碳的清除,同时将氢气转化为更安全的甲烷,反应原理为
 。在恒容密闭容器中加入等物质的量的
。在恒容密闭容器中加入等物质的量的 和
和 ,分压均为
,分压均为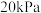 ,一定温度下发生萨巴蒂尔反应,随着反应的进行,
,一定温度下发生萨巴蒂尔反应,随着反应的进行, 的物质的量分数
的物质的量分数 的分压为
的分压为 ,若
,若 的反应速率
的反应速率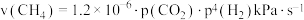 ,则同时刻
,则同时刻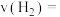
 (保留2位小数)。
(保留2位小数)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
Ⅱ.CO(g)+2H2(g) CH3OH(g) ΔH2=-90.4 kJ·mol-1
CH3OH(g) ΔH2=-90.4 kJ·mol-1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)ΔH3=___________ 。
(2)在密闭容器中充有2 mol CO和4mol H2,在催化剂作用下发生反应II,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积___________ (填“大于”、“=”或“小于”)2L。若反应进行1min达到平衡状态C,用CO的分压变化表示的平均反应速率vp(CO)=___________ kPa•min-1,此时的化学平衡常数Kp=___________ [Kp是用分压表示的平衡常数,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)]。
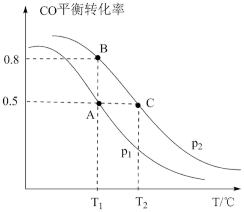
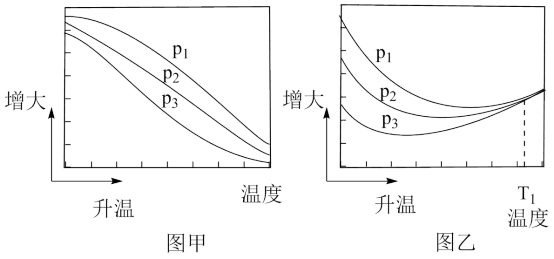
(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:CO2的平衡转化率=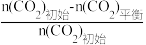 ×100%
×100%
CH3OH的平衡产率= ×100%
×100%
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)工业上可采用CH3OH CO+2H2的原理来制取高纯度的CO和H2。我国学者通过计算机模拟,研究了在钯基催化剂表面上利用甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式,主要经历的方式是
CO+2H2的原理来制取高纯度的CO和H2。我国学者通过计算机模拟,研究了在钯基催化剂表面上利用甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式,主要经历的方式是___________ (填字母)。
方式A: CH3OH* →CH3O* + H* Ea=+103.1 kJ·mol-1
方式B: CH3OH* →CH3* + OH* Eb=+249.3 kJ·mol-1
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.5 kJ·mol-1Ⅱ.CO(g)+2H2(g)
 CH3OH(g) ΔH2=-90.4 kJ·mol-1
CH3OH(g) ΔH2=-90.4 kJ·mol-1Ⅲ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3回答下列问题:
(1)ΔH3=
(2)在密闭容器中充有2 mol CO和4mol H2,在催化剂作用下发生反应II,改变条件,测得CO的平衡转化率与温度(T)、压强(p)的关系如图所示。若达到平衡状态A时,容器的体积为2L,则在平衡状态B时容器的体积

(3)不同压强下,按照n(CO2):n(H2)=1:3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。

已知:CO2的平衡转化率=
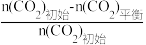 ×100%
×100%CH3OH的平衡产率=
 ×100%
×100%其中纵坐标表示CO2平衡转化率的是图
(4)工业上可采用CH3OH
 CO+2H2的原理来制取高纯度的CO和H2。我国学者通过计算机模拟,研究了在钯基催化剂表面上利用甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式,主要经历的方式是
CO+2H2的原理来制取高纯度的CO和H2。我国学者通过计算机模拟,研究了在钯基催化剂表面上利用甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式,主要经历的方式是方式A: CH3OH* →CH3O* + H* Ea=+103.1 kJ·mol-1
方式B: CH3OH* →CH3* + OH* Eb=+249.3 kJ·mol-1
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】煤制天然气的关键步骤是从合成气中生产CH4.合成气转化为CH4的过程中涉及以下反应:
I.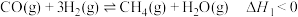
Ⅱ.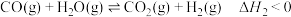
Ⅲ.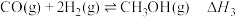
(1)煤的综合利用途径主要有干馏、气化和液化,煤的干馏属于___________ 变化(填“物理”或“化学”)。
(2)已知几种物质的燃烧热如下表:
结合上述数据,可知△H3=___________ kJ·mol-1。
(3)向添加了催化剂的管式反应器中以一定的气体流速通入合成气 ,
,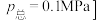 ,在一定温度下发生上述反应,在管式反应器的进、出口检测各成分的含量,并计算下列物理量:
,在一定温度下发生上述反应,在管式反应器的进、出口检测各成分的含量,并计算下列物理量:
CO转化率: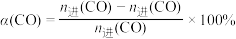
CH4选择性: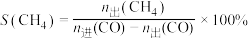
①对于反应I,下列说法正确的是___________ (填序号)。
A.混入N2能提高CO的平衡转化率
B.管式反应器的进、出口气体压强相同时,说明反应在反应器内已达平衡
C.在恒容密闭容器中反应达到平衡后,降低温度可使α(CO)增大
D.为了提高Y(CH4),需要使α(CO)增大的同时抑制反应Ⅰ以外的化学反应
②某次实验过程中测得如下数据:
此次实验中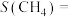
___________ (保留3位有效数字),氢气的转化率α(H2)=___________ 。
(4)利用太阳能电池在室温下能将CH4转化为CH3OH,工作原理如图所示: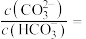
___________ 。
已知:H2CO3的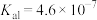 ,
,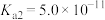
②CH4转化为CH3OH的电极反应式为___________ 。
I.
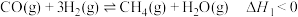
Ⅱ.
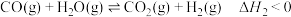
Ⅲ.
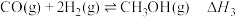
(1)煤的综合利用途径主要有干馏、气化和液化,煤的干馏属于
(2)已知几种物质的燃烧热如下表:
| 物质 | CO(g) | H2(g) | CH3OH(g) |
| 燃烧热ΔH/(kJ·mol-1) | -283.0 | -285.8 | -764.6 |
(3)向添加了催化剂的管式反应器中以一定的气体流速通入合成气
 ,
,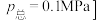 ,在一定温度下发生上述反应,在管式反应器的进、出口检测各成分的含量,并计算下列物理量:
,在一定温度下发生上述反应,在管式反应器的进、出口检测各成分的含量,并计算下列物理量:CO转化率:
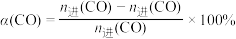
CH4选择性:
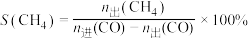
①对于反应I,下列说法正确的是
A.混入N2能提高CO的平衡转化率
B.管式反应器的进、出口气体压强相同时,说明反应在反应器内已达平衡
C.在恒容密闭容器中反应达到平衡后,降低温度可使α(CO)增大
D.为了提高Y(CH4),需要使α(CO)增大的同时抑制反应Ⅰ以外的化学反应
②某次实验过程中测得如下数据:
| 物质 | 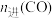 |  |  |  |
| n/mol | 1.00 | 0.87 | 0.02 | 0.01 |
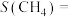
(4)利用太阳能电池在室温下能将CH4转化为CH3OH,工作原理如图所示:

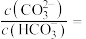
已知:H2CO3的
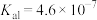 ,
,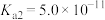
②CH4转化为CH3OH的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】实验小组同学为探究Fe2+性质,进行如下实验。
【实验Ⅰ】向2mL 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。
(1)甲同学通过上述实验分析 具有
具有_______ (填“氧化”或“还原”)性。
乙同学查阅资料发现 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
(2) 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为_______ 。
【实验Ⅱ】验证 与
与 发生反应
发生反应_______ 。
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是_______ 。
丙同学设计实验进一步证明 可与
可与 反应。
反应。
【实验Ⅲ】
①X为_______ 。
②实验能够证实 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是_______ 。
(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低 ,
,_______ 。
【实验Ⅰ】向2mL
 溶液滴中几滴
溶液滴中几滴 KSCN溶液,无明显现象,再滴加几滴3%
KSCN溶液,无明显现象,再滴加几滴3% 溶液(用
溶液(用 酸化至
酸化至 ),溶液颜色变红。
),溶液颜色变红。(1)甲同学通过上述实验分析
 具有
具有乙同学查阅资料发现
 与
与 可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。
可发生反应,生成无色的配合物。为证实该性质,利用进行如下实验。(2)
 的制备:用过量
的制备:用过量 溶液与
溶液与 溶液反应得到
溶液反应得到 ,离子方程式为
,离子方程式为【实验Ⅱ】验证
 与
与 发生反应
发生反应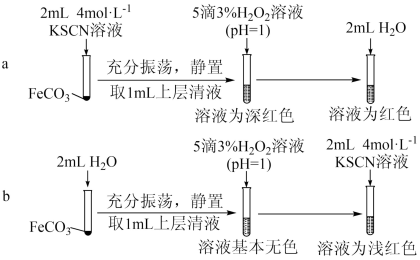
(4)从沉淀溶解平衡角度解释实验a和b最终溶液颜色不同的原因是
丙同学设计实验进一步证明
 可与
可与 反应。
反应。【实验Ⅲ】
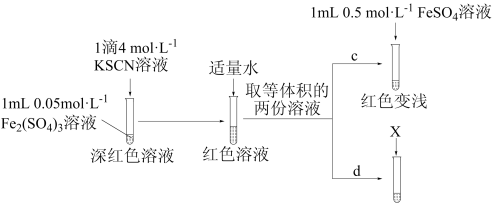
①X为
②实验能够证实
 可与
可与 反应,则应观察到的现象是
反应,则应观察到的现象是(6)实验Ⅲ中若未加适量水稀释,则无法通过现象得出结论。推测加水稀释的目的可能有:使后续实验颜色变化易于观察;降低
 ,
,
您最近一年使用:0次
【推荐3】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
Ⅰ.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
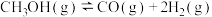
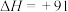 kJ·mol
kJ·mol

 kJ·mol
kJ·mol
写出以甲醇为原料制取氢气的热化学方程式___________ 。
(2)理论上,能提高 平衡产率的措施有
平衡产率的措施有___________ (写出一条即可)。
Ⅱ.储存氢气
硼氢化钠( )是研究最广泛的储氢材料之一
)是研究最广泛的储氢材料之一
已知:
i.B的电负性为2.0,H的电负性为2.1
ii.25℃下 在水中的溶解度为55 g,
在水中的溶解度为55 g, 在水中的溶解度为0.28 g
在水中的溶解度为0.28 g
(3)在配制 溶液时,为了防止发生水解反应,可以加入少量的
溶液时,为了防止发生水解反应,可以加入少量的___________ (填写化学式)。
(4)向 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(
水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠( )和氢气。写出该反应的化学方程式
)和氢气。写出该反应的化学方程式___________ 。
(5)在研究浓度对催化剂Ru/NGR活性的影响时,发现B点后(见图1)增加 的浓度,制氢速率反而下降,推断可能的原因是
的浓度,制氢速率反而下降,推断可能的原因是___________ 。

(6)用惰性电极电解 溶液可制得
溶液可制得 ,实现物质的循环使用,制备装置如图2所示。
,实现物质的循环使用,制备装置如图2所示。

①钛电极的电极反应式是___________ 。
②电解过程中,阴极区溶液pH___________ (填“增大”“减小”或“不变”)
Ⅰ.制取氢气
(1)甲醇和水蒸气制取氢气的过程中有下列反应:
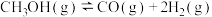
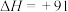 kJ·mol
kJ·mol

 kJ·mol
kJ·mol
写出以甲醇为原料制取氢气的热化学方程式
(2)理论上,能提高
 平衡产率的措施有
平衡产率的措施有Ⅱ.储存氢气
硼氢化钠(
 )是研究最广泛的储氢材料之一
)是研究最广泛的储氢材料之一已知:
i.B的电负性为2.0,H的电负性为2.1
ii.25℃下
 在水中的溶解度为55 g,
在水中的溶解度为55 g, 在水中的溶解度为0.28 g
在水中的溶解度为0.28 g(3)在配制
 溶液时,为了防止发生水解反应,可以加入少量的
溶液时,为了防止发生水解反应,可以加入少量的(4)向
 水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠(
水溶液中加入催化剂Ru/NGR后,能够迅速反应,生成偏硼酸钠( )和氢气。写出该反应的化学方程式
)和氢气。写出该反应的化学方程式(5)在研究浓度对催化剂Ru/NGR活性的影响时,发现B点后(见图1)增加
 的浓度,制氢速率反而下降,推断可能的原因是
的浓度,制氢速率反而下降,推断可能的原因是
(6)用惰性电极电解
 溶液可制得
溶液可制得 ,实现物质的循环使用,制备装置如图2所示。
,实现物质的循环使用,制备装置如图2所示。
①钛电极的电极反应式是
②电解过程中,阴极区溶液pH
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】还原法处理氮的氧化物是环境保护的热门课题。
Ⅰ.CO还原法:
(1)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh作催化剂时该反应的过程示意图如下:
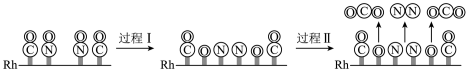
已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,则该反应的热化学方程式为_______ 。
Ⅱ.焦炭还原法:
(2)用焦炭还原 的反应为:
的反应为: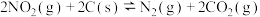 ∆H>0。
∆H>0。
①在一定条件下,下列事实一定能证明该反应已经达到平衡状态的是_______ 。
A.恒温恒容条件下,
B.绝热恒容条件下,体系的温度不再改变
C.恒温恒压条件下,混合气体密度不再改变
D.恒温恒容条件下, 与
与 的体积比不再改变
的体积比不再改变
②在恒温条件下,1mol 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压强的关系如图所示,则A、B两点的反应速率关系为v(A)
的物质的量浓度与平衡总压强的关系如图所示,则A、B两点的反应速率关系为v(A) _______ v(B)(填“>”、“<”或“=”),C点时该反应的分压平衡常数
_______ ( 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。

③下列措施既能加快反应速率,又能提高平衡转化率的是_______ 。
A.升高温度 B.增加炭的用量 C.增大压强 D.使用催化剂
Ⅲ. 还原法:
还原法:
(3)以氨气作还原剂,可除去烟气中的氮氧化物。其中除去NO的反应原理如下: ∆H=-1980kJ/mol,反应速率与浓度之间存在如下关系:
∆H=-1980kJ/mol,反应速率与浓度之间存在如下关系: ,
,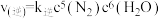 ,k正,k逆为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入0.9mol
,k正,k逆为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入0.9mol  和1.2mol
和1.2mol  发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下
发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下
_______ ;温度升高时,k正增大m倍,k逆增大n倍,则m_______ n(填“>”、“<”或“=”)。
Ⅰ.CO还原法:
(1)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh作催化剂时该反应的过程示意图如下:

已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,则该反应的热化学方程式为
Ⅱ.焦炭还原法:
(2)用焦炭还原
 的反应为:
的反应为: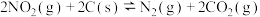 ∆H>0。
∆H>0。①在一定条件下,下列事实一定能证明该反应已经达到平衡状态的是
A.恒温恒容条件下,

B.绝热恒容条件下,体系的温度不再改变
C.恒温恒压条件下,混合气体密度不再改变
D.恒温恒容条件下,
 与
与 的体积比不再改变
的体积比不再改变②在恒温条件下,1mol
 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压强的关系如图所示,则A、B两点的反应速率关系为v(A)
的物质的量浓度与平衡总压强的关系如图所示,则A、B两点的反应速率关系为v(A) 
 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
③下列措施既能加快反应速率,又能提高平衡转化率的是
A.升高温度 B.增加炭的用量 C.增大压强 D.使用催化剂
Ⅲ.
 还原法:
还原法:(3)以氨气作还原剂,可除去烟气中的氮氧化物。其中除去NO的反应原理如下:
 ∆H=-1980kJ/mol,反应速率与浓度之间存在如下关系:
∆H=-1980kJ/mol,反应速率与浓度之间存在如下关系: ,
,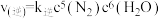 ,k正,k逆为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入0.9mol
,k正,k逆为速率常数,只受温度影响。350℃时,在2L恒容密闭容器中,通入0.9mol  和1.2mol
和1.2mol  发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下
发生反应,保持温度不变,平衡时NO的转化率为50%,则此温度下
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】为了实现“碳中和”、“碳达峰”,氢气是一种理想的绿色能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知:①乙醇、水蒸气重整制氢的部分反应过程如图1所示。

②反应Ⅰ和反应Ⅱ的平衡常数(K)随温度(T)的变化曲线如图2所示。

(1)反应Ⅰ中,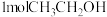 参与反应后的热量变化是
参与反应后的热量变化是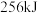 ,则该反应的热化学方程式为
,则该反应的热化学方程式为___________ 。
(2)一定温度下,在一恒容密闭容器中发生反应Ⅰ,下列叙述能说明此反应达到化学平衡状态的是___________(填标号)。
(3)在一恒容密闭容器中按不同进料比通入 与
与 发生反应Ⅱ,在不同温度时测得
发生反应Ⅱ,在不同温度时测得 的平衡转化率如图3所示。
的平衡转化率如图3所示。

①B、C两点对应的反应温度分别为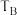 和
和 ,则
,则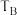
___________  (填“<”“=”或“>”)。
(填“<”“=”或“>”)。
②A点对应温度下,反应Ⅱ的化学平衡常数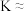
___________ 。
③若向A点对应的平衡体系中再充入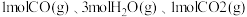 和
和 ,此时平衡向
,此时平衡向___________ (填“正反应”或“逆反应”)方向移动。
④其他条件不变,下列措施可以增大平衡时的 的体积分数的是
的体积分数的是___________ (填标号)。
A.投入一定量的 B.增大压强 C.降低温度
B.增大压强 C.降低温度
已知:①乙醇、水蒸气重整制氢的部分反应过程如图1所示。

②反应Ⅰ和反应Ⅱ的平衡常数(K)随温度(T)的变化曲线如图2所示。

(1)反应Ⅰ中,
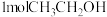 参与反应后的热量变化是
参与反应后的热量变化是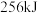 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)一定温度下,在一恒容密闭容器中发生反应Ⅰ,下列叙述能说明此反应达到化学平衡状态的是___________(填标号)。
A. |
| B.混合气体压强不再发生变化 |
C.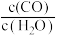 不再发生变化 不再发生变化 |
| D.混合气体密度不再发生变化 |
 与
与 发生反应Ⅱ,在不同温度时测得
发生反应Ⅱ,在不同温度时测得 的平衡转化率如图3所示。
的平衡转化率如图3所示。
①B、C两点对应的反应温度分别为
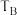 和
和 ,则
,则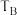
 (填“<”“=”或“>”)。
(填“<”“=”或“>”)。②A点对应温度下,反应Ⅱ的化学平衡常数
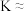
③若向A点对应的平衡体系中再充入
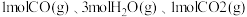 和
和 ,此时平衡向
,此时平衡向④其他条件不变,下列措施可以增大平衡时的
 的体积分数的是
的体积分数的是A.投入一定量的
 B.增大压强 C.降低温度
B.增大压强 C.降低温度
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ:氨热分解法制氢气。相关化学键的键能数据如下:
一定温度下,利用催化剂将 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:
(1)反应

___________  。
。
(2)此反应在___________ (填“高温”或“低温”)条件下能自发进行。
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,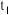 时反应达到平衡,用
时反应达到平衡,用 的压强变化表示0~
的压强变化表示0~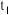 时间内的反应速率
时间内的反应速率
___________ Kpa/min(用含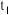 的代数式表示)。
的代数式表示)。
②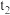 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是___________ (用图中a、b、c、d表示),理由是___________ 。
③在该温度下,反应的标准平衡常数
___________ 。(已知:分压=总压×该组分物质的量分数,对于反应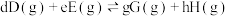 ,
,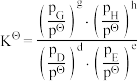 ,其中
,其中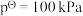 ,
, 、
、 、
、 、
、 为各级分的平衡分压。)
为各级分的平衡分压。)
方法Ⅰ:氨热分解法制氢气。相关化学键的键能数据如下:
| 化学键 | N≡N | H—H | N—H |
键能( ) ) | 946.0 | 436.0 | 390.8 |
 分解为
分解为 和
和 。回答下列问题:
。回答下列问题:(1)反应


 。
。(2)此反应在
(3)某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将0.1mol
 通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
通入3L的密闭容器中进行反应(此时容器内总压为200kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,
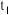 时反应达到平衡,用
时反应达到平衡,用 的压强变化表示0~
的压强变化表示0~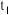 时间内的反应速率
时间内的反应速率
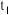 的代数式表示)。
的代数式表示)。②
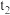 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
分压变化趋势的曲线是③在该温度下,反应的标准平衡常数

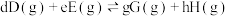 ,
,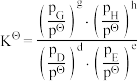 ,其中
,其中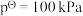 ,
, 、
、 、
、 、
、 为各级分的平衡分压。)
为各级分的平衡分压。)
您最近一年使用:0次



