氨是一种重要化工产品,研究有关氨反应规律具有重要意义。 的催化氧化是工业制备硝酸的重要反应。
的催化氧化是工业制备硝酸的重要反应。
(1)已知氨催化氧化时会发生如下两个竞争反应Ⅰ、Ⅱ
反应Ⅰ: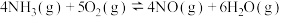

反应Ⅱ:

在反应过程中,上述反应Ⅰ和Ⅱ的能量变化如图甲、乙所示: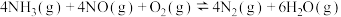 的
的
_______ 
(2)为了研究不同催化剂和温度对该反应的选择性影响,在1L密闭容器中充入2mol 和3mol
和3mol ,发生上述竞争反应Ⅰ和Ⅱ.在相同时间段内,测得不同催化剂对应
,发生上述竞争反应Ⅰ和Ⅱ.在相同时间段内,测得不同催化剂对应 的选择性变化如图丙所示,在最优催化剂下进行反应时,生成
的选择性变化如图丙所示,在最优催化剂下进行反应时,生成 、NO的
、NO的 的转化率随温度的变化如图丁所示[已知:ⅰ.
的转化率随温度的变化如图丁所示[已知:ⅰ. 的选择性=
的选择性=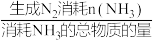 ;ⅱ.C点及以后两反应均达到平衡状态]
;ⅱ.C点及以后两反应均达到平衡状态]_______ 、_______ 。C点后NO的产率下降的原因是_______ ,硝酸溶液中,酸根阴离子的空间构型为_______
②下列叙述中能说明反应Ⅰ达到平衡状态的是_______ (填标号)
A.混合体系中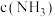 、
、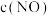 保持不变
保持不变
B.反应速率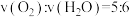
C.混合气体的密度不再变化
③C点对应温度下,反应Ⅰ的平衡常数为
_______ (列出计算式即可)
④若反应25min到达C点,在0~25min内用 表示的速率
表示的速率
_______ 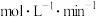
 的催化氧化是工业制备硝酸的重要反应。
的催化氧化是工业制备硝酸的重要反应。(1)已知氨催化氧化时会发生如下两个竞争反应Ⅰ、Ⅱ
反应Ⅰ:
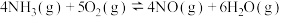

反应Ⅱ:


在反应过程中,上述反应Ⅰ和Ⅱ的能量变化如图甲、乙所示:
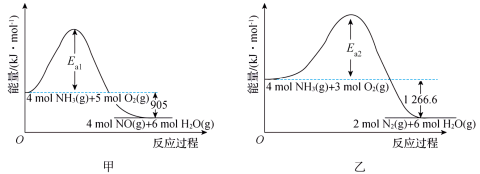
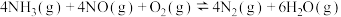 的
的

(2)为了研究不同催化剂和温度对该反应的选择性影响,在1L密闭容器中充入2mol
 和3mol
和3mol ,发生上述竞争反应Ⅰ和Ⅱ.在相同时间段内,测得不同催化剂对应
,发生上述竞争反应Ⅰ和Ⅱ.在相同时间段内,测得不同催化剂对应 的选择性变化如图丙所示,在最优催化剂下进行反应时,生成
的选择性变化如图丙所示,在最优催化剂下进行反应时,生成 、NO的
、NO的 的转化率随温度的变化如图丁所示[已知:ⅰ.
的转化率随温度的变化如图丁所示[已知:ⅰ. 的选择性=
的选择性=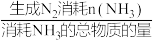 ;ⅱ.C点及以后两反应均达到平衡状态]
;ⅱ.C点及以后两反应均达到平衡状态]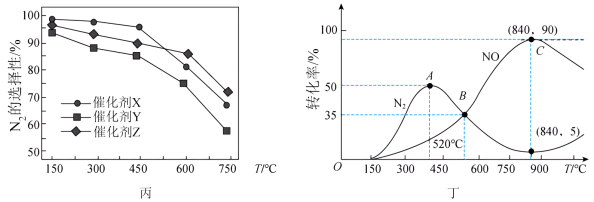
②下列叙述中能说明反应Ⅰ达到平衡状态的是
A.混合体系中
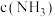 、
、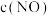 保持不变
保持不变B.反应速率
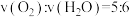
C.混合气体的密度不再变化
③C点对应温度下,反应Ⅰ的平衡常数为

④若反应25min到达C点,在0~25min内用
 表示的速率
表示的速率
2023·河北衡水·三模 查看更多[3]
更新时间:2023-06-21 18:21:22
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】雾霾主要成分为灰尘、 、
、 、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
(1)以氨气为脱硝剂时,可将 还原为
还原为 。
。
已知:
ⅰ.
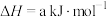
ⅱ.
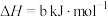
则反应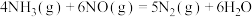 的
的
_______  。
。
(2)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为: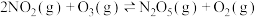
 。某温度时,在体积为1L的刚性密闭容器中充入2mol
。某温度时,在体积为1L的刚性密闭容器中充入2mol  和1mol
和1mol  发生反应。
发生反应。
①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是_______ (填标号)。
A. 的消耗速率与
的消耗速率与 的消耗速率相等 B.混合气体压强不再改变
的消耗速率相等 B.混合气体压强不再改变
C.混合气体的平均相对分子质量保持不变 D. 与
与 的物质的量浓度相等
的物质的量浓度相等
②欲增加 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有_______ (填标号)。
A.充入氦气 B.升高温度
C.充入2mol D.充入2mol
D.充入2mol  和1mol
和1mol 
③达到平衡时,混合气体总压为p, 的浓度为0.5
的浓度为0.5 ,则
,则 的转化率为
的转化率为_______ ,平衡常数
_______ (以分压表示,分压=总压×物质的量分数)。
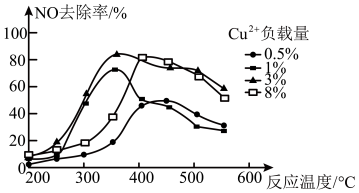
(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中 负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为
负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为_______ , 负载量为
负载量为_______ 。
 、
、 、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。
、有机碳氢化合物等粒子。烟气脱硝是治理雾霾的方法之一。(1)以氨气为脱硝剂时,可将
 还原为
还原为 。
。已知:
ⅰ.

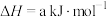
ⅱ.

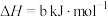
则反应
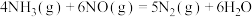 的
的
 。
。(2)臭氧也是理想的烟气脱硝剂,其脱硝反应之一为:
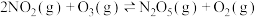
 。某温度时,在体积为1L的刚性密闭容器中充入2mol
。某温度时,在体积为1L的刚性密闭容器中充入2mol  和1mol
和1mol  发生反应。
发生反应。①在恒温恒容条件下,下列事实能够证明该反应已经达到平衡的是
A.
 的消耗速率与
的消耗速率与 的消耗速率相等 B.混合气体压强不再改变
的消耗速率相等 B.混合气体压强不再改变C.混合气体的平均相对分子质量保持不变 D.
 与
与 的物质的量浓度相等
的物质的量浓度相等②欲增加
 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有A.充入氦气 B.升高温度
C.充入2mol
 D.充入2mol
D.充入2mol  和1mol
和1mol 
③达到平衡时,混合气体总压为p,
 的浓度为0.5
的浓度为0.5 ,则
,则 的转化率为
的转化率为
(3)乙烯也可用于烟气脱硝。为研究温度、催化剂中
 负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为
负载量对NO去除率的影响,控制其它条件一定,实验结果如图所示。为达到最高的NO去除率,应选择的反应温度约为 负载量为
负载量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】Ⅰ.用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
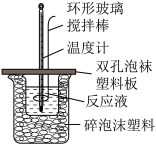
(1)烧杯间填满碎泡沫塑料的作用是______________ ;
(2)环形玻璃搅拌棒_______ (填“能”或“不能”)用环形铁质搅拌棒代替,其原因是________ ;
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是___________ 。实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:________ 。
Ⅱ.FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是___________ 。

(1)烧杯间填满碎泡沫塑料的作用是
(2)环形玻璃搅拌棒
(3)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是
(4)已知在稀溶液中,强酸和强碱发生中和反应生成1 mol H2O时,放出57.3 kJ的热量,则上述反应的热化学方程式为:
Ⅱ.FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25℃,101 kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480 kJ·mol-1
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】合成氨工业中的原料气制取与净化是重要的环节。
(1)已知有关反应的能量变化如图1:写出 与
与 反应制取
反应制取 和
和 的热化学方程式:
的热化学方程式:______ 。
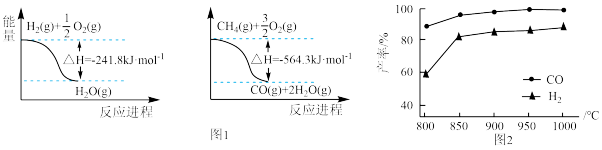
(2)“ 催化重整法”制氢气:
催化重整法”制氢气: ,
, 不仅可以得到合成气
不仅可以得到合成气 和
和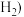 ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
①根据键能计算,该反应的
______  。
。
②按一定体积比加入 和
和 ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和 产率的影响如图2所示。实际生产中此反应优选温度为900℃,不选1000℃的原因是
产率的影响如图2所示。实际生产中此反应优选温度为900℃,不选1000℃的原因是______ 。
③某温度下,将 、
、 以及催化剂进行加入
以及催化剂进行加入 容器中,达到平衡时
容器中,达到平衡时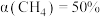 ,平衡常数
,平衡常数
______  。
。
(3)合成气在进入合成塔前常用醋酸二氨合铜 Ⅰ
Ⅰ 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是: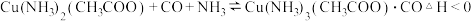 ,必须除去原料气中CO的原因是
,必须除去原料气中CO的原因是______ 。醋酸二氨合铜 Ⅰ
Ⅰ 吸收CO的生产适宜条件应是
吸收CO的生产适宜条件应是______  填序号
填序号 。
。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(1)已知有关反应的能量变化如图1:写出
 与
与 反应制取
反应制取 和
和 的热化学方程式:
的热化学方程式: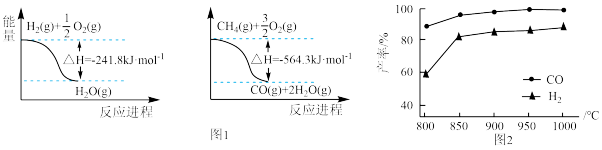
(2)“
 催化重整法”制氢气:
催化重整法”制氢气: ,
, 不仅可以得到合成气
不仅可以得到合成气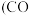 和
和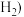 ,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。
,还对温室气体的减排具有重要意义。上述反应中相关的化学键键能数据如表所示。①根据键能计算,该反应的

 。
。| 化学键 | C-H | C=O | H-H | 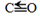 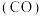 |
| 键能kJ/mol | 413 | 745 | 436 | 1075 |
 和
和 ,在恒压下发生反应,温度对CO和
,在恒压下发生反应,温度对CO和 产率的影响如图2所示。实际生产中此反应优选温度为900℃,不选1000℃的原因是
产率的影响如图2所示。实际生产中此反应优选温度为900℃,不选1000℃的原因是③某温度下,将
 、
、 以及催化剂进行加入
以及催化剂进行加入 容器中,达到平衡时
容器中,达到平衡时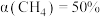 ,平衡常数
,平衡常数
 。
。(3)合成气在进入合成塔前常用醋酸二氨合铜
 Ⅰ
Ⅰ 溶液来吸收其中的CO杂质,其反应是:
溶液来吸收其中的CO杂质,其反应是: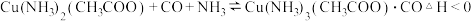 ,必须除去原料气中CO的原因是
,必须除去原料气中CO的原因是 Ⅰ
Ⅰ 吸收CO的生产适宜条件应是
吸收CO的生产适宜条件应是 填序号
填序号 。
。A.高温高压 B.高温低压 C.低温高压 D.低温低压
您最近一年使用:0次
【推荐1】CO2是造成全球气候变暖的主要气体,同时也是一种来源丰富、价格低廉的碳资源。中科院福建物构所谢奎及其团队利用电能将CO2高效转化为CO,CO和H2可生产优质燃料和多种化工产品,实现碳资源的循环利用。
(1)已知反应过程中能量变化如下表和曲线图所示:
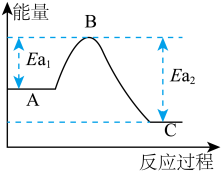
反应③ 的ΔH3=_________ kJ/mol。
CO(g) + 2H2(g) CH3OH(l) ΔH4=
CH3OH(l) ΔH4=_______ kJ/mol;此反应中,有利于提高H2平衡转化率的条件是_______ (填字母)。
A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在不同的电压下,CO2、H2O混合电解转化为CO、H2的电流效率如图所示(注:电流效率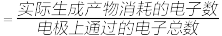 ×100%):
×100%):
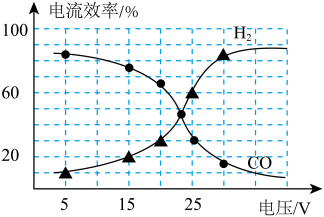
①由图可知生成CO和H2有相互_______ (填“促进”、“抑制”或“无影响”)作用。
②用此法生产的CO和H2合成CH3OH,为使CO和H2利用率最高,电解时应控制电压在________ V左右(选填5、15、23、25、30)。
(3)在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,在恒温恒容下发生反应CO(g) + 2H2(g) CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
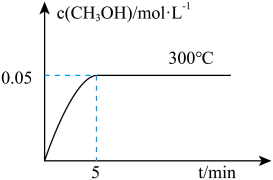
①图中判断反应到达平衡状态的依据是________________ 。
② 5min内H2的平均反应速率v(H2) =________ mol/(L•min)。
③ 若在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时反应将_______ (填字母)。
A.正反应方向反应 B.逆反应方向反应
C.达到平衡 D.无法判断
(1)已知反应过程中能量变化如下表和曲线图所示:

| 反应 | A | C | Ea1(kJ/mol) | Ea2(kJ/mol) | ΔH(kJ/mol) |
| ① | 2CO(g)+O2(g) | 2CO2(g) | ? | 2389 | -566 |
| ② | 2H2(g)+O2(g) | 2H2O(l) | 1480 | ? | -571.6 |
| ③ | 2CH3OH(l)+3O2(g) | 2CO2(g)+4H2O(l) | 3026 | 4478 | ΔH3 |
CO(g) + 2H2(g)
 CH3OH(l) ΔH4=
CH3OH(l) ΔH4=A.高温低压 B.低温高压
C.高温高压 D.低温低压
(2)在不同的电压下,CO2、H2O混合电解转化为CO、H2的电流效率如图所示(注:电流效率
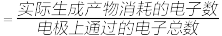 ×100%):
×100%):
①由图可知生成CO和H2有相互
②用此法生产的CO和H2合成CH3OH,为使CO和H2利用率最高,电解时应控制电压在
(3)在300℃时,将0.60molCO、1.40molH2充入4L密闭容器中,在恒温恒容下发生反应CO(g) + 2H2(g)
 CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
CH3OH(g) △H<0,甲醇的物质的量浓度随时间的变化如图所示:
①图中判断反应到达平衡状态的依据是
② 5min内H2的平均反应速率v(H2) =
③ 若在500℃条件下,将1.00molCO、0.50mol H2和0.50mol CH3OH充入容积为2L的密闭容器中,此时反应将
A.正反应方向反应 B.逆反应方向反应
C.达到平衡 D.无法判断
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】高锰酸钾是一种强氧化剂,在化学实验中被大量使用。某研究性学习小组用高锰酸钾进行系列实验。
I.用草酸溶液与酸性高锰酸钾溶液的反应来探究“外界条件改变对化学反应速率的影响”,相关实验数据如下表所示:
(1)反应的化学方程式为___________ 。
(2)通过实验ii、iii,可探究___________ (填外界条件)对化学反应速率的影响,则
___________ ,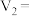
___________ 。
(3)忽略溶液体积的变化,利用实验ii中数据计算,0~8s内用KMnO4的浓度变化表示的反应速率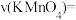
___________  (保留2位有效数字)。
(保留2位有效数字)。
(4)研究小组的同学在实验中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后突然加快。查阅资料获悉,H2C2O4与酸性KMnO4溶液反应的一种机理如下图所示:
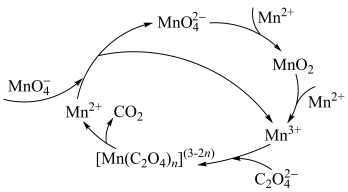
①由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为___________ 。
②若用实验证明①的推测,除了酸性KMnO4溶液和H2C2O4溶液外,还需要选择的试剂为___________ (填选项字母)。
a. b.
b. c.
c.
Ⅱ.用酸性KMnO4标准溶液测定血液中Ca2+的浓度。实验步骤如下:
i.将2.00mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀分离、净化后,用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4,溶液用 酸性KMnO4标准液滴定。
酸性KMnO4标准液滴定。
iii.滴定终点时,用去KMnO4溶液bmL。
(5)盛放KMnO4溶液所使用的滴定管为___________ (填“酸式”或“碱式”)滴定管,该滴定管在滴定前排尽尖嘴处气泡的操作为___________ (填选项字母)。
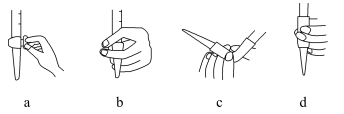
(6)滴定至终点时的现象为___________ 。
(7)血液中Ca2+的浓度为___________  (用含a、b的式子表示)。
(用含a、b的式子表示)。
I.用草酸溶液与酸性高锰酸钾溶液的反应来探究“外界条件改变对化学反应速率的影响”,相关实验数据如下表所示:
| 实验序号 | 实验温度/℃ | 所加试剂及其用量/mL | 溶液颜色褪至无色所需时间/s | ||
| 0.02mol/L 酸性KMnO4溶液 | 0.10mol/L H2C2O4溶液 | H2O | |||
| i | 20 | 2.0 | 4.0 | 0 |  |
| ii | 20 | 2.0 | 3.0 |  | 8 |
| iii | 40 | 2.0 |  | 1.0 |  |
(1)反应的化学方程式为
(2)通过实验ii、iii,可探究

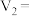
(3)忽略溶液体积的变化,利用实验ii中数据计算,0~8s内用KMnO4的浓度变化表示的反应速率
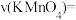
 (保留2位有效数字)。
(保留2位有效数字)。(4)研究小组的同学在实验中观察到KMnO4溶液褪色速率开始时较慢,反应一段时间后突然加快。查阅资料获悉,H2C2O4与酸性KMnO4溶液反应的一种机理如下图所示:

①由图示机理分析,反应一段时间后溶液褪色速率突然加快的原因可能为
②若用实验证明①的推测,除了酸性KMnO4溶液和H2C2O4溶液外,还需要选择的试剂为
a.
 b.
b. c.
c.
Ⅱ.用酸性KMnO4标准溶液测定血液中Ca2+的浓度。实验步骤如下:
i.将2.00mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀分离、净化后,用稀硫酸处理得H2C2O4溶液。
ii.将i得到的H2C2O4,溶液用
 酸性KMnO4标准液滴定。
酸性KMnO4标准液滴定。iii.滴定终点时,用去KMnO4溶液bmL。
(5)盛放KMnO4溶液所使用的滴定管为

(6)滴定至终点时的现象为
(7)血液中Ca2+的浓度为
 (用含a、b的式子表示)。
(用含a、b的式子表示)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】SO2和NOx是主要的大气污染物。某学习小组认为一定条件下,用NH3与NO2反应转化为无污染物质可进行汽车尾气无害化处理。
(1)写出实验室制取氨气的化学方程式为____ 。
(2)将NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好),烧杯Z中盛装NaOH溶液(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O),在一定温度下按如图装置进行实验。_____ 。
②将注射器活塞退回原处并固定,待装置恢复到室温。打开K2,Z中NaOH溶液产生倒吸现象,原因是_____ 。
(3)利用(2)中装置探究SO2能否与Na2O2发生氧化还原反应。将Y中的药品更换为少量Na2O2,将注射器X中SO2缓慢推入Y中,Y装置中的现象为_____ 。
(4)100℃时,在2L密闭容器中发生反应N2O4(g) 2NO2(g),各气体浓度随时间变化的情况如图所示。
2NO2(g),各气体浓度随时间变化的情况如图所示。____ 。
②已知NO2(g)与SO2(g)发生可逆反应:NO2(g)+SO2(g) SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是
SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是____ 。
a.只要经过足够长的时间,可使c(SO2)=0
b.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
c.达到平衡状态时,各物质的物质的量浓度相等
d.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
(1)写出实验室制取氨气的化学方程式为
(2)将NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好),烧杯Z中盛装NaOH溶液(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O),在一定温度下按如图装置进行实验。
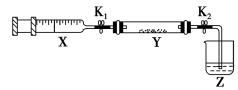
②将注射器活塞退回原处并固定,待装置恢复到室温。打开K2,Z中NaOH溶液产生倒吸现象,原因是
(3)利用(2)中装置探究SO2能否与Na2O2发生氧化还原反应。将Y中的药品更换为少量Na2O2,将注射器X中SO2缓慢推入Y中,Y装置中的现象为
(4)100℃时,在2L密闭容器中发生反应N2O4(g)
 2NO2(g),各气体浓度随时间变化的情况如图所示。
2NO2(g),各气体浓度随时间变化的情况如图所示。
②已知NO2(g)与SO2(g)发生可逆反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是
SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是a.只要经过足够长的时间,可使c(SO2)=0
b.每消耗1molSO2,同时生成1molNO2,说明该反应达到平衡状态
c.达到平衡状态时,各物质的物质的量浓度相等
d.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】化学反应伴随着能量变化,研究化学反应中的能量变化具有重大意义。请回答下列问题:
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:
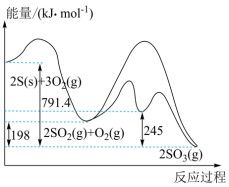
(1)表示 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为______ 。
(2)对于反应 :
:
①______ (填“低温”、“高温”或“任意温度”)有利于该反应正向自发进行。
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是______ (填标号)。
A.升高温度 B.压缩容器体积 C.增大 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。
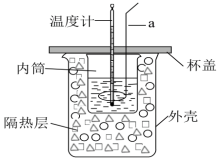
实验步骤:
①量取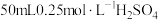 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;
②量取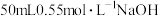 溶液,测量温度;
溶液,测量温度;
③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为______ ,使用的溶液稍微过量的原因是______ 。
(4)实验数据记录:
(5)实验过程中,向 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
______ (填“偏大”或“偏小”,下同);若用 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
______ 。
Ⅰ.硫与硫的氧化物转化过程中能量变化如图所示:

(1)表示
 的燃烧热的热化学方程式为
的燃烧热的热化学方程式为(2)对于反应
 :
:①
②在一密闭容器中仅发生该反应,下列措施有利于提高的平衡转化率的是
A.升高温度 B.压缩容器体积 C.增大
 浓度 D.再充入一定量的
浓度 D.再充入一定量的
Ⅱ.某化学兴趣小组利用如图装置进行中和反应反应热的测定实验。

实验步骤:
①量取
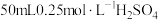 ,溶液倒入小烧杯中,测量温度;
,溶液倒入小烧杯中,测量温度;②量取
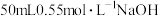 溶液,测量温度;
溶液,测量温度;③将溶液倒入小烧杯中,混合均匀后测量混合液温度。
(3)仪器a的名称为
(4)实验数据记录:
实验次数 | 反应物的初始温度/℃ | 反应后体系的温度/℃ | ||
H2SO4溶液 | NaOH溶液 | 平均值 | ||
1 | 25.2 | 25.4 | 28.6 | |
2 | 24.9 | 25.1 | 28.4 | |
3 | 25.3 | 25.3 | 28.0 | |
4 | 25.0 | 25.2 | 28.3 | |
设实验所用的酸、碱溶液的密度均为 ,反应前后溶液的比热容
,反应前后溶液的比热容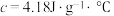 。计算该实验的
。计算该实验的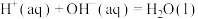

 。
。
(5)实验过程中,向
 溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
溶液中加碱时,分多次加入NaOH溶液,将会导致测得的
 氨水代替NaOH溶液,将会导致测得的
氨水代替NaOH溶液,将会导致测得的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氨是最重要的氮肥,也是产量最大的化工产品之一。
Ⅰ.合成氨工艺是人工固氮的重要途径。
(1)可用作合成氨的催化剂有很多,如Os,Fe,Pt,Mn,Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:
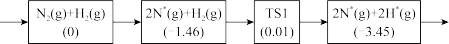
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV),TS 表示过渡态,*表示吸附态。
①写出N2参与化学吸附的反应方程式_______ 。
②以上历程须克服的最大能垒为_______ eV。
(2)在使用同一催化剂时,将2.0molN2和6.0molH2通入体积为2L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T1温度下n(H2)的变化(a点恰好达到平衡),曲线B表示T2温度下n(NH3)的变化。
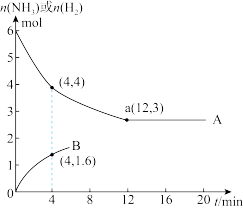
①T1温度下,该反应的化学平衡常数K=_______ 。
②T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的85%,则此时v(正)_______ v(逆)(填“>”、“<”或“=”)。
③能否由图中数据得出温度T1和T2的大小关系,并说明理由_______ 。
Ⅱ.液氨是一种应用广泛的非水溶剂,以氨为原料可以合成很多重要化合物。
(3)Arrhenius提出:溶剂在液态下能自发发生电离,产生溶剂阳离子与溶剂阴离子的现象,称为自耦电离,如液态水的自耦电离方程式为:2H2O H3O++OH-。在液氨中也存在类似的自耦电离,试写出液氨中NH4Cl与NaNH2反应的离子方程式
H3O++OH-。在液氨中也存在类似的自耦电离,试写出液氨中NH4Cl与NaNH2反应的离子方程式_______ 。
(4)如图是20℃时,NH3-CO2-H2O 三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。20℃时,可根据需要,选择水溶液体系反应得到(NH4)2CO3(aq)与NH4HCO3(aq),也可选择无水体系反应得到NH4COONH2(s)。
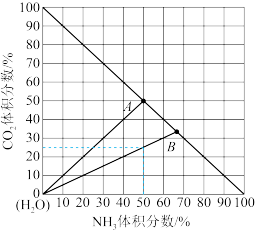
①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq) 的最佳曲线是_______ (填“A-H2O”或B-H2O”)。
②B点可得到的产品是_______ (填化学式)。
Ⅰ.合成氨工艺是人工固氮的重要途径。
(1)可用作合成氨的催化剂有很多,如Os,Fe,Pt,Mn,Co等金属及相应的合金或化合物。该反应在LaCoSi催化作用的化学吸附及初步表面反应历程如下:
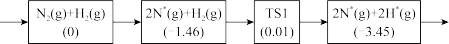
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字单位:eV),TS 表示过渡态,*表示吸附态。
①写出N2参与化学吸附的反应方程式
②以上历程须克服的最大能垒为
(2)在使用同一催化剂时,将2.0molN2和6.0molH2通入体积为2L的密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T1温度下n(H2)的变化(a点恰好达到平衡),曲线B表示T2温度下n(NH3)的变化。

①T1温度下,该反应的化学平衡常数K=
②T2温度下反应进行到某时刻,测得容器内气体的压强为起始时的85%,则此时v(正)
③能否由图中数据得出温度T1和T2的大小关系,并说明理由
Ⅱ.液氨是一种应用广泛的非水溶剂,以氨为原料可以合成很多重要化合物。
(3)Arrhenius提出:溶剂在液态下能自发发生电离,产生溶剂阳离子与溶剂阴离子的现象,称为自耦电离,如液态水的自耦电离方程式为:2H2O
 H3O++OH-。在液氨中也存在类似的自耦电离,试写出液氨中NH4Cl与NaNH2反应的离子方程式
H3O++OH-。在液氨中也存在类似的自耦电离,试写出液氨中NH4Cl与NaNH2反应的离子方程式(4)如图是20℃时,NH3-CO2-H2O 三元体系相图。纵坐标代表CO2的体积分数,横坐标代表NH3的体积分数,坐标原点代表液态纯水。20℃时,可根据需要,选择水溶液体系反应得到(NH4)2CO3(aq)与NH4HCO3(aq),也可选择无水体系反应得到NH4COONH2(s)。

①20℃时,利用NH3(g)、CO2(g)和H2O(l)制备NH4HCO3(aq) 的最佳曲线是
②B点可得到的产品是
您最近一年使用:0次
【推荐3】我国提出争取在2030年前实现碳达峰,2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。回答下列问题:
(1)若
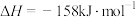 。已知有关物质的化学键键能数据如下表:
。已知有关物质的化学键键能数据如下表:
则 的键能
的键能
______  。
。
(2)利用 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气 充入2L恒容密闭容器中,只发生
充入2L恒容密闭容器中,只发生
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应 时
时 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:

①若起始时CO2和H2的物质的量分别为1.5mol、4.5mol。2min末反应达到平衡,此时测得水和甲醇的物质的量之和为1.0mol,则此时容器内氢气的体积分数为______ 。
②图中e点,
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列说法错误的是______ (填字母)。
A.当温度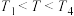 时,选择催化剂Ⅰ
时,选择催化剂Ⅰ  的转化率更高
的转化率更高
B.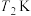 的平衡常数大于
的平衡常数大于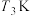 的平衡常数
的平衡常数
C.若容器内混合气体的密度不再变化时,该反应已达到平衡状态
D.c点转化率比a点低的原因一定是温度升高平衡逆向移动, 转化率降低
转化率降低
(3)工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。温度T时,在容积不变的密闭容器中充入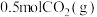 和
和 ,起始压强为
,起始压强为 ,10min达平衡时生成
,10min达平衡时生成 ,测得压强为
,测得压强为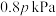 。
。
Ⅰ.

Ⅱ.

①若反应速率用单位时间内分压变化表示,则10min内生成H2O的反应速率 为
为______  。
。
②计算出反应Ⅱ的平衡常数
______ ( 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
(4)将CH4与CO2利用电解装置进行耦合转化,其原理示意如图所示:
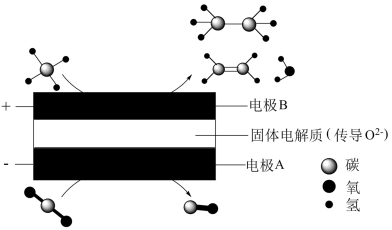
①电池工作时,电极A的电极反应式为____________ 。
②若两极恰好消耗标准状况下33.6LCH4和22.4LCO2,则生成乙烷的物质的量为______ mol。
(1)若

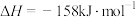 。已知有关物质的化学键键能数据如下表:
。已知有关物质的化学键键能数据如下表:化学键 |
|
|
|
|
|
键能/( | 436 | 343 | a | 413 | 465 |
 的键能
的键能
 。
。(2)利用
 合成甲醇也是有效利用
合成甲醇也是有效利用 资源的重要途径。将原料气
资源的重要途径。将原料气 充入2L恒容密闭容器中,只发生
充入2L恒容密闭容器中,只发生
 ,在不同催化剂作用下,反应
,在不同催化剂作用下,反应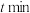 时
时 的转化率随温度的变化如图所示:
的转化率随温度的变化如图所示:
①若起始时CO2和H2的物质的量分别为1.5mol、4.5mol。2min末反应达到平衡,此时测得水和甲醇的物质的量之和为1.0mol,则此时容器内氢气的体积分数为
②图中e点,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列说法错误的是
A.当温度
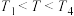 时,选择催化剂Ⅰ
时,选择催化剂Ⅰ  的转化率更高
的转化率更高B.
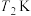 的平衡常数大于
的平衡常数大于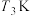 的平衡常数
的平衡常数C.若容器内混合气体的密度不再变化时,该反应已达到平衡状态
D.c点转化率比a点低的原因一定是温度升高平衡逆向移动,
 转化率降低
转化率降低(3)工业上在Cu-ZnO催化下利用CO2发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。温度T时,在容积不变的密闭容器中充入
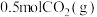 和
和 ,起始压强为
,起始压强为 ,10min达平衡时生成
,10min达平衡时生成 ,测得压强为
,测得压强为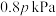 。
。Ⅰ.


Ⅱ.


①若反应速率用单位时间内分压变化表示,则10min内生成H2O的反应速率
 为
为 。
。②计算出反应Ⅱ的平衡常数

 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)。(4)将CH4与CO2利用电解装置进行耦合转化,其原理示意如图所示:

①电池工作时,电极A的电极反应式为
②若两极恰好消耗标准状况下33.6LCH4和22.4LCO2,则生成乙烷的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】合成氨工艺是人工固氮的重要途径,解决了数亿人口生存问题。
(1)已知:①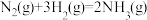

②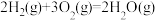
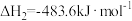
则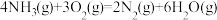
 =
=___________ 。
(2)合成氨的反应历程可表示如下:
第一步: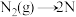 ;
;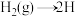 (慢反应)
(慢反应)
第二步: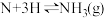 (快反应)
(快反应)
①第一步反应的活化能大于第二步反应的活化能,理由是___________ 。
②下列关于合成氨反应条件的选择是利用勒夏特列原理的是___________ (填序号)。
A.选择400~500℃ B.选择10~30MPa
C.使用铁触媒催化剂 D.及时分离出氨气
(3)在一定条件下,向某反应容器中充入1molN2、3molH2在不同温度下反应,平衡体系中氨的物质的量分数随压强变化的曲线如图所示:
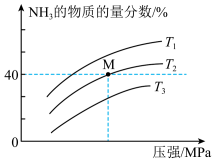
温度T1、T2、T3由高到低的顺序为___________ ,M点H2的平衡转化率为___________ %(保留一位小数)。
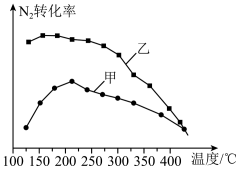
(4)将N2和H2以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定N2的转化率,结果如图所示,则在合理的温度下,___________ (填“甲”或“乙”)催化剂的催化效果更好。
(1)已知:①
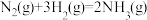

②
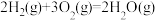
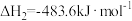
则
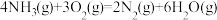
 =
=(2)合成氨的反应历程可表示如下:
第一步:
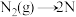 ;
;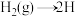 (慢反应)
(慢反应)第二步:
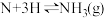 (快反应)
(快反应)①第一步反应的活化能大于第二步反应的活化能,理由是
②下列关于合成氨反应条件的选择是利用勒夏特列原理的是
A.选择400~500℃ B.选择10~30MPa
C.使用铁触媒催化剂 D.及时分离出氨气
(3)在一定条件下,向某反应容器中充入1molN2、3molH2在不同温度下反应,平衡体系中氨的物质的量分数随压强变化的曲线如图所示:

温度T1、T2、T3由高到低的顺序为
(4)将N2和H2以一定的流速分别通过甲、乙两种催化剂进行反应,相同时间内测量逸出气体中N2的含量,从而确定N2的转化率,结果如图所示,则在合理的温度下,

您最近一年使用:0次
【推荐2】以 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
 。
。
已知: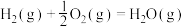
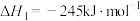
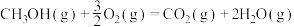
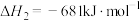
回答下列问题:
(1)计算上述合成甲醇反应的焓变
___________  。
。
(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果,在3MPa,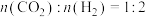 时,不同Ni、Ga配比的
时,不同Ni、Ga配比的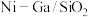 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是___________ 。催化剂的最佳配比和反应温度是___________ 。 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数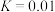 ,下列事实说明该反应已达平衡的是___________。
,下列事实说明该反应已达平衡的是___________。
(4) 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1L容器中投入
。5MPa,200℃时在1L容器中投入 和
和 ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率 )。计算合成甲醇反应的化学平衡常数K(列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(列出计算表达式)___________ 。
 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。已知:
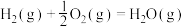
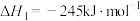
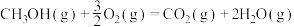
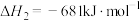
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。
。(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果,在3MPa,
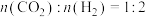 时,不同Ni、Ga配比的
时,不同Ni、Ga配比的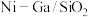 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是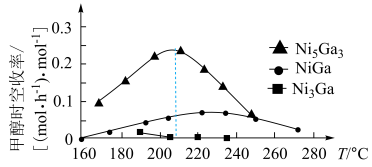
 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数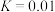 ,下列事实说明该反应已达平衡的是___________。
,下列事实说明该反应已达平衡的是___________。| A.气体密度保持不变 |
B. 与 与 的生成速率相等 的生成速率相等 |
C.某时刻容器中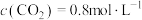 , ,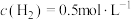 , , |
| D.混合气体的平均相对分子质量不变 |
(4)
 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1L容器中投入
。5MPa,200℃时在1L容器中投入 和
和 ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率 )。计算合成甲醇反应的化学平衡常数K(列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(列出计算表达式)
您最近一年使用:0次
【推荐3】二氧化碳的吸收和利用是实现“碳中和”的重要途径,利用二氧化碳合成二甲醚方法通常是 和
和 先合成甲醇,再由甲醇脱水制备二甲醚。
先合成甲醇,再由甲醇脱水制备二甲醚。
(1)已知: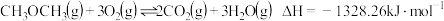


则合成二甲醚反应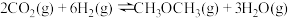 的
的
___________ 。
(2)合成二甲醚的关键是合成甲醇:
I.
①恒容绝热容器中,一定能说明反应Ⅰ已达到化学平衡状态的是___________ 。
A.
B.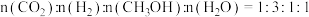
C.气体的密度保持不变
D.容器内气体的温度保持不变
②合成甲醇时存在逆水汽变换:II.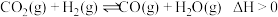 ,按照
,按照 投料,保持压强为
投料,保持压强为 下达到平衡时,
下达到平衡时, 和
和 在含碳产物中物质的量百分数及
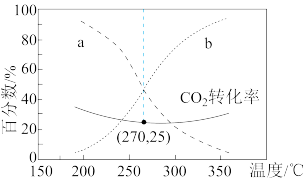
在含碳产物中物质的量百分数及 的转化率随温度的变化如图所示,图中
的转化率随温度的变化如图所示,图中___________ (填“a”或“b”)表示甲醇在含碳产物中物质的量分数, 的转化率在
的转化率在 之后随温度升高而增大的原因是
之后随温度升高而增大的原因是___________ 。若甲醇的选择性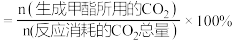 ,图中
,图中 时甲醇的选择性=
时甲醇的选择性=___________ 。逆水汽变换反应的压强平衡常数
___________ 。
(3)甲醇脱水可制得二甲醚: 。
。
实验测得: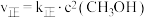 ,
,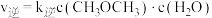 ,
, 、
、 为速率常数。
为速率常数。 温度下,向
温度下,向 恒容密闭容器中加入
恒容密闭容器中加入 ,达到平衡时测得
,达到平衡时测得 的体积分数为60%,则平衡时
的体积分数为60%,则平衡时 的产率
的产率
___________ ;当温度改变为 时,
时,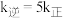 ,则
,则
___________  (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
 和
和 先合成甲醇,再由甲醇脱水制备二甲醚。
先合成甲醇,再由甲醇脱水制备二甲醚。(1)已知:
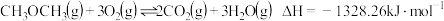


则合成二甲醚反应
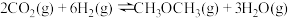 的
的
(2)合成二甲醚的关键是合成甲醇:
I.

①恒容绝热容器中,一定能说明反应Ⅰ已达到化学平衡状态的是
A.

B.
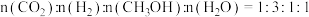
C.气体的密度保持不变
D.容器内气体的温度保持不变
②合成甲醇时存在逆水汽变换:II.
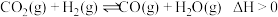 ,按照
,按照 投料,保持压强为
投料,保持压强为 下达到平衡时,
下达到平衡时, 和
和 在含碳产物中物质的量百分数及
在含碳产物中物质的量百分数及 的转化率随温度的变化如图所示,图中
的转化率随温度的变化如图所示,图中 的转化率在
的转化率在 之后随温度升高而增大的原因是
之后随温度升高而增大的原因是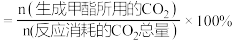 ,图中
,图中 时甲醇的选择性=
时甲醇的选择性=

(3)甲醇脱水可制得二甲醚:
 。
。实验测得:
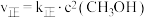 ,
,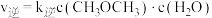 ,
, 、
、 为速率常数。
为速率常数。 温度下,向
温度下,向 恒容密闭容器中加入
恒容密闭容器中加入 ,达到平衡时测得
,达到平衡时测得 的体积分数为60%,则平衡时
的体积分数为60%,则平衡时 的产率
的产率
 时,
时,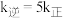 ,则
,则
 (填“<”“>”或“=”)。
(填“<”“>”或“=”)。
您最近一年使用:0次







