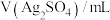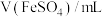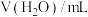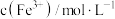用 制备
制备 ,既可减少碳排放,又可获得实用的含碳物质,有利于实现“双碳”目标。主要反应为:
,既可减少碳排放,又可获得实用的含碳物质,有利于实现“双碳”目标。主要反应为:
I.

II.
 。
。
回答下列问题:
(1)①25℃,101kPa时,CO的燃烧热为283 ,
, 的燃烧热为286
的燃烧热为286 ;
;
②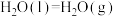
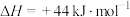 。
。
则
_________  。反应I能自发进行的条件是
。反应I能自发进行的条件是________ (填“高温”或“低温”)。
(2)向某刚性容器中,按投料比 充入
充入 和
和 在不同催化剂(M、N)下发生上述反应。一段时间后,测得
在不同催化剂(M、N)下发生上述反应。一段时间后,测得 的转化率、
的转化率、 的选择性(含碳生成物中
的选择性(含碳生成物中 的百分含量)随温度的变化如图所示。
的百分含量)随温度的变化如图所示。
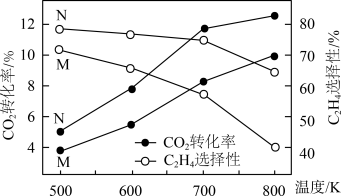
①由图可知,催化效果M___________ N(填“优于”或“劣于”)。
②已知活化能 (看作不受温度影响),反应温度T和速率常数k之间符合公式:
(看作不受温度影响),反应温度T和速率常数k之间符合公式: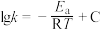 (R和C为常数),下列关于反应Ⅰ在题设条件下的
(R和C为常数),下列关于反应Ⅰ在题设条件下的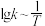 图像与上述两种催化剂关系对应正确的是
图像与上述两种催化剂关系对应正确的是___________ (填标号)。
a.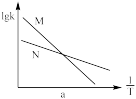 b.
b.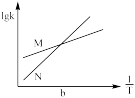 c.
c.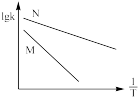 d.
d.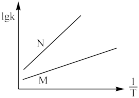
③500~800K之间,乙烯的选择性随温度变化的原因是___________ 。
④能加快制备 的速率且提高
的速率且提高 选择性的措施有
选择性的措施有___________ (填标号)。
A.降低温度 B.增大压强 C.移走 (g) D.更换适宜的催化剂
(g) D.更换适宜的催化剂
(3)T℃时,在恒容容器中加入1molCO(g)、1mol (g)以及催化剂,仅发生反应II。反应后测得各组分的平衡分压:
(g)以及催化剂,仅发生反应II。反应后测得各组分的平衡分压: 和
和 ,则反应的平衡常数
,则反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
 制备
制备 ,既可减少碳排放,又可获得实用的含碳物质,有利于实现“双碳”目标。主要反应为:
,既可减少碳排放,又可获得实用的含碳物质,有利于实现“双碳”目标。主要反应为:I.


II.

 。
。回答下列问题:
(1)①25℃,101kPa时,CO的燃烧热为283
 ,
, 的燃烧热为286
的燃烧热为286 ;
;②
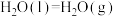
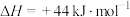 。
。则

 。反应I能自发进行的条件是
。反应I能自发进行的条件是(2)向某刚性容器中,按投料比
 充入
充入 和
和 在不同催化剂(M、N)下发生上述反应。一段时间后,测得
在不同催化剂(M、N)下发生上述反应。一段时间后,测得 的转化率、
的转化率、 的选择性(含碳生成物中
的选择性(含碳生成物中 的百分含量)随温度的变化如图所示。
的百分含量)随温度的变化如图所示。
①由图可知,催化效果M
②已知活化能
 (看作不受温度影响),反应温度T和速率常数k之间符合公式:
(看作不受温度影响),反应温度T和速率常数k之间符合公式: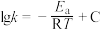 (R和C为常数),下列关于反应Ⅰ在题设条件下的
(R和C为常数),下列关于反应Ⅰ在题设条件下的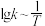 图像与上述两种催化剂关系对应正确的是
图像与上述两种催化剂关系对应正确的是a.
 b.
b. c.
c. d.
d.
③500~800K之间,乙烯的选择性随温度变化的原因是
④能加快制备
 的速率且提高
的速率且提高 选择性的措施有
选择性的措施有A.降低温度 B.增大压强 C.移走
 (g) D.更换适宜的催化剂
(g) D.更换适宜的催化剂(3)T℃时,在恒容容器中加入1molCO(g)、1mol
 (g)以及催化剂,仅发生反应II。反应后测得各组分的平衡分压:
(g)以及催化剂,仅发生反应II。反应后测得各组分的平衡分压: 和
和 ,则反应的平衡常数
,则反应的平衡常数
更新时间:2023-09-08 13:36:18
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)①若在一个容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2+3H2 2NH3 △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为
2NH3 △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为______ 。
②平衡后,若要提高H2的转化率,可以采取的措施有______ (填字母)。
A.加了催化剂 B.增大容器体积 C.降低反应体系的温度 D.加入一定量N2
③下列各项能作为判断该反应达到化学平衡状态的依据是______ (填字母)。
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)化学反应的焓变通常用实验进行测定:实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧的热化学方程式:______ 。
(3)已知:As(s)+ H2(g)+O2(g)=H3AsO4(s) △H1
H2(g)+O2(g)=H3AsO4(s) △H1
H2(g)+ O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
2As(s)+ O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
则反应的As2O5(s)+3H2O(l)=2H3AsO4(s)△H=______ 。
(1)①若在一个容积为2L的密闭容器中加入0.2molN2和0.6molH2,在一定条件下发生反应:N2+3H2
 2NH3 △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为
2NH3 △H<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则平衡时H2的转化率为②平衡后,若要提高H2的转化率,可以采取的措施有
A.加了催化剂 B.增大容器体积 C.降低反应体系的温度 D.加入一定量N2
③下列各项能作为判断该反应达到化学平衡状态的依据是
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2 B.v(N2)正=3v(H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)化学反应的焓变通常用实验进行测定:实验测得,标准状况下11.2L甲烷在氧气中充分燃烧生成液态水和二氧化碳气体时释放出akJ的热量,试写出表示甲烷燃烧的热化学方程式:
(3)已知:As(s)+
 H2(g)+O2(g)=H3AsO4(s) △H1
H2(g)+O2(g)=H3AsO4(s) △H1H2(g)+
 O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H22As(s)+
 O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3则反应的As2O5(s)+3H2O(l)=2H3AsO4(s)△H=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】将二氧化碳加氢制甲醇可以实现碳减排。其主反应为:
I:CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) ΔH=-49kJ/mol
在较高温度时可发生副反应:
II:CO2(g) + H2(g) ⇌CO(g) +H2O(g) ΔH=+41 kJ/mol
(1)①写出反应 I 的平衡常数表达式___________ 。
②为提高主反应 I 中 CO2 的平衡转化率 ,可以采取的措施是
,可以采取的措施是___________ (填字母序号)
a.升高温度 b.增大反应的压强 c.增大投料比
(2)反应过程中,副反应生成的 CO 也可以与 H2 反应生成甲醇,请写出该反应的热化学方程式___________
(3)在密闭容器中充入 3mol 氢气和 1mol 二氧化碳,在相同时间内测得不同实验温度下混合气体中甲醇的体积分数(CH3OH)与温度的关系如图所示:
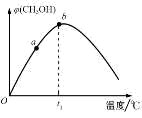
①甲醇的生成速率:va___________ vb(填“>”“=”或“<”)
②温度高于 t1 时,甲醇的体积分数随温度升高而减小的原因是___________ 。
(4)下表是其它条件相同时,不同催化剂成分对甲醇产率及催化选择性的数据。
说明: wt%为质量百分数单位。
由上表数据,可以得到的结论是___________ (填字母序号)。
a.催化剂的组成会影响单位时间内所获得的产品质量
b.催化剂的组成会影响反应的限度
c.其它条件相同时,催化剂中 MnO 对甲醇选择性的影响大于 ZrO2
I:CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) ΔH=-49kJ/mol
在较高温度时可发生副反应:
II:CO2(g) + H2(g) ⇌CO(g) +H2O(g) ΔH=+41 kJ/mol
(1)①写出反应 I 的平衡常数表达式
②为提高主反应 I 中 CO2 的平衡转化率
 ,可以采取的措施是
,可以采取的措施是a.升高温度 b.增大反应的压强 c.增大投料比
(2)反应过程中,副反应生成的 CO 也可以与 H2 反应生成甲醇,请写出该反应的热化学方程式
(3)在密闭容器中充入 3mol 氢气和 1mol 二氧化碳,在相同时间内测得不同实验温度下混合气体中甲醇的体积分数(CH3OH)与温度的关系如图所示:

①甲醇的生成速率:va
②温度高于 t1 时,甲醇的体积分数随温度升高而减小的原因是
(4)下表是其它条件相同时,不同催化剂成分对甲醇产率及催化选择性的数据。
| 组成/单位 催化剂 | CuO | ZnO | Al2O3 | ZrO2 | MnO | CH3OH 产率 | 选择性 |
| wt% | wt% | wt% | wt% | wt% | g·(kg-催化剂) -1·h-1 | % | |
| 催化剂 I | 65.8 | 26.3 | 7.9 | 0 | 0 | 78 | 40 |
| 催化剂 II | 62.4 | 25 | 0 | 12.6 | 0 | 96 | 88 |
| 催化剂 III | 65.8 | 26.6 | 0 | 3.6 | 4 | 88 | 100 |
| 催化剂 IV | 65.8 | 26.6 | 0 | 5.6 | 2 | 138 | 91 |
说明: wt%为质量百分数单位。
由上表数据,可以得到的结论是
a.催化剂的组成会影响单位时间内所获得的产品质量
b.催化剂的组成会影响反应的限度
c.其它条件相同时,催化剂中 MnO 对甲醇选择性的影响大于 ZrO2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________ g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo=o为499.0kJ·mol-1。
①反应:CO(g)+O2(g) CO2(g)+O(g)的△H=
CO2(g)+O(g)的△H=_________ kJ·mol-1。
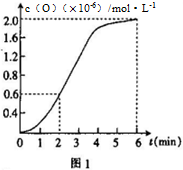
②已知1500℃时,在密闭容器中发生反应:CO2(g) CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=_________ 。
(3)在某密闭容器中发生反应:2CO2(g) 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。

①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=_________ (计算结果保留1 位小数)。
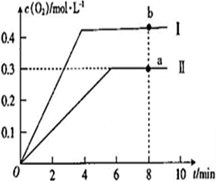
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g) 2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是
2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________ ;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________ (填“>”“<”或“=”) υb( CO)。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo=o为499.0kJ·mol-1。
①反应:CO(g)+O2(g)
 CO2(g)+O(g)的△H=
CO2(g)+O(g)的△H=②已知1500℃时,在密闭容器中发生反应:CO2(g)
 CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=
(3)在某密闭容器中发生反应:2CO2(g)
 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)
 2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是
2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氢能是一种很有前景的新能源,位于成都市郫都区的油氢合建站为成都大运会氢燃料电池汽车零排放、零污染、绿色低碳的办赛理念提供了能源保障。CH4-CO2催化重整是目前制取氢气的同时减缓温室效应的重要方法。
已知:CH4-CO2催化重整的反应阶段如下:
Ⅰ:CH4(g) C(s)+2H2(g) △H1 K1
C(s)+2H2(g) △H1 K1
Ⅱ:CO2(g)+C(s) 2CO(g) △H2 K2
2CO(g) △H2 K2
回答下列问题:
(1)CH4、CO2催化重整生成CO、H2的热化学方程式为________ (反应热用△H1、△H2表示),该反应的平衡常数K=________ (用K1、K2表示)。
(2)在恒温恒压下,向甲、乙两个密闭容器中均通入10molCH4和10molCO2进行催化重整,并分别加入两种不同催化剂ⅰ和ⅱ,测得相同时间内CO的平衡百分含量随温度的变化关系如图所示。
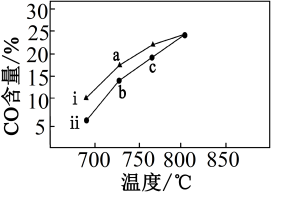
①由图可知,△H_______ 0(填“>”或“<”)。催化剂_______ (填“ⅰ”或“ⅱ”)效果更好。
②能够说明CH4-CO2催化重整生成CO、H2达到化学平衡状态的是_______ (填标号)。
A.容器内气体密度保持不变
B.化学平衡常数保持不变
C.CO2的体积分数保持不变
D.相同时间内,断裂4molC-H的同时生成2molH-H键
(3)利用工业废气中的CO2合成甲醇,选用氢气或水作为氢源,可能设计出以下两个反应:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
Ⅱ.CO2(g)+2H2O(g) CH3OH(g)+
CH3OH(g)+ O2(g)
O2(g)
上述两个化学反应的焓变和熵变如表所示(假设反应的焓变和熵变不随温度的改变而改变):
你认为反应_______ (填“Ⅰ”或“Ⅱ”)更适宜甲替的工业生产,理由是_______ 。
(4)实验室在模拟CO2(g)+3H2(g) CH3OH(g)+H2O(g)制取甲醇的过程中,将气体体积比为1:1的CO2和H2混合气体按相同流速通过反应器,CO2的转化率[α(CO2)]随温度和压强的变化关系如图所示(已知:该反应的催化剂活性受温度影响变化不大。):
CH3OH(g)+H2O(g)制取甲醇的过程中,将气体体积比为1:1的CO2和H2混合气体按相同流速通过反应器,CO2的转化率[α(CO2)]随温度和压强的变化关系如图所示(已知:该反应的催化剂活性受温度影响变化不大。):
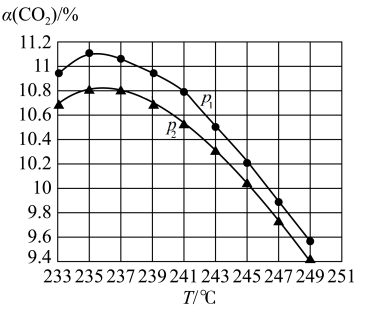
①p1_______ p2(填“>”“<”或“=”)。
②分析236℃后曲线变化的原因:________ 。
已知:CH4-CO2催化重整的反应阶段如下:
Ⅰ:CH4(g)
 C(s)+2H2(g) △H1 K1
C(s)+2H2(g) △H1 K1Ⅱ:CO2(g)+C(s)
 2CO(g) △H2 K2
2CO(g) △H2 K2回答下列问题:
(1)CH4、CO2催化重整生成CO、H2的热化学方程式为
(2)在恒温恒压下,向甲、乙两个密闭容器中均通入10molCH4和10molCO2进行催化重整,并分别加入两种不同催化剂ⅰ和ⅱ,测得相同时间内CO的平衡百分含量随温度的变化关系如图所示。

①由图可知,△H
②能够说明CH4-CO2催化重整生成CO、H2达到化学平衡状态的是
A.容器内气体密度保持不变
B.化学平衡常数保持不变
C.CO2的体积分数保持不变
D.相同时间内,断裂4molC-H的同时生成2molH-H键
(3)利用工业废气中的CO2合成甲醇,选用氢气或水作为氢源,可能设计出以下两个反应:
Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)Ⅱ.CO2(g)+2H2O(g)
 CH3OH(g)+
CH3OH(g)+ O2(g)
O2(g)上述两个化学反应的焓变和熵变如表所示(假设反应的焓变和熵变不随温度的改变而改变):
| 反应 | △H/(kJ•mol-1) | △S/(J•mol-1•K-1) |
| Ⅰ | -48.97 | -177.16 |
| Ⅱ | +676.48 | -43.87 |
(4)实验室在模拟CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)制取甲醇的过程中,将气体体积比为1:1的CO2和H2混合气体按相同流速通过反应器,CO2的转化率[α(CO2)]随温度和压强的变化关系如图所示(已知:该反应的催化剂活性受温度影响变化不大。):
CH3OH(g)+H2O(g)制取甲醇的过程中,将气体体积比为1:1的CO2和H2混合气体按相同流速通过反应器,CO2的转化率[α(CO2)]随温度和压强的变化关系如图所示(已知:该反应的催化剂活性受温度影响变化不大。):
①p1
②分析236℃后曲线变化的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】研究CO与H2反应制备二甲醚(CH3OCH3),既可减少碳排放,又可变废为宝。回答下列问题:
(1)已知CO与H2反应制备二甲醚的总反应为:2CO (g) +4H2(g)⇌CH3OCH3(g) +H2O (g),该反应经历以下两个中间反应:
i:CO (g) + 2H2(g)⇌CH3OH (g) ΔH1=- 90. 1KJ/ mol
ii:2CH3OH (g)⇌CH3OCH3(g)+ H2O(g) ΔH2=- 24.5KJ/mol
则总反应的ΔH=_______ ; 若反应过程中能量变化如图所示,则总反应速率主要由反应 _______ (选填“i ”或“ii”)决定。

(2)下列措施既能加快总反应速率,又能提高CO转化率的是_______ 。
a.升高温度 b.增大压强 c.使用合适催化剂 d.及时分离二甲醚
(3)当起始物 =2时,在100°C、200°C、300°C时,总反应中CO的平衡转化率(α)随压强变化关系如图所示, 则:
=2时,在100°C、200°C、300°C时,总反应中CO的平衡转化率(α)随压强变化关系如图所示, 则:
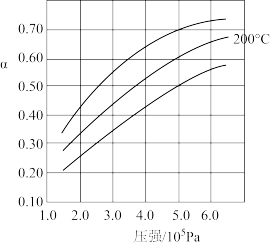
①反应在100℃,5. 0 ×105Pa时,CO的平衡转化率α=_______ ,判断依据是 _______ ,该条件下的平衡体系中二甲醚的体积分数约为 _______ %(保 留小数点后一位)。
②一定温度下,同一反应用平衡浓度表示的平衡常数Kc和用平衡分压表示的平衡常数Kp间存在定量关系,可以借助公式pV= nRT进行推导(其中T为体系温度;p为气体压强;V为气体体积;n为气体物质的量;R为常数)。则当体系温度为T时,总反应Kc与Kp的关系为Kc=_______ Kp(用含 R、T的式子表示)。
(1)已知CO与H2反应制备二甲醚的总反应为:2CO (g) +4H2(g)⇌CH3OCH3(g) +H2O (g),该反应经历以下两个中间反应:
i:CO (g) + 2H2(g)⇌CH3OH (g) ΔH1=- 90. 1KJ/ mol
ii:2CH3OH (g)⇌CH3OCH3(g)+ H2O(g) ΔH2=- 24.5KJ/mol
则总反应的ΔH=

(2)下列措施既能加快总反应速率,又能提高CO转化率的是
a.升高温度 b.增大压强 c.使用合适催化剂 d.及时分离二甲醚
(3)当起始物
 =2时,在100°C、200°C、300°C时,总反应中CO的平衡转化率(α)随压强变化关系如图所示, 则:
=2时,在100°C、200°C、300°C时,总反应中CO的平衡转化率(α)随压强变化关系如图所示, 则:
①反应在100℃,5. 0 ×105Pa时,CO的平衡转化率α=
②一定温度下,同一反应用平衡浓度表示的平衡常数Kc和用平衡分压表示的平衡常数Kp间存在定量关系,可以借助公式pV= nRT进行推导(其中T为体系温度;p为气体压强;V为气体体积;n为气体物质的量;R为常数)。则当体系温度为T时,总反应Kc与Kp的关系为Kc=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】(1)高温下,C(s)+H2O(g) CO(g)+H2(g) ΔH>0,反应的化学平衡常数表达式K=
CO(g)+H2(g) ΔH>0,反应的化学平衡常数表达式K=____ ,该反应随温度升高,K值___ (填增大、减小或不变),该反应在高温下自发进行的原因是_____ 。
(2)向重铬酸钾溶液中加入氢氧化钠固体,溶液的颜色变化为____ ,原因是(请从平衡的角度用化学用语及必要的文字说明)____ 。
(3)密闭容器中充入N2O4达化学平衡,压缩体积达新平衡,整个过程的现象为____ 。
(4)多元弱酸的逐级电离平衡常数为K1、K2、K3……,则K1、K2、K3的大小关系为___ 。
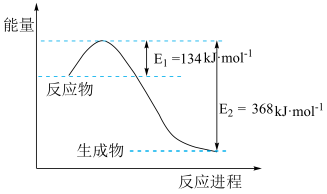
(5)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式___ ,向上述可逆反应中加入催化剂,则E1____ (填增大、减小或不变,下同);此反应的ΔH____ 。
 CO(g)+H2(g) ΔH>0,反应的化学平衡常数表达式K=
CO(g)+H2(g) ΔH>0,反应的化学平衡常数表达式K=(2)向重铬酸钾溶液中加入氢氧化钠固体,溶液的颜色变化为
(3)密闭容器中充入N2O4达化学平衡,压缩体积达新平衡,整个过程的现象为
(4)多元弱酸的逐级电离平衡常数为K1、K2、K3……,则K1、K2、K3的大小关系为
(5)1molNO2和1molCO反应生成CO2和NO过程中的能量变化如图,请写出NO2和CO反应的热化学方程式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】二氯乙烷为原料制备氯乙烯是合成氯乙烯的一种重要的方法。请回答:
(1)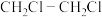 热裂解反应为:
热裂解反应为: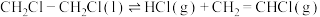

已知相关物质的标准熵数值如下表:
①该反应的标准熵变
___________  ;
;
②已知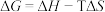 ,该反应在下列哪些温度下能自发进行?
,该反应在下列哪些温度下能自发进行?________ (填标号);
A.0.39K B.0.49K C.500K D.525K
(2)密闭恒容容器中充满1.0mol/L CH2Cl-CH2Cl(g),保持温度773K,只发生以下反应。
反应Ⅰ: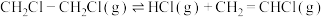
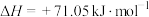
反应Ⅱ:
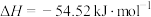
研究发现,反应Ⅰ活化能远小于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。未加入催化剂下进行反应,各物质的浓度与反应时间的变化关系如图所示,t时刻测得CH2=CHCl、H2的浓度分别为0.80 mol/L、0.10 mol/L。___________ mol/L。
②其他条件不变,若反应温度高于773K且保持不变,则图示点a、b中,CH2=CHCl的浓度峰值点可能是________ (填标号)。
③相同条件下,若反应起始时加入足量的氮掺杂活性炭催化剂(该催化剂仅对反应Ⅰ有加速作用),则图示点a、b、c、d中,CH2=CHCl的浓度峰值点可能是________ (填标号),解释原因____________ 。
(3)现投入CH≡CH与CH2Cl-CH2Cl于密闭恒容中,可能发生的反应如下:
反应Ⅰ: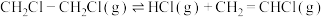

反应Ⅱ: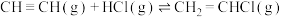
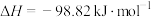
反应Ⅲ:
若用氮掺杂活性炭作催化剂,只发生反应Ⅰ和Ⅱ;若用 和
和 作催化剂,只发生反应Ⅲ。不考虑催化剂活性降低或丧失,下列说法不正确的是 。
作催化剂,只发生反应Ⅲ。不考虑催化剂活性降低或丧失,下列说法不正确的是 。
(1)
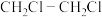 热裂解反应为:
热裂解反应为: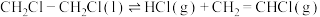

已知相关物质的标准熵数值如下表:
化学式 |
| HCl(g) |
|
标准熵:S/( | 305.90 | 186.90 | 264.00 |

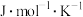 ;
;②已知
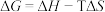 ,该反应在下列哪些温度下能自发进行?
,该反应在下列哪些温度下能自发进行?A.0.39K B.0.49K C.500K D.525K
(2)密闭恒容容器中充满1.0mol/L CH2Cl-CH2Cl(g),保持温度773K,只发生以下反应。
反应Ⅰ:
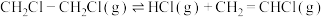
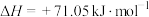
反应Ⅱ:

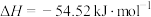
研究发现,反应Ⅰ活化能远小于反应Ⅱ,近似认为反应Ⅰ建立平衡后始终处于平衡状态。未加入催化剂下进行反应,各物质的浓度与反应时间的变化关系如图所示,t时刻测得CH2=CHCl、H2的浓度分别为0.80 mol/L、0.10 mol/L。
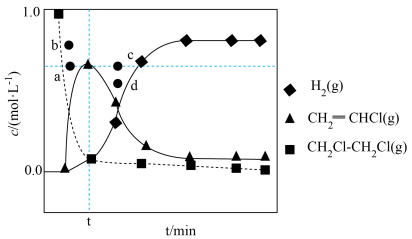
②其他条件不变,若反应温度高于773K且保持不变,则图示点a、b中,CH2=CHCl的浓度峰值点可能是
③相同条件下,若反应起始时加入足量的氮掺杂活性炭催化剂(该催化剂仅对反应Ⅰ有加速作用),则图示点a、b、c、d中,CH2=CHCl的浓度峰值点可能是
(3)现投入CH≡CH与CH2Cl-CH2Cl于密闭恒容中,可能发生的反应如下:
反应Ⅰ:
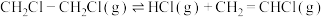

反应Ⅱ:
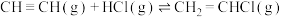
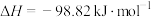
反应Ⅲ:

若用氮掺杂活性炭作催化剂,只发生反应Ⅰ和Ⅱ;若用
 和
和 作催化剂,只发生反应Ⅲ。不考虑催化剂活性降低或丧失,下列说法不正确的是 。
作催化剂,只发生反应Ⅲ。不考虑催化剂活性降低或丧失,下列说法不正确的是 。| A.温度升高,反应Ⅲ的平衡常数K增大 |
| B.其他条件不变,氮掺杂活性炭作催化剂,HCl平衡浓度随温度升高而增大 |
C.其他条件不变, 和 和 作催化剂,减少容器体积对 作催化剂,减少容器体积对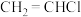 平衡产率不影响 平衡产率不影响 |
D.其他条件不变,CH2Cl-CH2Cl的平衡转化率大小比较:氮掺杂活性炭作催化剂> 和 和 作催化剂 作催化剂 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某小组设计实验测定可逆反应 的平衡常数并探究影响化学平衡移动的因素。
的平衡常数并探究影响化学平衡移动的因素。
已知:常温下,反应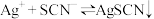 (白色)和
(白色)和 (红色)的平衡常数分别为
(红色)的平衡常数分别为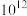 、
、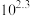 。
。
Ⅰ.配制溶液
(1)用绿矾 配制
配制 ,为防止配制过程中
,为防止配制过程中 变质,常加入少量的
变质,常加入少量的_______ 和_______ (填试剂名称)。
Ⅱ.测定 的平衡常数
的平衡常数
常温下,将 溶液和
溶液和 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
(2)用 溶液滴定测定滤液
溶液滴定测定滤液 中
中 浓度。
浓度。
①量取滤液X。用_______ (填“酸式”或“碱式”)滴定管取一定体积滤液X于锥形瓶中,若滴定管未用滤液 润洗,对
润洗,对 浓度测定结果是
浓度测定结果是_______ (填“偏高”、“偏低”或“无影响”)。
②用 溶液滴定滤液中
溶液滴定滤液中 。滴定终点的现象为:当最后半滴
。滴定终点的现象为:当最后半滴 溶液滴入后,
溶液滴入后,_______ ,此时为滴定终点。重复三次实验,实验数据如下表所示。根据表中数据计算出的滤液 中
中 的平均浓度是
的平均浓度是_______  (用含
(用含 的计算式表示)。
的计算式表示)。
(3)计算 。若测得滤液
。若测得滤液 中
中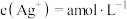 ,则该反应的平衡常数
,则该反应的平衡常数
_______ 。(用含 的计算式表示)
的计算式表示)
Ⅲ.探究稀释对该反应平衡移动方向的影响
常温下,用 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。
(4)①
_______ ,
_______ 。
②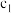 和
和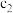 存在的关系是
存在的关系是_______ (用含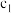 和
和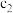 的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
 的平衡常数并探究影响化学平衡移动的因素。
的平衡常数并探究影响化学平衡移动的因素。已知:常温下,反应
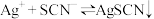 (白色)和
(白色)和 (红色)的平衡常数分别为
(红色)的平衡常数分别为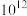 、
、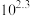 。
。Ⅰ.配制溶液
(1)用绿矾
 配制
配制 ,为防止配制过程中
,为防止配制过程中 变质,常加入少量的
变质,常加入少量的Ⅱ.测定
 的平衡常数
的平衡常数
常温下,将
 溶液和
溶液和 溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。(2)用
 溶液滴定测定滤液
溶液滴定测定滤液 中
中 浓度。
浓度。①量取滤液X。用
 润洗,对
润洗,对 浓度测定结果是
浓度测定结果是②用
 溶液滴定滤液中
溶液滴定滤液中 。滴定终点的现象为:当最后半滴
。滴定终点的现象为:当最后半滴 溶液滴入后,
溶液滴入后, 中
中 的平均浓度是
的平均浓度是 (用含
(用含 的计算式表示)。
的计算式表示)。实验编号 | 滤液 | 滴定前 | 滴定后 |
1 | 10.00 | 3.10 | 23.06 |
2 | 10.00 | 0.50 | 20.50 |
3 | 10.00 | 2.36 | 22.40 |
 。若测得滤液
。若测得滤液 中
中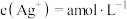 ,则该反应的平衡常数
,则该反应的平衡常数
 的计算式表示)
的计算式表示)Ⅲ.探究稀释对该反应平衡移动方向的影响
常温下,用
 溶液和
溶液和 溶液,按下表配制总体积相同的系列溶液,测定平衡时
溶液,按下表配制总体积相同的系列溶液,测定平衡时 浓度,记录数据。
浓度,记录数据。实验编号 |
|
|
|
|
ⅰ | 10 | 10 | 0 |
|
ⅱ | 4 |
|
|
|


②
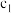 和
和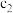 存在的关系是
存在的关系是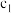 和
和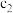 的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:
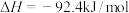 ,该反应的能量变化如图所示。
,该反应的能量变化如图所示。

①在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ ,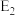 的变化是
的变化是___________ (填“增大”、“减小”或“不变”)。
②将0.3mol 和0.5mol
和0.5mol 充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体的物质的量变为原来的
充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体的物质的量变为原来的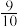 ,此时
,此时 的转化率为
的转化率为___________ ;欲提高该容器中 的转化率,下列措施不可行的是
的转化率,下列措施不可行的是___________ (填选项字母)。
a.向容器中按原比例再充入原料气 b.改变反应的催化剂
c.向容器中再充入一定量 d.分离出生成物氨
d.分离出生成物氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下, 在催化剂(掺有少量
在催化剂(掺有少量 和
和 )表面与水发生反应:
)表面与水发生反应:
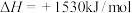
又知:
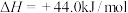
则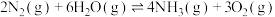

___________  ,该反应的化学平衡常数表达式为K=
,该反应的化学平衡常数表达式为K=___________ ,控制其他条件不变,降低温度,K值___________ (填“增大”、“减小”或“不变”)。
(1)合成氨的原理为:

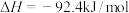 ,该反应的能量变化如图所示。
,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,
 的变化是
的变化是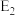 的变化是
的变化是②将0.3mol
 和0.5mol
和0.5mol 充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体的物质的量变为原来的
充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体的物质的量变为原来的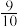 ,此时
,此时 的转化率为
的转化率为 的转化率,下列措施不可行的是
的转化率,下列措施不可行的是a.向容器中按原比例再充入原料气 b.改变反应的催化剂
c.向容器中再充入一定量
 d.分离出生成物氨
d.分离出生成物氨(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,
 在催化剂(掺有少量
在催化剂(掺有少量 和
和 )表面与水发生反应:
)表面与水发生反应:
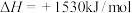
又知:

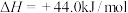
则
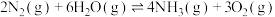

 ,该反应的化学平衡常数表达式为K=
,该反应的化学平衡常数表达式为K=
您最近一年使用:0次