钕铁硼因其超强的磁性被誉为“永磁之王”,广泛应用于新能源汽车、信息存储等方面。从钕铁硼废料(主要成分为Nd、铁、硼、铝,少量的硅酸盐)中回收钕元素的工艺流程如图所示:
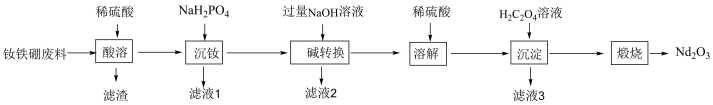
已知:①硼难溶于非氧化性酸, 难溶于水和稀酸,滤液1中主要金属离子为
难溶于水和稀酸,滤液1中主要金属离子为 、
、 ,沉淀时得到
,沉淀时得到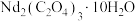 。
。
②部分金属离子( )形成氢氧化物沉淀的pH范围如表:
)形成氢氧化物沉淀的pH范围如表:
回答下列问题:
(1)“滤渣”的主要成分是___________ (填化学式)。
(2)除去铝元素的操作单元为___________ 。
(3)若“酸溶”后溶液中 的浓度为1.0
的浓度为1.0 ,则“沉钕”时调节pH范围为
,则“沉钕”时调节pH范围为___________ ,“碱转化”过程Nd元素发生反应的离子方程式为___________ 。
(4)“煅烧”过程中固体质量变化( )随温度变化曲线如图所示:
)随温度变化曲线如图所示:

750K时得到的固体是___________ ,若在1000K下进行煅烧,发生反应的化学方程式为___________ 。

已知:①硼难溶于非氧化性酸,
 难溶于水和稀酸,滤液1中主要金属离子为
难溶于水和稀酸,滤液1中主要金属离子为 、
、 ,沉淀时得到
,沉淀时得到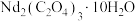 。
。②部分金属离子(
 )形成氢氧化物沉淀的pH范围如表:
)形成氢氧化物沉淀的pH范围如表:| 金属离子 |  |  |  |
| 开始沉淀 | 6.3 | 1.5 | 3.4 |
完全沉淀(离子浓度: ) ) | 8.3 | 2.8 | 4.7 |
(1)“滤渣”的主要成分是
(2)除去铝元素的操作单元为
(3)若“酸溶”后溶液中
 的浓度为1.0
的浓度为1.0 ,则“沉钕”时调节pH范围为
,则“沉钕”时调节pH范围为(4)“煅烧”过程中固体质量变化(
 )随温度变化曲线如图所示:
)随温度变化曲线如图所示:
750K时得到的固体是
更新时间:2023-10-11 15:11:30
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
【推荐1】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如图:

(1)将菱锌矿研磨成粉的目的是__ 。
(2)完成“氧化除铁”步骤中反应的离子方程式:□Fe(OH)2+□____+□_____=□Fe(OH)3+□Cl-____ 。
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是___ 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为__ 。
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是___ (选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为_____ 、____ 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于___ 。

(1)将菱锌矿研磨成粉的目的是
(2)完成“氧化除铁”步骤中反应的离子方程式:□Fe(OH)2+□____+□_____=□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | — | — |
| 沉淀完全的pH | 12.4 | 8.0 | — | — |
| 开始溶解的pH | — | 10.5 | — | — |
| Ksp | 5.6×10-12 | — | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】氧化还原滴定法是以氧化还原反应为基础的定量分析方法。在测定赤铁矿矿石中的含铁量时,可准确称0.2500g矿石溶解在硫酸中,再把 还原成
还原成 ,然后用
,然后用 的
的 标准溶液进行滴定。请回答下列问题:
标准溶液进行滴定。请回答下列问题:
(1)矿石溶解过程中发生反应的离子方程式为_______ 。
(2)在滴定过程中 标准溶液应装在
标准溶液应装在_______ 滴定管里,原因是_______ 。
(3)滴定过程中不另加指示剂的原因是_______ 。滴定终点的标志为_______ 。
(4)计算:重复滴定操作3次,记录实验数据如下表。则消耗 标准溶液的平均体积为
标准溶液的平均体积为_______  。矿石中铁元素的质量分数为
。矿石中铁元素的质量分数为_______ 。
(5)误差分析:下列操作会导致测定结果偏高的是_______ (填字母)。
A.盛放 标准溶液的滴定管未润洗
标准溶液的滴定管未润洗
B.滴定操作开始时,锥形瓶中残留少量蒸馏水
C.矿石用盐酸溶解
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
 还原成
还原成 ,然后用
,然后用 的
的 标准溶液进行滴定。请回答下列问题:
标准溶液进行滴定。请回答下列问题:(1)矿石溶解过程中发生反应的离子方程式为
(2)在滴定过程中
 标准溶液应装在
标准溶液应装在(3)滴定过程中不另加指示剂的原因是
(4)计算:重复滴定操作3次,记录实验数据如下表。则消耗
 标准溶液的平均体积为
标准溶液的平均体积为 。矿石中铁元素的质量分数为
。矿石中铁元素的质量分数为| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.50 | 20.51 |
| 2 | 1.10 | 21.09 |
| 3 | 0.10 | 21.10 |
A.盛放
 标准溶液的滴定管未润洗
标准溶液的滴定管未润洗B.滴定操作开始时,锥形瓶中残留少量蒸馏水
C.矿石用盐酸溶解
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(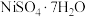 ):
):
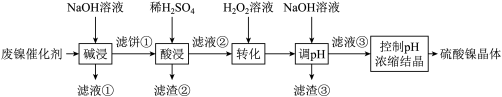
常温溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是___________ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式___________ 。
(2)“滤液②”中含有的金属离子可能是___________ 。
(3)“转化”中可替代 的物质是
的物质是___________ 。若工艺流程改为先“调pH”后“转化”,即“滤液③”中可能含有的杂质离子为___________ 。
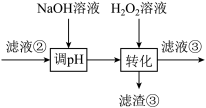
(4)将废镍催化剂a克按流程制成硫酸镍晶体,(镍元素损失10%)并溶于水中配成250ml溶液,取其中25ml于锥形瓶,加入足量的氯化钡溶液充分反应,产生b克沉淀,则废镍催化剂中镍元素的质量分数为___________ (用a、b列式表示)。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍锅电池正极材料的NiOOH。写出该反应的离子方程式___________ 。
 ):
):
常温溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离 |  |  |  |  |
开始沉淀时( )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(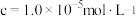 )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子可能是
(3)“转化”中可替代
 的物质是
的物质是
(4)将废镍催化剂a克按流程制成硫酸镍晶体,(镍元素损失10%)并溶于水中配成250ml溶液,取其中25ml于锥形瓶,加入足量的氯化钡溶液充分反应,产生b克沉淀,则废镍催化剂中镍元素的质量分数为
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍锅电池正极材料的NiOOH。写出该反应的离子方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O。
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·1/2H2O(s)+3/2H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O(g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·1/2H2O(s)=CaSO4(s)+1/2H2O(g)的ΔH4=____ kJ·mol-1。

⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如右图1所示。在低于800℃时主要还原产物为______ ;高于800℃时主要发生的反应的化学方程式为______ 。
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是______ ;当温度高于1200 ℃时,无论有无CaCl2,CaSO4的转化率趋于相同,其原因是______ 。
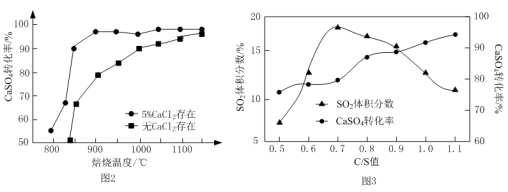
③以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是______ 。
⑶利用反应CaSO4(s)+(NH4)2CO3(aq) CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=__________ 。[已知:Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=3.2×10-7]
⑴CaSO4·2H2O脱水反应相关的热化学方程式为:
CaSO4·2H2O(s)=CaSO4·1/2H2O(s)+3/2H2O(g) ΔH1=83.2 kJ·mol-1
CaSO4·2H2O(s)=CaSO4(s)+2H2O(l) ΔH2=26 kJ·mol-1
H2O(g)=H2O(l) ΔH3=-44 kJ·mol-1
则反应CaSO4·1/2H2O(s)=CaSO4(s)+1/2H2O(g)的ΔH4=

⑵用合适的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸。
①以CO作还原剂,改变反应温度可得到不同的产物。不同温度下反应后所得固体成分的物质的量如右图1所示。在低于800℃时主要还原产物为
②以高硫煤为还原剂焙烧2.5 小时,不同条件对硫酸钙转化率的影响如下图2所示。CaCl2的作用是

③以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(炭粉与CaSO4的物质的量之比)的混合物在1100℃加热,结果如上图3所示。当C/S值为0.5时,反应产物为CaO、SO2和CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其主要原因可能是
⑶利用反应CaSO4(s)+(NH4)2CO3(aq)
 CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=
CaCO3(s)+(NH4)2SO4(aq)可以将磷石膏转化为硫酸铵。若反应达到平衡后溶液中c(SO42-)=2.0 mol·L-1,此时溶液中c(CO32-)=
您最近一年使用:0次
【推荐2】纳米铁在废水处理、材料研发等领域有着重要应用。以某钛白粉厂副产品(主要含FeSO4,还含有TiOSO4、CoSO4、NiSO4等杂质)为原料制备纳米铁的流程如下:______ 。
(2)“除钴镍”完全后,溶液中c(Fe2+)的最大值为______ mol·L-1.
(3)投入1molNaBH4还原FeSO4时,获得的纳米铁粉的质量总是低于理论值,其原因是______ 。
(4)用纳米铁去除废水中的Cu2+。常温下,选择Cu2+初始浓度为2.0×10-4mol·L-1的废水,控制纳米铁的用量相同,测得Cu2+去除率随初始pH的变化如图1所示。初始pH=7时Cu2+去除率明显大于pH=5时的原因是______ 。
(5)利用该纳米铁制成的改性Fe3O4是一种优良的磁性材料,该Fe3O4晶胞的 的结构如图2所示,研究发现结构中的Fe2+只可能出现在图中某一“
的结构如图2所示,研究发现结构中的Fe2+只可能出现在图中某一“ ”所示位置上,请确定Fe2+所在晶胞的位置并说明理由:
”所示位置上,请确定Fe2+所在晶胞的位置并说明理由:______ 。


(2)“除钴镍”完全后,溶液中c(Fe2+)的最大值为
(3)投入1molNaBH4还原FeSO4时,获得的纳米铁粉的质量总是低于理论值,其原因是
(4)用纳米铁去除废水中的Cu2+。常温下,选择Cu2+初始浓度为2.0×10-4mol·L-1的废水,控制纳米铁的用量相同,测得Cu2+去除率随初始pH的变化如图1所示。初始pH=7时Cu2+去除率明显大于pH=5时的原因是
(5)利用该纳米铁制成的改性Fe3O4是一种优良的磁性材料,该Fe3O4晶胞的
 的结构如图2所示,研究发现结构中的Fe2+只可能出现在图中某一“
的结构如图2所示,研究发现结构中的Fe2+只可能出现在图中某一“ ”所示位置上,请确定Fe2+所在晶胞的位置并说明理由:
”所示位置上,请确定Fe2+所在晶胞的位置并说明理由:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】随着生活水平的提高,旧电池的回收利用成为当前世界各国研究的重要课题,我国科学家提出利用旧干电池(除碳棒后,主要成份为:Zn、Fe、Cu、 、
、 以及
以及 )回收氧化锌的流程如图:
)回收氧化锌的流程如图:

已知:
①二氧化锰难溶于水、弱酸、弱碱;锌、铜氧化物及其盐能溶于氨水形成配合物(如 )。
)。
②室温下, ,
, 。
。
③室温下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)旧电池灼烧的目的是___________ ;滤渣1的主要成分是___________ (填化学式)。
(2)若在实验室中进行“提锌”操作,该操作的名称为___________ 。
(3)除铜时不采用加入氨水方法的原因是___________ ;加入 不宜过多,可能的原因是
不宜过多,可能的原因是___________ (用离子方程式表示)。
(4)室温下,测得除铜后溶液中: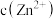 为
为 、
、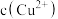 为
为 ,此时溶液中
,此时溶液中
___________ (填“能”或“不能”)形成沉淀。
(5)工业上常采用电解硫酸锌溶液的方法制备锌,阴极电极反应式为___________ 。
 、
、 以及
以及 )回收氧化锌的流程如图:
)回收氧化锌的流程如图:
已知:
①二氧化锰难溶于水、弱酸、弱碱;锌、铜氧化物及其盐能溶于氨水形成配合物(如
 )。
)。②室温下,
 ,
, 。
。③室温下,一些金属氢氧化物沉淀时的pH如下表:
| 金属氢氧化物 |  |  |  |
| 开始沉淀的pH | 2.3 | 5.9 | 5.4 |
| 完全沉淀的pH | 3.2 | 8.2(>10时溶解) | 6.7 |
(1)旧电池灼烧的目的是
(2)若在实验室中进行“提锌”操作,该操作的名称为
(3)除铜时不采用加入氨水方法的原因是
 不宜过多,可能的原因是
不宜过多,可能的原因是(4)室温下,测得除铜后溶液中:
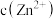 为
为 、
、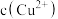 为
为 ,此时溶液中
,此时溶液中
(5)工业上常采用电解硫酸锌溶液的方法制备锌,阴极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】钴是生产电池材料高温合金、磁性材料及催化剂的重要原料。一种以湿法炼锌净化渣(含有Co、Zn、Fe、Cu、Pb等金属及其氧化物)为原料提取钴的工艺流程如图所示:

已知:①常温下,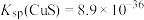 ,
,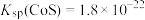 。
。
②溶液的氧化还原电位为正表示该溶液显示出一定的氧化性。氧化还原电位越高,氧化性越强。
回答下列问题:
(1)“浸出渣”的主要成分为________ (填化学式)。工业上,在“浸出”过程中,常选用硫酸浸取,而不用盐酸,原因是________ 。
(2) 常用作沉淀剂,在“铜渣”中检测不到
常用作沉淀剂,在“铜渣”中检测不到 ,“除铜液”中
,“除铜液”中 浓度为
浓度为 ,则此时溶液的
,则此时溶液的
________ [已知常温下,饱和 水溶液中存在关系式:
水溶液中存在关系式: ]。
]。
(3)“氧化”过程中, 与
与 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(4)“沉铁”过程中, 的作用是
的作用是________ 。
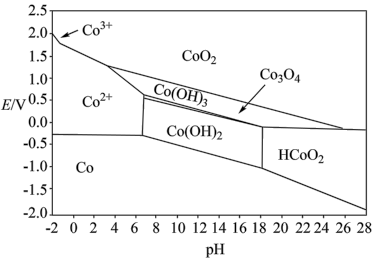
(5)Co元素的存在形式的稳定区域与溶液pH的关系如图(E-pH图)所示,在溶液 时,
时, 能将
能将 氧化,写出该反应的离子方程式:
氧化,写出该反应的离子方程式:________ ;以1吨湿法炼锌净化渣(Co的质量分数为w%)为原料提取出 。在提取过程中钴的损失率为
。在提取过程中钴的损失率为________ %(填含w、m的表达式)。
(6)Co的一种化合物为六方晶系晶体,晶胞结构如图所示。以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为________ 。


已知:①常温下,
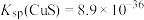 ,
,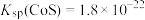 。
。②溶液的氧化还原电位为正表示该溶液显示出一定的氧化性。氧化还原电位越高,氧化性越强。
回答下列问题:
(1)“浸出渣”的主要成分为
(2)
 常用作沉淀剂,在“铜渣”中检测不到
常用作沉淀剂,在“铜渣”中检测不到 ,“除铜液”中
,“除铜液”中 浓度为
浓度为 ,则此时溶液的
,则此时溶液的
 水溶液中存在关系式:
水溶液中存在关系式: ]。
]。(3)“氧化”过程中,
 与
与 发生反应的离子方程式为
发生反应的离子方程式为(4)“沉铁”过程中,
 的作用是
的作用是(5)Co元素的存在形式的稳定区域与溶液pH的关系如图(E-pH图)所示,在溶液
 时,
时, 能将
能将 氧化,写出该反应的离子方程式:
氧化,写出该反应的离子方程式: 。在提取过程中钴的损失率为
。在提取过程中钴的损失率为
(6)Co的一种化合物为六方晶系晶体,晶胞结构如图所示。以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为

您最近一年使用:0次
【推荐2】以大洋锰结核(主要由MnO2和铁氧化物组成,还含有Al、Mg、Zn、Ca、Si等元素)为原料,制备MnxOy及Mn(H2PO4)2·2H2O,所得产品具有广泛的用途。制备过程如下图所示:
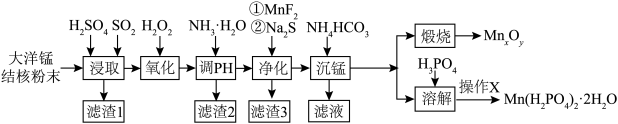
已知:①金属离子浓度≤10-5mol/L时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
②25℃时,Ksp(ZnS)=2.9×10-25;Ksp(MnF2)=5.3×10-3;Ksp(MgF2)=7.4×10-11;Ksp(MnCO3)=1.0×10-11。
(1)基态锰原子的价层电子轨道表示式为___________ 。
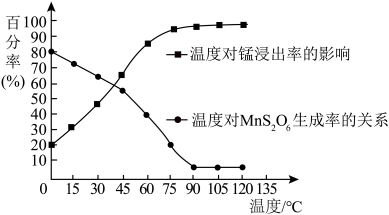
(2)“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式___________ 。温度对锰的浸出率、MnS2O6生成率的影响如图所示,为了减少副产物的生成,最适宜的温度___________ 。
(3)“调pH”时,应控制的pH范围是___________ 。“净化”后滤渣3的主要成分___________ 。
(4)“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为___________ 。若改用加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)  Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = ___________ (填数值)。
(5)要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为___________ 、过滤、洗涤、干燥。
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
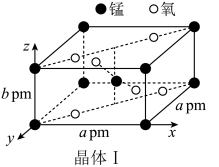
①晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。阿伏伽德罗常数为NA mol-1,则晶体Ⅰ的密度为___________ g·cm-3。
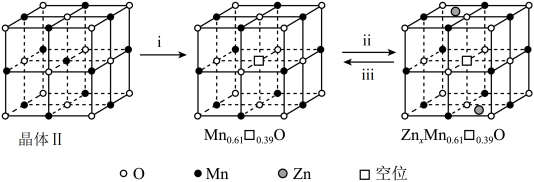
②晶体Ⅱ可作电池正极材料,通过Zn2+在晶体Ⅱ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ii”代表电池___________ (填“充电”或“放电”)过程,“iii”的电极反应式为___________ 。

已知:①金属离子浓度≤10-5mol/L时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
(1)基态锰原子的价层电子轨道表示式为
(2)“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式

(3)“调pH”时,应控制的pH范围是
(4)“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为
 Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = (5)要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
①晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。阿伏伽德罗常数为NA mol-1,则晶体Ⅰ的密度为

②晶体Ⅱ可作电池正极材料,通过Zn2+在晶体Ⅱ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ii”代表电池

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
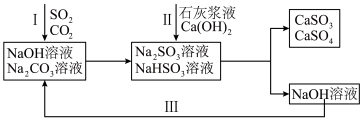
【推荐3】双碱法是一种用于燃煤尾气脱硫的工艺,其具有脱硫效率高、成本低等优点,以下是一种脱硫工艺简要流程。 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。
1.等浓度的 和
和 溶液,
溶液,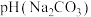
___________ 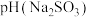 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:___________ 。
2.过程I中, 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数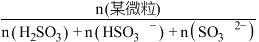 与pH的关系如图所示。
与pH的关系如图所示。___________ 。
②等浓度 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是___________ 。
A.
B.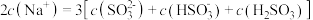
C.
D.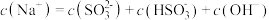
3.生成的 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:___________ 。
4.工业上也可以用氨水吸收尾气中的 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。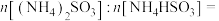
___________ 。
 时,
时, 和
和 的电离常数如下表所示。
的电离常数如下表所示。 |  |
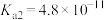 | |
 |  |
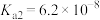 |
1.等浓度的
 和
和 溶液,
溶液,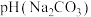
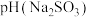 (填“>”、“<”或“=”),请依据电离平衡常数分析原因:
(填“>”、“<”或“=”),请依据电离平衡常数分析原因:2.过程I中,
 溶液吸收
溶液吸收 时,随着
时,随着 的通入,会得到不同溶质组成的溶液。
的通入,会得到不同溶质组成的溶液。 时,
时, 的物质的量分数
的物质的量分数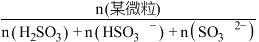 与pH的关系如图所示。
与pH的关系如图所示。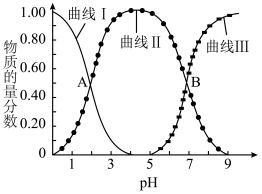
②等浓度
 和
和 的混合溶液中,下列关系正确的是
的混合溶液中,下列关系正确的是A.

B.
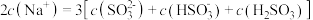
C.

D.
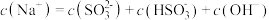
3.生成的
 沉淀会被空气中氧气氧化,写出
沉淀会被空气中氧气氧化,写出 被氧化过程的化学方程式为:
被氧化过程的化学方程式为:4.工业上也可以用氨水吸收尾气中的
 。氨水吸收
。氨水吸收 后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。
后,氨水全部转化为铵盐的溶液。为测定铵盐溶液的成分,设计如下实验。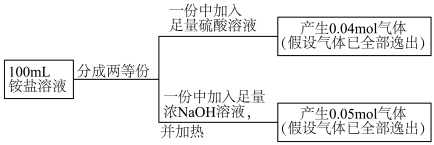
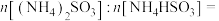
您最近一年使用:0次



