以大洋锰结核(主要由MnO2和铁氧化物组成,还含有Al、Mg、Zn、Ca、Si等元素)为原料,制备MnxOy及Mn(H2PO4)2·2H2O,所得产品具有广泛的用途。制备过程如下图所示:
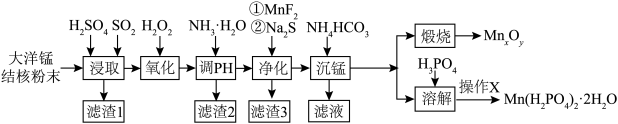
已知:①金属离子浓度≤10-5mol/L时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
②25℃时,Ksp(ZnS)=2.9×10-25;Ksp(MnF2)=5.3×10-3;Ksp(MgF2)=7.4×10-11;Ksp(MnCO3)=1.0×10-11。
(1)基态锰原子的价层电子轨道表示式为___________ 。
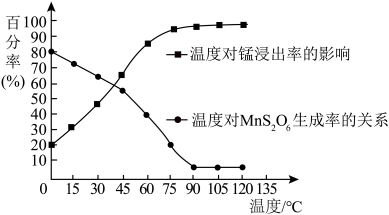
(2)“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式___________ 。温度对锰的浸出率、MnS2O6生成率的影响如图所示,为了减少副产物的生成,最适宜的温度___________ 。
(3)“调pH”时,应控制的pH范围是___________ 。“净化”后滤渣3的主要成分___________ 。
(4)“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为___________ 。若改用加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq)  Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = ___________ (填数值)。
(5)要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为___________ 、过滤、洗涤、干燥。
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
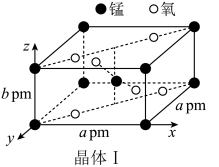
①晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。阿伏伽德罗常数为NA mol-1,则晶体Ⅰ的密度为___________ g·cm-3。
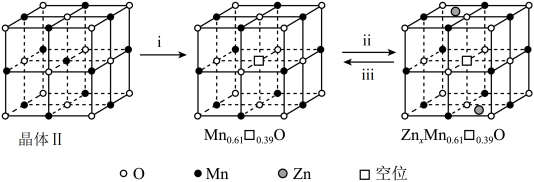
②晶体Ⅱ可作电池正极材料,通过Zn2+在晶体Ⅱ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ii”代表电池___________ (填“充电”或“放电”)过程,“iii”的电极反应式为___________ 。

已知:①金属离子浓度≤10-5mol/L时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
(1)基态锰原子的价层电子轨道表示式为
(2)“浸取”时,有副产物MnS2O6生成,请写出该副反应的化学方程式

(3)“调pH”时,应控制的pH范围是
(4)“沉锰”时,加入过量NH4HCO3溶液,该反应的离子方程式为
 Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K =
Mn(OH)2(s)+CO32-(aq),25℃时,计算该反应的平衡常数的对数值lg K = (5)要将“溶解”后的溶液制得Mn(H2PO4)2·2H2O晶体,操作X为
(6)“煅烧”时,不同条件下煅烧可制得不同锰的氧化物晶体。
①晶体Ⅰ可作脱硫剂,其长方体晶胞结构如图。阿伏伽德罗常数为NA mol-1,则晶体Ⅰ的密度为

②晶体Ⅱ可作电池正极材料,通过Zn2+在晶体Ⅱ中嵌入和脱嵌,实现电极材料充放电的原理如图所示。“ii”代表电池

更新时间:2024-03-31 17:16:27
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】全球空气污染日趋严重,消除氮氧化物污染对建设宜居环境有重要意义。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1①
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1②
N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ·mol-1③
某反应的平衡常数表达式为K=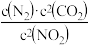 ,写出该反应的热化学方程式
,写出该反应的热化学方程式___________ 。
(2)利用氨气可将汽车尾气中的NOx还原为N2和H2O,反应原理是:NO(g)+NO2(g)+2NH3(g) 3H2O(g)+2N2(g) ΔH
3H2O(g)+2N2(g) ΔH
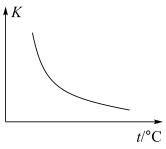
①该反应化学平衡常数K与温度t关系如上图所示,则ΔH___________ 0(填“>”、“<”或“=”)。
②能增加平衡时NOx去除率的条件是___________ 。
A.高温高压 B.低温低压 C.选择优异催化剂 D.一定条件下分离出水
③500℃时,在2 L恒容密闭容器中充入1 mol NO、1 mol NO2和2 mol NH3,10 min时反应达到平衡,此时NH3的转化率为50%,体系压强为pMPa,则0~10 min内用NH3表示的平均反应速率v(NH3)=___________ ,该反应的平衡常数Kp=___________ Mpa(用含p的代数式表示,某组分B的平衡压强p(B)可代替物质的量浓度c(B),如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
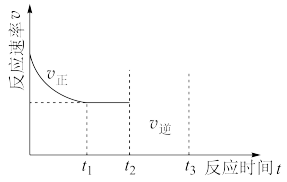
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。向一恒压密闭容器中加入活性炭(足量)和NO,t1时到达平衡。在t2时刻继续充入一定量NO,t3时刻重新到达平衡,请在下图中作出逆反应速率在t2~t3变化的曲线
N2(g)+CO2(g)。向一恒压密闭容器中加入活性炭(足量)和NO,t1时到达平衡。在t2时刻继续充入一定量NO,t3时刻重新到达平衡,请在下图中作出逆反应速率在t2~t3变化的曲线___________ 。
(4)在恒温恒容密闭容器中发生反应C(s)+2NO(g) N2(g)+CO2(g) ,下列说法正确的是___________。
N2(g)+CO2(g) ,下列说法正确的是___________。
(1)已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1①
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ·mol-1②
N2(g)+O2(g)=2NO(g) ΔH3=+181 kJ·mol-1③
某反应的平衡常数表达式为K=
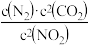 ,写出该反应的热化学方程式
,写出该反应的热化学方程式(2)利用氨气可将汽车尾气中的NOx还原为N2和H2O,反应原理是:NO(g)+NO2(g)+2NH3(g)
 3H2O(g)+2N2(g) ΔH
3H2O(g)+2N2(g) ΔH
①该反应化学平衡常数K与温度t关系如上图所示,则ΔH
②能增加平衡时NOx去除率的条件是
A.高温高压 B.低温低压 C.选择优异催化剂 D.一定条件下分离出水
③500℃时,在2 L恒容密闭容器中充入1 mol NO、1 mol NO2和2 mol NH3,10 min时反应达到平衡,此时NH3的转化率为50%,体系压强为pMPa,则0~10 min内用NH3表示的平均反应速率v(NH3)=
(3)用活性炭还原法处理氮氧化物的有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。向一恒压密闭容器中加入活性炭(足量)和NO,t1时到达平衡。在t2时刻继续充入一定量NO,t3时刻重新到达平衡,请在下图中作出逆反应速率在t2~t3变化的曲线
N2(g)+CO2(g)。向一恒压密闭容器中加入活性炭(足量)和NO,t1时到达平衡。在t2时刻继续充入一定量NO,t3时刻重新到达平衡,请在下图中作出逆反应速率在t2~t3变化的曲线
(4)在恒温恒容密闭容器中发生反应C(s)+2NO(g)
 N2(g)+CO2(g) ,下列说法正确的是___________。
N2(g)+CO2(g) ,下列说法正确的是___________。| A.NO与CO2的物质的量之比不变时说明反应已达平衡 |
| B.混合气体的压强不变时说明反应已达平衡 |
| C.该反应能否自发的判断依据主要由ΔH决定 |
| D.增加碳的量,导致Qc<K,平衡正向移动 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】为实现碳中和目标,利用CO、CO2加氢制甲醇的有关反应如下:
反应Ⅰ 2H2(g)+CO(g) CH3OH(g) ΔH1<0
CH3OH(g) ΔH1<0
反应Ⅱ H2(g)+CO2(g) CO(g)+H2O(g) ΔH2>0
CO(g)+H2O(g) ΔH2>0
反应Ⅲ 3H2(g)+CO2(g) CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3
回答下列问题:
(1)反应Ⅰ的ΔH1=___________ (用含ΔH2、ΔH3的式子表示)。
(2)一定条件下,在容积恒定为V L的密闭容器中充入1 mol CO和2 mol H2,在催化剂作用下发生上述反应Ⅰ,CO的平衡转化率与温度、压强的关系如图1所示。
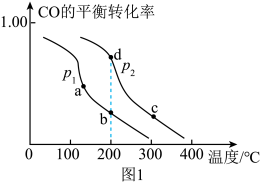
①图中b、c、d三点的化学平衡常数分别为Kb、Kc、Kd,它们的大小关系为___________ 。
②比较体系中气体平均摩尔质量:M(b)___________ (填“>”、“<”或“=”)M(d)。
③下列措施中能够同时增大正反应速率和提高CO的平衡转化率的是___________ (填字母)。
A.使用高效催化剂 B.降低反应温度
C.再充入2 mol CO和4 mol H2 D.不断将甲醇从体系中分离出来
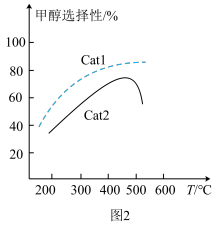
(3)在密闭容器中充入CO2、H2,发生上述反应Ⅱ和反应Ⅲ,在不同催化剂Cat1、Cat2作用下,测得温度与甲醇选择性的关系如图2所示。在其他条件相同时,若想主要发生反应Ⅲ,应选择催化效率较高的___________ (填“Cat1”或“Cat2”)催化剂。
(4)在不同温度、压强和相同催化剂条件下,发生反应Ⅲ,初始时CO2和H2的物质的量分别为1.0 mol、3.0 mol,测得H2的平衡转化率[α(H2)]随温度和压强的变化如图3所示。

①图中压强p1、p2、p3由小到大的顺序为___________ 。
②250 ℃、p3条件下,该反应的平衡常数Kp=___________ (用含p3的代数式表示,分压=总压×物质的量分数)。
反应Ⅰ 2H2(g)+CO(g)
 CH3OH(g) ΔH1<0
CH3OH(g) ΔH1<0反应Ⅱ H2(g)+CO2(g)
 CO(g)+H2O(g) ΔH2>0
CO(g)+H2O(g) ΔH2>0反应Ⅲ 3H2(g)+CO2(g)
 CH3OH(g)+H2O(g) ΔH3
CH3OH(g)+H2O(g) ΔH3回答下列问题:
(1)反应Ⅰ的ΔH1=
(2)一定条件下,在容积恒定为V L的密闭容器中充入1 mol CO和2 mol H2,在催化剂作用下发生上述反应Ⅰ,CO的平衡转化率与温度、压强的关系如图1所示。

①图中b、c、d三点的化学平衡常数分别为Kb、Kc、Kd,它们的大小关系为
②比较体系中气体平均摩尔质量:M(b)
③下列措施中能够同时增大正反应速率和提高CO的平衡转化率的是
A.使用高效催化剂 B.降低反应温度
C.再充入2 mol CO和4 mol H2 D.不断将甲醇从体系中分离出来
(3)在密闭容器中充入CO2、H2,发生上述反应Ⅱ和反应Ⅲ,在不同催化剂Cat1、Cat2作用下,测得温度与甲醇选择性的关系如图2所示。在其他条件相同时,若想主要发生反应Ⅲ,应选择催化效率较高的

(4)在不同温度、压强和相同催化剂条件下,发生反应Ⅲ,初始时CO2和H2的物质的量分别为1.0 mol、3.0 mol,测得H2的平衡转化率[α(H2)]随温度和压强的变化如图3所示。

①图中压强p1、p2、p3由小到大的顺序为
②250 ℃、p3条件下,该反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】2023年杭州亚运会主火炬创新使用了绿色“零碳甲醇”作为燃料,这不仅在亚运史上是第一次,在全球大型体育赛事上也是首次实现了废碳的再生利用。“零碳甲醇”是符合“碳中和”属性的绿色能源。
请回答下列问题:
(1)工业上主要利用以下反应合成甲醇: 。已知在一定条件下该反应的
。已知在一定条件下该反应的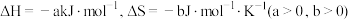 ,假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围
,假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围___________ K(用含a、b的代数式表示)。
(2) 合成甲醇的工艺主要分为两类,一类称为直接法:
合成甲醇的工艺主要分为两类,一类称为直接法: 直接加
直接加 合成甲醇;一类称为间接法:
合成甲醇;一类称为间接法: 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成 后,
后, 和
和 再合成甲醇。
再合成甲醇。
Ⅰ.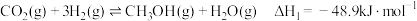
Ⅱ.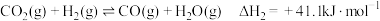
Ⅲ.
①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是___________ (填字母)。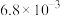 ,寻找催化效率高、选择性高的催化剂是推动该反应投入实际生产的一个重要研究方向。在某催化剂下,反应Ⅲ的反应历程(图中的数据表示的仅为微粒的数目以及各个段微粒的相对总能量,*表示吸附在催化剂上)如图所示:
,寻找催化效率高、选择性高的催化剂是推动该反应投入实际生产的一个重要研究方向。在某催化剂下,反应Ⅲ的反应历程(图中的数据表示的仅为微粒的数目以及各个段微粒的相对总能量,*表示吸附在催化剂上)如图所示:___________ 。
③工业生产中测定体系的压强具有实际意义。一定温度下,仅利用反应直接合成甲醇,将体积分数为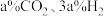 的进料气(含杂质气体),以
的进料气(含杂质气体),以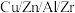 纳米纤维为催化剂,控制压强为
纳米纤维为催化剂,控制压强为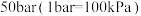 发生反应Ⅰ,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
发生反应Ⅰ,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
___________  ,反应Ⅰ的平衡常数
,反应Ⅰ的平衡常数
___________  (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示)。
为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示)。
(3)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是___________ ,理由是___________ 。
请回答下列问题:
(1)工业上主要利用以下反应合成甲醇:
 。已知在一定条件下该反应的
。已知在一定条件下该反应的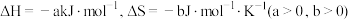 ,假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围
,假设该反应的焓变和熵变不随温度的改变而改变,请计算该反应能够发生的适宜温度T的取值范围(2)
 合成甲醇的工艺主要分为两类,一类称为直接法:
合成甲醇的工艺主要分为两类,一类称为直接法: 直接加
直接加 合成甲醇;一类称为间接法:
合成甲醇;一类称为间接法: 和
和 通过逆水煤气反应,先合成
通过逆水煤气反应,先合成 后,
后, 和
和 再合成甲醇。
再合成甲醇。Ⅰ.
Ⅱ.
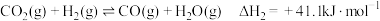
Ⅲ.

①若利用间接工艺法合成甲醇,反应的决速步为逆水煤气反应,下列示意图中能体现上述反应体系能量变化的是
A.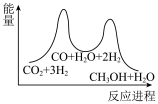 B.
B.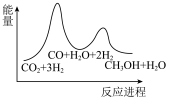
C. D.
D.
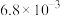 ,寻找催化效率高、选择性高的催化剂是推动该反应投入实际生产的一个重要研究方向。在某催化剂下,反应Ⅲ的反应历程(图中的数据表示的仅为微粒的数目以及各个段微粒的相对总能量,*表示吸附在催化剂上)如图所示:
,寻找催化效率高、选择性高的催化剂是推动该反应投入实际生产的一个重要研究方向。在某催化剂下,反应Ⅲ的反应历程(图中的数据表示的仅为微粒的数目以及各个段微粒的相对总能量,*表示吸附在催化剂上)如图所示: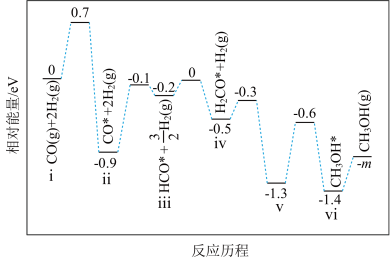
③工业生产中测定体系的压强具有实际意义。一定温度下,仅利用反应直接合成甲醇,将体积分数为
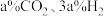 的进料气(含杂质气体),以
的进料气(含杂质气体),以 纳米纤维为催化剂,控制压强为
纳米纤维为催化剂,控制压强为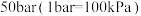 发生反应Ⅰ,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
发生反应Ⅰ,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
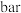 ,反应Ⅰ的平衡常数
,反应Ⅰ的平衡常数
 (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示)。
为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示)。(3)甲醇便于运输,是一种具有前景的液体燃料,利用手持技术,通过测定甲醇、乙醇、正丙醇等三种物质在温度传感器尖头处蒸发时的温度变化曲线,根据曲线下降的幅度和速率的快慢,可以比较它们之间的分子间作用力的大小。请判断表示甲醇的曲线是

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】原子序数小于等于36的Q、W、X、Y、Z五种元素,其中Q是形成化合物种类最多的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是______ 。
(2)1molQWX与1molWQ2Y所含σ键的比值为______ 。
(3)根据等电子体理论可以预测WXY-的空间构型为______ 。
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为______ 。
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。______ 。
②该化合物所属晶体类型为______ 晶体,预测其熔点应______ 金刚石(填“高于”或“低于”)。
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
(2)1molQWX与1molWQ2Y所含σ键的比值为
(3)根据等电子体理论可以预测WXY-的空间构型为
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。
②该化合物所属晶体类型为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
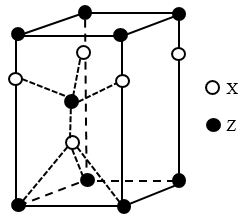
【推荐2】中国是最早发现并使用青铜器的国家。司母戊鼎是迄今为止出土的世界上最大、最重的青铜礼器,享有“镇国之宝”的美誉(如图1)。
(1)Cu原子的外围电子排布式为_____ 。
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是____ ,I3远大于I2的原因是______ 。
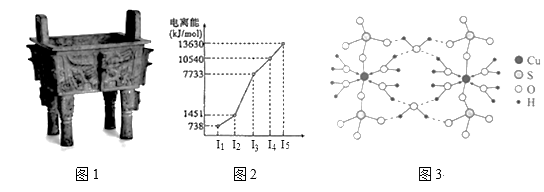
(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为_____ ,试判断H2O和SO42-的键角大小关系并说明原因_____ 。
②图3中的氢键有(H2O)O—H···O(H2O)和_______ 。
③写出该配合物的化学式_______ 。
(4)一种铜的氯化物晶胞结构如图所示。
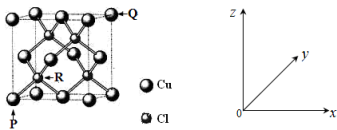
该化合物的化学式为______ ,已知P、Q、R的原子坐标分别(0,0,0)、(1,1,1)、( ,
, ,
, ),若Cu原子与最近的Cl原子的核间距为apm,则该晶体的密度计算表达式为
),若Cu原子与最近的Cl原子的核间距为apm,则该晶体的密度计算表达式为______ 。
(1)Cu原子的外围电子排布式为
(2)图2所示为第四周期某主族元素的第一至五电离能数据,该元素是

(3)图3是某含铜配合物的晶体结构示意图。
①晶体中H2O和SO42-的中心原子的杂化类型为
②图3中的氢键有(H2O)O—H···O(H2O)和
③写出该配合物的化学式
(4)一种铜的氯化物晶胞结构如图所示。

该化合物的化学式为
 ,
, ,
, ),若Cu原子与最近的Cl原子的核间距为apm,则该晶体的密度计算表达式为
),若Cu原子与最近的Cl原子的核间距为apm,则该晶体的密度计算表达式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】硫及其化合物有许多用途,相关物质的物理常数如下表所示:

回答下列问题:
(1)基态S原子电子占据最高能级的电子云轮廓图为__________ 形。
(2)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为________ 。
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为__________ 形,其中共价键的类型有__________ 种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________ 。
(4)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__________ 。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为____________ g/cm3;晶胞中Fe2+位于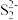 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为__________ nm。
晶胞有两个基本要素:
(6)晶胞的一个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为__________ 。

| H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
| 熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
| 沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |

回答下列问题:
(1)基态S原子电子占据最高能级的电子云轮廓图为
(2)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为
(3)气态三氧化硫以单分子形式存在,其分子的立体构型为
(4)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加 德罗常数的值为NA,其晶体密度的计算表达式为
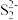 所形成的正八面体的体心,该正八面体的边长为
所形成的正八面体的体心,该正八面体的边长为晶胞有两个基本要素:
(6)晶胞的一个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】用一种硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)制取盆景肥料NH4Fe(SO4)2及铝硅合金材料的工艺流程如下 :
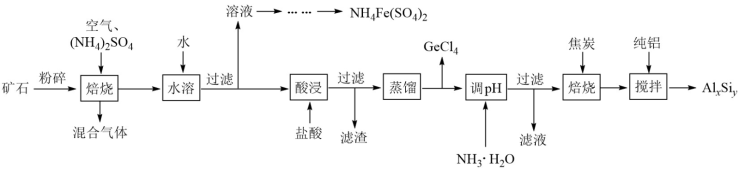
(1)“矿石”粉碎的目的是_____________________ 。
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为____________________ 。
②“混合气体”的主要成分是_______________ (填化学式).
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为_______________ 。 Al2O3也能发生类似反应.这两种氧化物转化为硫酸盐的转化率与温度的关系如图,上述流程中最适宜的“焙烧” 温度为_____________________ 。

(3)GeCl4的沸点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是_________ 。
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为______________________ 。
(5)假设流程中SiO2损失了20%,Al2O3损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=______________ 。

(1)“矿石”粉碎的目的是
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为
②“混合气体”的主要成分是
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为

(3)GeCl4的沸点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为
(5)假设流程中SiO2损失了20%,Al2O3损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】某种废弃电子元器件的主要成分为CuS、BeO,还含有少量的FeS、 等,实验室中以其为原料提取金属Be和胆矾的工艺流程如图。
等,实验室中以其为原料提取金属Be和胆矾的工艺流程如图。
回答下列问题:
(1)基态Fe、Cu原子核外未成对电子数之比为___________ 。
(2)BeO为两性氧化物,BeO在“碱浸”工序时发生反应的离子方程式为___________ 。
(3)滤液1的主要成分为___________ 。工业上可电解熔融 制备金属铍,电解过程中加入
制备金属铍,电解过程中加入 或NaCl,其作用是
或NaCl,其作用是___________ 。
(4)“氧化”工序时FeS发生反应的离子方程式为___________ 。
(5)加试剂X调pH可得 沉淀和滤液2,则所加试剂X为
沉淀和滤液2,则所加试剂X为___________ ,所调pH的范围为___________ 。
(6)请你以 、铁粉和稀硫酸为原料,设计一个简单的实验方案制备绿矾
、铁粉和稀硫酸为原料,设计一个简单的实验方案制备绿矾___________ 。
 等,实验室中以其为原料提取金属Be和胆矾的工艺流程如图。
等,实验室中以其为原料提取金属Be和胆矾的工艺流程如图。
| 金属阳离子 |  |  |  |
| 开始沉淀的pH | 2.2 | 5.8 | 4.2 |
| 沉淀完全的pH | 3.2 | 8.8 | 7.7 |
(1)基态Fe、Cu原子核外未成对电子数之比为
(2)BeO为两性氧化物,BeO在“碱浸”工序时发生反应的离子方程式为
(3)滤液1的主要成分为
 制备金属铍,电解过程中加入
制备金属铍,电解过程中加入 或NaCl,其作用是
或NaCl,其作用是(4)“氧化”工序时FeS发生反应的离子方程式为
(5)加试剂X调pH可得
 沉淀和滤液2,则所加试剂X为
沉淀和滤液2,则所加试剂X为(6)请你以
 、铁粉和稀硫酸为原料,设计一个简单的实验方案制备绿矾
、铁粉和稀硫酸为原料,设计一个简单的实验方案制备绿矾
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
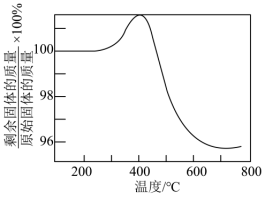
【推荐3】利用某工厂废水(主要成分含有 、
、 、
、 ,及少量
,及少量 、
、 、
、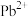 )制备
)制备 溶液的实验流程如下:
溶液的实验流程如下:

已知:①溶液中金属离子的浓度小于 时,可视为沉淀完全。
时,可视为沉淀完全。
②室温下 。
。
(1)①“氧化”步骤的离子方程式为___________ 。
②调节 的目的是
的目的是___________ 。
(2)流程中分两步除杂而不采用直接加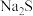 溶液除杂,除了减少
溶液除杂,除了减少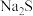 的使用量之外,还可能的原因是:
的使用量之外,还可能的原因是:___________ 。
(3)以 溶液为原料制备的
溶液为原料制备的 脱硫剂,可用于脱除煤气中的
脱硫剂,可用于脱除煤气中的 。
。
①400℃时,将一定比例 、
、 、
、 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有 脱硫剂的硫化反应器。硫化过程中
脱硫剂的硫化反应器。硫化过程中 与
与 、
、 反应生成
反应生成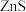 和
和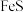 ,其化学方程式为
,其化学方程式为___________ 。
②将硫化后的固体在 (体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是___________ 。
 、
、 、
、 ,及少量
,及少量 、
、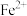 、
、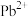 )制备
)制备 溶液的实验流程如下:
溶液的实验流程如下:
已知:①溶液中金属离子的浓度小于
 时,可视为沉淀完全。
时,可视为沉淀完全。②室温下
 。
。(1)①“氧化”步骤的离子方程式为
②调节
 的目的是
的目的是(2)流程中分两步除杂而不采用直接加
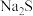 溶液除杂,除了减少
溶液除杂,除了减少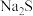 的使用量之外,还可能的原因是:
的使用量之外,还可能的原因是:(3)以
 溶液为原料制备的
溶液为原料制备的 脱硫剂,可用于脱除煤气中的
脱硫剂,可用于脱除煤气中的 。
。①400℃时,将一定比例
 、
、 、
、 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有 脱硫剂的硫化反应器。硫化过程中
脱硫剂的硫化反应器。硫化过程中 与
与 、
、 反应生成
反应生成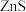 和
和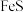 ,其化学方程式为
,其化学方程式为②将硫化后的固体在
 (体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)制备精细无机化工产品“三盐”(3PbO·PbSO4·H2O),主要制备流程如下:
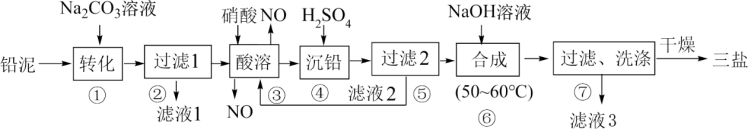
(1)步骤①PbSO4(难溶)转化为PbCO3(难溶)的离子方程式为_______ 。
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为_______ 写化学式)。
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为_______ ;滤液2中溶质主要成分为_______ (写化学式)。
(4)步骤⑥合成三盐的化学方程式为_______ 。

(1)步骤①PbSO4(难溶)转化为PbCO3(难溶)的离子方程式为
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为
(4)步骤⑥合成三盐的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】焦亚硫酸钠(Na2S2O5)是一种常用的食品添加剂,有抗氧化的作用,其生产工艺流程如图所示。
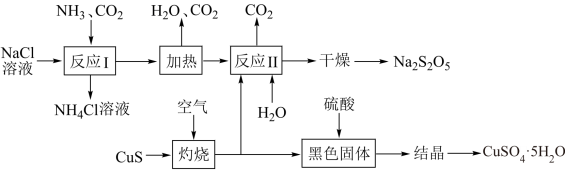
已知:在反应II中,测得水溶液的pH=4.1后停止反应;反应II中的产物经过干燥、加热脱水后可制备得到Na2S2O5固体。
(1)反应I是侯氏制碱法的核心步骤,其具体操作是先向饱和NaCl溶液中通入___________ (填“CO2”或“NH3”),请写出反应的化学方程式___________ 。
(2)“灼烧”时发生的氧化还原反应中,氧化剂和还原剂的物质的量之比为___________ 。
(3)反应II制得的主要产物是___________ 。
(4)将生产过程中产生的黑色固体溶于稀硫酸后得到澄清透明的溶液,对该溶液进行___________ 、洗涤、干燥等一系列操作后得到副产品CuSO4·5H2O。
(5)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为___________ 。
(6)由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中的Na2S2O5残留量时,取40.00mL葡萄酒样品,向其中加入淀粉溶液并用0.02000 mol/L的碘的标准溶液滴定至终点,消耗碘标准液5.00mL,滴定终点的现象是___________ ,该葡萄酒样品中Na2S2O5的残留量为___________ g/L。

已知:在反应II中,测得水溶液的pH=4.1后停止反应;反应II中的产物经过干燥、加热脱水后可制备得到Na2S2O5固体。
(1)反应I是侯氏制碱法的核心步骤,其具体操作是先向饱和NaCl溶液中通入
(2)“灼烧”时发生的氧化还原反应中,氧化剂和还原剂的物质的量之比为
(3)反应II制得的主要产物是
(4)将生产过程中产生的黑色固体溶于稀硫酸后得到澄清透明的溶液,对该溶液进行
(5)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为
(6)由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中的Na2S2O5残留量时,取40.00mL葡萄酒样品,向其中加入淀粉溶液并用0.02000 mol/L的碘的标准溶液滴定至终点,消耗碘标准液5.00mL,滴定终点的现象是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】二茂铁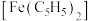 是重要的燃料抗爆剂,其难溶于水,易溶于乙醚等有机溶剂,100℃时易升华,图一是实验室制备二茂铁装置示意图,图二是提纯二茂铁的装置示意图。
是重要的燃料抗爆剂,其难溶于水,易溶于乙醚等有机溶剂,100℃时易升华,图一是实验室制备二茂铁装置示意图,图二是提纯二茂铁的装置示意图。

已知:制备二茂铁的反应原理:
密度:乙醚 < 水
实验步骤为:
①在仪器c中加入稍过量的 粉末,并从仪器a中加入
粉末,并从仪器a中加入 无水乙醚到烧瓶中,充分搅拌,同时通氮气约
无水乙醚到烧瓶中,充分搅拌,同时通氮气约 ;
;
②再从仪器a滴入 新蒸馏的环戊二烯(
新蒸馏的环戊二烯(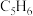 ,密度为
,密度为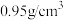 ),搅拌;
),搅拌;
③将适量无水 与
与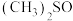 (二甲亚砜,作溶剂)配成的溶液
(二甲亚砜,作溶剂)配成的溶液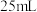 装入仪器a中,慢慢滴入仪器c中,
装入仪器a中,慢慢滴入仪器c中,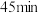 滴完,继续搅拌
滴完,继续搅拌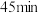 ;
;
④再从仪器a加入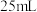 无水乙醚搅拌;
无水乙醚搅拌;
⑤将仪器c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器a的名称是_______ ,仪器b的作用是_______ 。
(2)步骤①中通入氮气的目的是_______ 。
(3)下列对本实验描述错误的是_______(填序号)。
(4)步骤⑤用盐酸洗涤的目的是_______ ,水洗的目的是_______ 。
(5)步骤⑤在洗涤、分液操作中,应充分振荡,然后静置,待分层后的操作是_______(填序号)。
(6)图二是二茂铁粗产品的提纯,该操作中棉花的作用是_______ 。
(7)若本次实验消耗环戊二烯 ,其它物质足量,所得产品二茂铁的质量为
,其它物质足量,所得产品二茂铁的质量为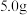 ,该实验的产率为
,该实验的产率为_______ (保留3位有效数字)。
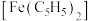 是重要的燃料抗爆剂,其难溶于水,易溶于乙醚等有机溶剂,100℃时易升华,图一是实验室制备二茂铁装置示意图,图二是提纯二茂铁的装置示意图。
是重要的燃料抗爆剂,其难溶于水,易溶于乙醚等有机溶剂,100℃时易升华,图一是实验室制备二茂铁装置示意图,图二是提纯二茂铁的装置示意图。
已知:制备二茂铁的反应原理:

密度:乙醚 < 水
实验步骤为:
①在仪器c中加入稍过量的
 粉末,并从仪器a中加入
粉末,并从仪器a中加入 无水乙醚到烧瓶中,充分搅拌,同时通氮气约
无水乙醚到烧瓶中,充分搅拌,同时通氮气约 ;
;②再从仪器a滴入
 新蒸馏的环戊二烯(
新蒸馏的环戊二烯(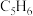 ,密度为
,密度为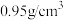 ),搅拌;
),搅拌;③将适量无水
 与
与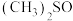 (二甲亚砜,作溶剂)配成的溶液
(二甲亚砜,作溶剂)配成的溶液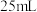 装入仪器a中,慢慢滴入仪器c中,
装入仪器a中,慢慢滴入仪器c中,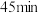 滴完,继续搅拌
滴完,继续搅拌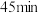 ;
;④再从仪器a加入
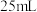 无水乙醚搅拌;
无水乙醚搅拌;⑤将仪器c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器a的名称是
(2)步骤①中通入氮气的目的是
(3)下列对本实验描述错误的是_______(填序号)。
| A.实验中所加乙醚主要起溶剂的作用 |
B.根据所加试剂的量,选用容积为 的三颈烧瓶 的三颈烧瓶 |
| C.欲确认得到的二茂铁是否纯净,可以测定其是否有固定的熔点 |
| D.步骤⑥在操作过程中温度不宜太高 |
(5)步骤⑤在洗涤、分液操作中,应充分振荡,然后静置,待分层后的操作是_______(填序号)。
| A.直接将二茂铁乙醚溶液从分液漏斗上口倒出 |
| B.直接将二茂铁乙醚溶液从分液漏斗下口放出 |
| C.先将水层从分液漏斗的下口放出,再将二茂铁乙醚溶液从下口放出 |
| D.先将水层从分液漏斗的下口放出,再将二茂铁乙醚溶液从上口倒出 |
(7)若本次实验消耗环戊二烯
 ,其它物质足量,所得产品二茂铁的质量为
,其它物质足量,所得产品二茂铁的质量为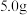 ,该实验的产率为
,该实验的产率为
您最近一年使用:0次



