I. 是一种常见的酸,
是一种常见的酸,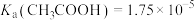 ,可以形成多种醋酸盐。回答下列问题:
,可以形成多种醋酸盐。回答下列问题:
(1)在室温下, 醋酸钠溶液的
醋酸钠溶液的 约为
约为___________ 。
(2)在室温下,若下列溶液的物质的量浓度相同:① ②
② ③
③ ④
④ ,则
,则 从大到小的顺序为
从大到小的顺序为___________ 。
(3)在室温下,等物质的量浓度的 与
与 以体积比
以体积比 混合,混合后溶液的
混合,混合后溶液的 ,求
,求
___________ (写出计算结果的表达式)。
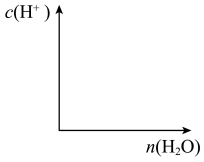
(4)冰醋酸中加入一定量的水,可以得到各种不同浓度的醋酸溶液。在下方坐标系中画出随着水的加入量增加, 的变化曲线
的变化曲线__________ 。
II.已知次磷酸 是一种一元弱酸;电离平衡常数
是一种一元弱酸;电离平衡常数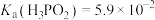 。
。
(5)写出次磷酸与足量 反应的离子方程式
反应的离子方程式___________ 。
(6)下列说法正确的是___________(填字母)。
 是一种常见的酸,
是一种常见的酸,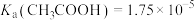 ,可以形成多种醋酸盐。回答下列问题:
,可以形成多种醋酸盐。回答下列问题:(1)在室温下,
 醋酸钠溶液的
醋酸钠溶液的 约为
约为(2)在室温下,若下列溶液的物质的量浓度相同:①
 ②
② ③
③ ④
④ ,则
,则 从大到小的顺序为
从大到小的顺序为(3)在室温下,等物质的量浓度的
 与
与 以体积比
以体积比 混合,混合后溶液的
混合,混合后溶液的 ,求
,求
(4)冰醋酸中加入一定量的水,可以得到各种不同浓度的醋酸溶液。在下方坐标系中画出随着水的加入量增加,
 的变化曲线
的变化曲线
II.已知次磷酸
 是一种一元弱酸;电离平衡常数
是一种一元弱酸;电离平衡常数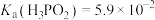 。
。(5)写出次磷酸与足量
 反应的离子方程式
反应的离子方程式(6)下列说法正确的是___________(填字母)。
A.导电能力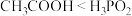 |
B. 溶液中加入小苏打,可以看到气泡 溶液中加入小苏打,可以看到气泡 |
C. 溶液中的离子种类比 溶液中的离子种类比 溶液中的离子种类多 溶液中的离子种类多 |
D.常温下,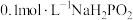 溶液的 溶液的 比 比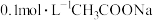 溶液的 溶液的 小 小 |
更新时间:2023-11-08 20:15:11
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H
反应1:Fe2O3(s)+3C(石墨,s) 2Fe(s)+3CO(g) △H 1
2Fe(s)+3CO(g) △H 1
反应2:C(石墨,s)+CO2(g) 2CO(g) △H 2
2CO(g) △H 2
①△H=__ (用含△H1、△H2代数式表示)
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO(Fe足量),则平衡__ 移动(填“正向”或“逆向”),达到新平衡后c(CO)将__ (填“变大”、“变小”或“不变”)
(2)氯化铵常用作除锈剂,其水溶液呈酸性的原因是__ 。
(3)硫酸铝水解的离子方程式是__ ,为了抑制其水解,配制时可以加入少量的__ 。
(4)泡沫灭火器中装的灭火剂主要包括硫酸铝溶液、碳酸氢钠溶液。泡沫灭火器内置的玻璃筒应装__ 溶液,外部的铁筒装另一种溶液。
 2Fe(s)+3CO2(g) △H
2Fe(s)+3CO2(g) △H反应1:Fe2O3(s)+3C(石墨,s)
 2Fe(s)+3CO(g) △H 1
2Fe(s)+3CO(g) △H 1反应2:C(石墨,s)+CO2(g)
 2CO(g) △H 2
2CO(g) △H 2①△H=
②保持温度不变,在恒容容器中进行反应1,达到平衡状态,再次充入一定量的CO(Fe足量),则平衡
(2)氯化铵常用作除锈剂,其水溶液呈酸性的原因是
(3)硫酸铝水解的离子方程式是
(4)泡沫灭火器中装的灭火剂主要包括硫酸铝溶液、碳酸氢钠溶液。泡沫灭火器内置的玻璃筒应装
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】Ⅰ.请回答下列问题:
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是____ 。
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是____ (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:____ 。
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=_____ (用含a的代数式表示)。
Ⅱ.结合表格回答下列问题(均为常温下的数据):
(4)0.1mol/L的KHC2O4溶液呈酸性,该溶液中各离子浓度由大到小的顺序为____ 。
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]____ [c(K+)-c(CH3COO-)](填“>”、“<”或“=”)。
(6)向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=____ 。(CH3COOH的电离平衡常数Ka=1.8×10-5)
(1)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示:

a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
(2)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
(3)已知常温时,amol/L醋酸在水中与0.1mol/LNaOH等体积混合,溶液为中性,则醋酸钠的水解平衡常数Kh=
Ⅱ.结合表格回答下列问题(均为常温下的数据):
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
| HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
(5)pH相同的NaClO和CH3COOK溶液中,[c(Na+)-c(C1O-)]
(6)向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】水溶液广泛存在于生命体及其赖以生存的环境中,许多化学反应都是在水溶液中进行的,溶液中的电离平衡、水解平衡和溶解平衡,与生命活动、日常生活、工农业生产和环境保护等息息相关。
Ⅰ.醋酸属于有机酸,是食醋的成分之一。纯净的无水乙酸因凝固点较低,常温下为无色晶体,称为冰醋酸。
(1)向1mol/LCH3COOH溶液中加水稀释,则稀释过程中,
________ (填“增大”“不变”或“减小”)。
Ⅱ.在一定温度下,冰醋酸加水过程中溶液的导电能力变化如图,请回答问题:
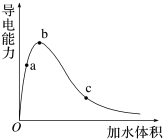
(2)a、b、c三点对应的溶液中,c(CH3COO-)由大到小的顺序是______________ 。
(3)a点到b点的过程中,溶液的pH_______ (填“增大”“不变”或“减小”)。
(4)浓度均为1mol/L且等体积的醋酸溶液和盐酸,恰好完全中和NaOH的物质的量_______ 。
A.醋酸溶液中和NaOH的物质的量多
B.盐酸中和NaOH的物质的量多
C.两者一样多
(5)醋酸溶液和氢氧化钠溶液恰好完全中和所得溶液呈_______ 性(填“酸”“碱”或“中”),原因是____________ (用离子方程式表示)。
Ⅲ.已知:25℃时Ksp(AgCl)=1.8×10-10,Ag2CrO4为砖红色沉淀。
(6)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl- 时,采用K2CrO4为指示剂,当溶液中的Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中的c(Ag+)=_______ mol/L,滴定终点现象为______________ 。
Ⅰ.醋酸属于有机酸,是食醋的成分之一。纯净的无水乙酸因凝固点较低,常温下为无色晶体,称为冰醋酸。
(1)向1mol/LCH3COOH溶液中加水稀释,则稀释过程中,

Ⅱ.在一定温度下,冰醋酸加水过程中溶液的导电能力变化如图,请回答问题:

(2)a、b、c三点对应的溶液中,c(CH3COO-)由大到小的顺序是
(3)a点到b点的过程中,溶液的pH
(4)浓度均为1mol/L且等体积的醋酸溶液和盐酸,恰好完全中和NaOH的物质的量
A.醋酸溶液中和NaOH的物质的量多
B.盐酸中和NaOH的物质的量多
C.两者一样多
(5)醋酸溶液和氢氧化钠溶液恰好完全中和所得溶液呈
Ⅲ.已知:25℃时Ksp(AgCl)=1.8×10-10,Ag2CrO4为砖红色沉淀。
(6)在化学分析中,以AgNO3标准溶液滴定溶液中的Cl- 时,采用K2CrO4为指示剂,当溶液中的Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中的c(Ag+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】氨和联氨 是氮的两种常见化合物,在工农业生产中有重要的应用。
是氮的两种常见化合物,在工农业生产中有重要的应用。
(1)联氨分子的电子式为___________
(2)联氨与盐酸反应生成重要的化工原料盐酸肼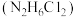 ,盐酸肼
,盐酸肼 属于离子化合物,易溶于水,溶液呈酸性,水解原理与
属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似。
类似。
①写出盐酸肼第一步水解反应的离子方程式___________ ;
②写出足量金属镁加入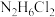 溶液中所发生反应的化学方程式
溶液中所发生反应的化学方程式___________ 。
(3)室温下,有物质的量浓度相等的下列物质的溶液:① ②
② ③
③ ④
④ ⑤
⑤ ,其中所含的c(
,其中所含的c( )由大到小的顺序是
)由大到小的顺序是___________ (用序号填空)
(4)工业生产硫酸过程中,通常用氨水吸收尾气
①如果在 时,相同物质的量的
时,相同物质的量的 与
与 溶于水,发生反应的离子方程式为
溶于水,发生反应的离子方程式为___________ ,所得溶液中
___________ (填序号)。
A.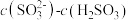 B.
B.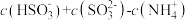
C.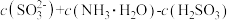 D.
D.
②已知在 时
时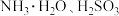 电离平衡常数可知,如下表,则上述所得溶液中,各离子浓度由大到小的顺序为
电离平衡常数可知,如下表,则上述所得溶液中,各离子浓度由大到小的顺序为______
 是氮的两种常见化合物,在工农业生产中有重要的应用。
是氮的两种常见化合物,在工农业生产中有重要的应用。(1)联氨分子的电子式为
(2)联氨与盐酸反应生成重要的化工原料盐酸肼
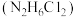 ,盐酸肼
,盐酸肼 属于离子化合物,易溶于水,溶液呈酸性,水解原理与
属于离子化合物,易溶于水,溶液呈酸性,水解原理与 类似。
类似。①写出盐酸肼第一步水解反应的离子方程式
②写出足量金属镁加入
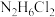 溶液中所发生反应的化学方程式
溶液中所发生反应的化学方程式(3)室温下,有物质的量浓度相等的下列物质的溶液:①
 ②
② ③
③ ④
④ ⑤
⑤ ,其中所含的c(
,其中所含的c( )由大到小的顺序是
)由大到小的顺序是(4)工业生产硫酸过程中,通常用氨水吸收尾气

①如果在
 时,相同物质的量的
时,相同物质的量的 与
与 溶于水,发生反应的离子方程式为
溶于水,发生反应的离子方程式为
A.
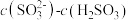 B.
B.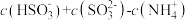
C.
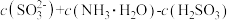 D.
D.
 |  | ||
| 电离平衡常数 | 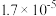 |  |  |
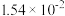 | 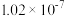 | ||
 时
时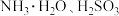 电离平衡常数可知,如下表,则上述所得溶液中,各离子浓度由大到小的顺序为
电离平衡常数可知,如下表,则上述所得溶液中,各离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题:
(1)25℃时,某Na2SO4溶液中c(SO )=1×10-4mol/L,则该溶液中c(Na+)∶c(OH-)=
)=1×10-4mol/L,则该溶液中c(Na+)∶c(OH-)=___ 。
(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,在该温度下,纯水的Kw=___ 。此时,将pH=12的NaOH溶液VaL与pH=2的H2SO4溶液VbL混合,所得混合液为中性,则Va︰Vb=___ 。
(3)25℃时,已知0.1mol·L-1CH3COONa溶液pH=8,
①该溶液中离子浓度由大到小排列的顺序为:___ 。
②精确表达下列算式的数学结果:c(Na+)-c(CH3COO-)=___ ;c(OH-)-c(CH3COOH)=___ 。
(1)25℃时,某Na2SO4溶液中c(SO
 )=1×10-4mol/L,则该溶液中c(Na+)∶c(OH-)=
)=1×10-4mol/L,则该溶液中c(Na+)∶c(OH-)=(2)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,在该温度下,纯水的Kw=
(3)25℃时,已知0.1mol·L-1CH3COONa溶液pH=8,
①该溶液中离子浓度由大到小排列的顺序为:
②精确表达下列算式的数学结果:c(Na+)-c(CH3COO-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,用0.1000mol/LNaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如图所示:

(1)判断滴定HCl溶液的曲线是________ (填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________ ;
(4)E点对应离子浓度由大到小的顺序为__________________________________ 。
(5)图1中,从A点到B点,溶液中水的电离程度逐渐________ (填“增大”或“减小”或“不变”);
(6)氢氧化钠溶液滴定盐酸溶液过程中,用酚酞作指示剂,请描述滴定终点的判断____________________________ 。

(1)判断滴定HCl溶液的曲线是
(2)a=
(3)c(Na+)=c(CH3COO-)的点是
(4)E点对应离子浓度由大到小的顺序为
(5)图1中,从A点到B点,溶液中水的电离程度逐渐
(6)氢氧化钠溶液滴定盐酸溶液过程中,用酚酞作指示剂,请描述滴定终点的判断
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的 溶液,所得溶液中
溶液,所得溶液中 、
、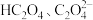 三种微粒的物质的量分数
三种微粒的物质的量分数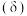 与溶液
与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:

(1) 的
的
___________ ,向 溶液中滴加少量的草酸溶液,写出其反应的离子方程式
溶液中滴加少量的草酸溶液,写出其反应的离子方程式___________ 。(已知 的
的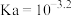 )
)
(2)若所得溶液溶质为 ,则该溶液显
,则该溶液显___________ (填“酸性”、“碱性”或“中性”),其原因是(从平衡常数的角度解释)___________ 。
(3)若所得溶液溶质为 ,此时溶液的
,此时溶液的 ,则溶液中水电离的
,则溶液中水电离的
___________ 
(4)当所得溶液 时,溶液中
时,溶液中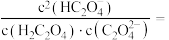
___________ 。
(5)已知 草酸钙的
草酸钙的 ,碳酸钙的
,碳酸钙的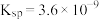 。回答下列问题:
。回答下列问题: 时向
时向 碳酸钙的饱和溶液中逐滴加入
碳酸钙的饱和溶液中逐滴加入 的草酸钾溶液
的草酸钾溶液 ,
,___________ 产生草酸钙沉淀(填“能”或“不能”)。
 溶液,所得溶液中
溶液,所得溶液中 、
、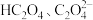 三种微粒的物质的量分数
三种微粒的物质的量分数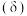 与溶液
与溶液 的关系如图所示,回答下列问题:
的关系如图所示,回答下列问题:
(1)
 的
的
 溶液中滴加少量的草酸溶液,写出其反应的离子方程式
溶液中滴加少量的草酸溶液,写出其反应的离子方程式 的
的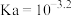 )
)(2)若所得溶液溶质为
 ,则该溶液显
,则该溶液显(3)若所得溶液溶质为
 ,此时溶液的
,此时溶液的 ,则溶液中水电离的
,则溶液中水电离的

(4)当所得溶液
 时,溶液中
时,溶液中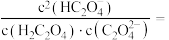
(5)已知
 草酸钙的
草酸钙的 ,碳酸钙的
,碳酸钙的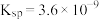 。回答下列问题:
。回答下列问题: 时向
时向 碳酸钙的饱和溶液中逐滴加入
碳酸钙的饱和溶液中逐滴加入 的草酸钾溶液
的草酸钾溶液 ,
,
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】Ⅰ.回答下列问题:
(1) 溶液蒸干得到的固体物质是
溶液蒸干得到的固体物质是_______ ,原因是_______ 。
(2) 溶液蒸干灼烧得到的固体物质是
溶液蒸干灼烧得到的固体物质是_______ ,原因是_______ 。
(3)将 的
的 溶液加热蒸干灼烧最后所得的固体是
溶液加热蒸干灼烧最后所得的固体是_______ ,原因是_______ 。
Ⅱ. 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。请回答下列问题:
高效,且腐蚀性小。请回答下列问题:
 在溶液中分三步水解:
在溶液中分三步水解:
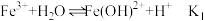

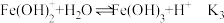
(4)以上水解反应的平衡常数 由大到小的顺序是
由大到小的顺序是_______ 。通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为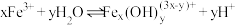 。欲使平衡正向移动可采用的方法是
。欲使平衡正向移动可采用的方法是_______ (填字母)。
a.降温 b.加水稀释 c.加入 d.加入
d.加入
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是_______ 。
(1)
 溶液蒸干得到的固体物质是
溶液蒸干得到的固体物质是(2)
 溶液蒸干灼烧得到的固体物质是
溶液蒸干灼烧得到的固体物质是(3)将
 的
的 溶液加热蒸干灼烧最后所得的固体是
溶液加热蒸干灼烧最后所得的固体是Ⅱ.
 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比 高效,且腐蚀性小。请回答下列问题:
高效,且腐蚀性小。请回答下列问题: 在溶液中分三步水解:
在溶液中分三步水解: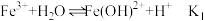

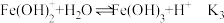
(4)以上水解反应的平衡常数
 由大到小的顺序是
由大到小的顺序是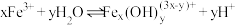 。欲使平衡正向移动可采用的方法是
。欲使平衡正向移动可采用的方法是a.降温 b.加水稀释 c.加入
 d.加入
d.加入
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)已知:常温下浓度为0.1mol/L的下列溶液的pH如表
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-_________ ClO-,浓度相等的NaClO和CH3COOK溶液中:[c(Na+)-c(ClO-)]__________ [c(K+)-c(CH3COO-)](填“>”“<”或“=”)
②HCO3-的水解常数为__________ (填写具体数值),在相同温度下,同浓度的CH3COOH、H2CO3、HClO三种酸溶液的导电能力大小为__________
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH_____ 14-a(>、<、=)
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中 =1×10-6。
=1×10-6。
①常温下,0.1mol﹒L-1HA溶液的pH=_____ ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:_____ 。
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=_____
| 溶质 | NaCl | CH3COOK | Na2CO3 | NaClO | NaHCO3 |
| pH | 7 | 8.1 | 11.6 | 9.7 | 8.3 |
①等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl-
②HCO3-的水解常数为
(2)常温下,向pH=a的醋酸中加入等体积NaOH时后呈中性,则此NaOH的pH
(3)常温下,已知0.1mol﹒L-1一元酸HA溶液中
 =1×10-6。
=1×10-6。①常温下,0.1mol﹒L-1HA溶液的pH=
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:
(4)常温下,amol/L氨水与等体积0.1mol/LH2SO4溶液混合后溶液显中性,则NH3·H2O的电离平衡常数Kb=
您最近一年使用:0次



