赤泥含有Sc2O3(氧化钪)、Al2O3、Fe2O3、SiO2等,以赤泥为原料提取钪(Sc)、氧化钪(Sc2O3)的流程如下:
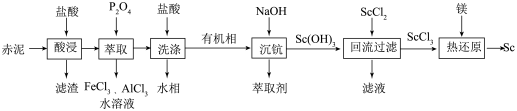
已知:①P2O4为磷酸酯萃取剂;②Sc3+易水解;③Ksp[Sc(OH)3]=8.00×10-31。
请回答下列问题:
(1)滤渣主要成分是___________ (填化学式)。
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是___________ 。
(3)“回流过滤”中SOCl2作用有将Sc(OH)3转化成ScCl3、作溶剂和___________ 。
(4)“热还原”的化学方程式为___________ 。
(5)利用ScCl3制备Sc2O3的方法是ScCl3溶于水,加入草酸产生草酸钪沉淀,过滤洗涤灼烧(空气中)草酸钪得到Sc2O3。灼烧草酸钪的副产物主要是___________ 。(填化学式)。
(6)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时P2O4最佳浓度及料液温度分别为___________ ,___________ 。若“洗涤”操作于实验室中进行,所需玻璃仪器有___________ 。
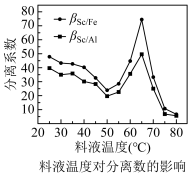
(7)已知:c(Sc3+)≤1.0×10-5mol·L-1时表明完全沉淀,萃取剂混合液的pH为6时是否完全沉淀?___________ (填“已完全沉淀”或“未完全沉淀”),通过计算作出判断:___________ 。

已知:①P2O4为磷酸酯萃取剂;②Sc3+易水解;③Ksp[Sc(OH)3]=8.00×10-31。
请回答下列问题:
(1)滤渣主要成分是
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是
(3)“回流过滤”中SOCl2作用有将Sc(OH)3转化成ScCl3、作溶剂和
(4)“热还原”的化学方程式为
(5)利用ScCl3制备Sc2O3的方法是ScCl3溶于水,加入草酸产生草酸钪沉淀,过滤洗涤灼烧(空气中)草酸钪得到Sc2O3。灼烧草酸钪的副产物主要是
(6)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如下所示,萃取时P2O4最佳浓度及料液温度分别为
| 试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
| 1-1 | 1 | 分相快 | 90.76 | 15.82 |
| 1-2 | 2 | 分相容易 | 91.53 | 19.23 |
| 1-3 | 3 | 分相容易 | 92.98 | 13.56 |
| 1-4 | 4 | 有第三相 | 90.69 | 30.12 |
| 1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |

(7)已知:c(Sc3+)≤1.0×10-5mol·L-1时表明完全沉淀,萃取剂混合液的pH为6时是否完全沉淀?
更新时间:2023-11-11 09:52:07
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
【推荐1】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质,采用如下工艺流程回收其中的镍制备硫酸镍晶体( )。
)。

溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是___________________________ ;为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀,写出该反应的离子方程式____________________ 。
(2)“滤液②”中含有的金属离子是______________________ 。
(3)“转化”中可替代 的物质是
的物质是___________ 。
(4)利用上述表格数据,计算 的
的
___________ (列出计算式);如果“转化”后的溶液中 浓度为1.0
浓度为1.0 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是___________ 。
(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________ 。
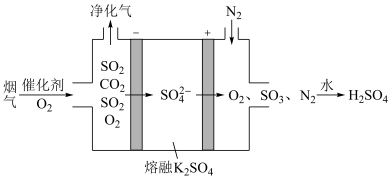
(6)硫酸镍可转化为NiOOH用作镍镉电池,镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行: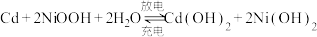 ,放电时NiOOH参与的电极反应式为
,放电时NiOOH参与的电极反应式为___________________ ;某种电化学脱硫法装置如图所示,不仅可脱除烟气中 ,还可以制得,请写出在阳极脱除
,还可以制得,请写出在阳极脱除 生成
生成 的电极反应式是
的电极反应式是________________ 。
 )。
)。
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 |
|
|
|
|
开始沉淀时( | 7.2 | 3.7 | 2.2 | 7.5 |
完全沉淀时( | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中NaOH的两个作用分别是
(2)“滤液②”中含有的金属离子是
(3)“转化”中可替代
 的物质是
的物质是(4)利用上述表格数据,计算
 的
的
 浓度为1.0
浓度为1.0 ,则“调pH”应控制的pH范围是
,则“调pH”应控制的pH范围是(5)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
(6)硫酸镍可转化为NiOOH用作镍镉电池,镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
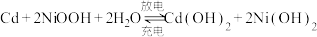 ,放电时NiOOH参与的电极反应式为
,放电时NiOOH参与的电极反应式为 ,还可以制得,请写出在阳极脱除
,还可以制得,请写出在阳极脱除 生成
生成 的电极反应式是
的电极反应式是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。氯化钪(ScCl3)是一种可溶于水的灰白色固体,是制备钪的重要原料。工业上利用固体废料“赤泥”(含有Fe2O3、SiO2、Sc2O3、TiO2等)制取ScCl3,请结合流程回答以下问题:

已知:①TiO2难溶于盐酸。
②Ksp[Sc(OH)3]=1.0×10-30,Ksp[Fe(OH)3]=1.0×10-38
(1)滤渣1的主要成分是_______ (填化学式)。
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是_______ 。
(3)常温下,“调pH”时,溶液中c(Sc3+)=0.001mol·L-1,为除去杂质离子,应控制的pH范围是_______ (当溶液中某离子浓度c≤1.0 10-5mol·L-1时,可认为该离子沉淀完全)。
10-5mol·L-1时,可认为该离子沉淀完全)。
(4)已知Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3+6H+,此反应的平衡常数K=_______ (用含a、b、c的代数式表示)。
(5)“加热氯化”过程中排出的气体主要有________ (填化学式)。
(6)传统制备ScCl3的方法是先得到ScCl3·6H2O沉淀,再高温脱水得ScCl3,但通常含有ScOCl杂质,原因是_______ 。
(7)草酸钪晶体[Sc2(C2O4)3·6H2O]在空气中加热, 随温度的变化情况如下图所示。250℃时,晶体的主要成分是
随温度的变化情况如下图所示。250℃时,晶体的主要成分是_______ (填化学式),550~850℃,反应的化学方程式为_______ 。(已知Sc2(C2O4)3·6H2O的摩尔质量为462g·mol-1)


已知:①TiO2难溶于盐酸。
②Ksp[Sc(OH)3]=1.0×10-30,Ksp[Fe(OH)3]=1.0×10-38
(1)滤渣1的主要成分是
(2)“酸浸”时温度过高,酸浸速率反而减慢,其原因是
(3)常温下,“调pH”时,溶液中c(Sc3+)=0.001mol·L-1,为除去杂质离子,应控制的pH范围是
 10-5mol·L-1时,可认为该离子沉淀完全)。
10-5mol·L-1时,可认为该离子沉淀完全)。(4)已知Ka1(H2C2O4)=a,Ka2(H2C2O4)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4=Sc2(C2O4)3+6H+,此反应的平衡常数K=
(5)“加热氯化”过程中排出的气体主要有
(6)传统制备ScCl3的方法是先得到ScCl3·6H2O沉淀,再高温脱水得ScCl3,但通常含有ScOCl杂质,原因是
(7)草酸钪晶体[Sc2(C2O4)3·6H2O]在空气中加热,
 随温度的变化情况如下图所示。250℃时,晶体的主要成分是
随温度的变化情况如下图所示。250℃时,晶体的主要成分是
您最近一年使用:0次
【推荐3】分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图:
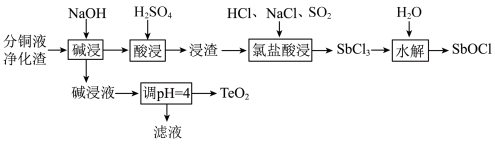
已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有Na2TeO3、Na3AsO4。
②“酸浸”时,锑元素发生反应生成难溶的Sb2O(SO4)4浸渣。
回答下列问题:
(1)As位于第四周期VA族,基态As的价层电子排布式为_______ 。
(2)“碱浸”时,TeO2与NaOH反应的离子方程式为_______ 。
(3)向碱浸液中加入盐酸调节pH=4,有TeO2析出,分离出TeO2的操作是_______ 。滤液中As元素最主要的存在形式为_______ 。(填标号)(25℃,H3AsO4的各级电离常数为Ka1=6.3×10-3,Ka2=1.0×10-7,Ka3=3.2×10-12)
A.H3AsO4 B.H2AsO C.HAsO
C.HAsO D.AsO
D.AsO
(4)①Sb2O(SO4)4中,Sb的化合价为_______ 。
②“氯盐酸浸”时,通入SO2的目的是_______ 。
(5)“水解”时,生成SbOCl的化学方程式为_______ 。
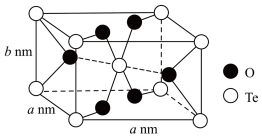
(6)TeO2可用作电子元件材料,熔点为733℃,TeO2晶胞是长方体结构如图。碲的配位数为_______ 。已知NA为阿伏加德罗常数的值,则该晶体的密度为_______ g/cm3。

已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有Na2TeO3、Na3AsO4。
②“酸浸”时,锑元素发生反应生成难溶的Sb2O(SO4)4浸渣。
回答下列问题:
(1)As位于第四周期VA族,基态As的价层电子排布式为
(2)“碱浸”时,TeO2与NaOH反应的离子方程式为
(3)向碱浸液中加入盐酸调节pH=4,有TeO2析出,分离出TeO2的操作是
A.H3AsO4 B.H2AsO
 C.HAsO
C.HAsO D.AsO
D.AsO
(4)①Sb2O(SO4)4中,Sb的化合价为
②“氯盐酸浸”时,通入SO2的目的是
(5)“水解”时,生成SbOCl的化学方程式为
(6)TeO2可用作电子元件材料,熔点为733℃,TeO2晶胞是长方体结构如图。碲的配位数为

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】环己烯是合成赖氨酸、环己酮、苯酚、聚环烯树脂、氯代环己烷、橡胶助剂、环己醇等的重要原料,也常用作催化剂、溶剂、石油萃取剂及高辛烷值汽油稳定剂。
制备环己烯的反应原理:
主反应: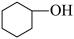
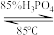
 +H2O
+H2O
副反应:2
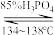
 +H2O
+H2O
制备环己烯的实验装置如图所示:

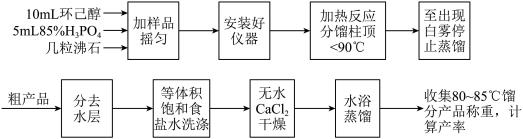
相关物理常数:
回答下列问题:
(1)上述装置图中,仪器B的名称是_______ ,从粗产品中分去水层及用饱和食盐水洗涤时,均需用到仪器D,下列操作与使用仪器D的操作无关的是_______ (填序号)。
a.润湿 b.振荡 c.检漏 d.放气
(2)实验中,不用浓硫酸而用浓磷酸脱水的理由是________ 。
(3)粗产物环己烯中加入食盐使水层饱和的目的是________ ;蒸馏提纯前在经食盐水洗所得产品中加入无水氯化钙的目的是_______ 。
(4)蒸馏提纯时用到水浴加热的方法,其优点是________ ,在水浴蒸馏前应将干燥剂除去,其原因是________ 。
(5)本实验最终得纯品2.75g,环己烯的产率为________ %(保留3位有效数字)。
制备环己烯的反应原理:
主反应:

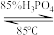
 +H2O
+H2O副反应:2

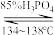
 +H2O
+H2O制备环己烯的实验装置如图所示:


相关物理常数:
| 物质 | 沸点 | 密度/(g•cm-3) | 水中溶解性 |
| 环己醇 | 161 | 0.9624 | 稍溶于水 |
| 环己烯 | 83.19 | 0.8098 | 不溶于水 |
| 85%磷酸 | — | 1.834 | 易溶于水 |
| 环己烯与水形成的共沸物(含水10%) | 70.8 | — | — |
| 环己醇与水形成的共沸物(含水80%) | 97.8 | — | — |
(1)上述装置图中,仪器B的名称是
a.润湿 b.振荡 c.检漏 d.放气
(2)实验中,不用浓硫酸而用浓磷酸脱水的理由是
(3)粗产物环己烯中加入食盐使水层饱和的目的是
(4)蒸馏提纯时用到水浴加热的方法,其优点是
(5)本实验最终得纯品2.75g,环己烯的产率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】食品级304不锈钢是一种重要的生产原材料,其中含铬18%。工业上将尖晶石类矿石(主要成分为 )综合利用,冶炼制造Cr和
)综合利用,冶炼制造Cr和 的流程如下(假设矿石中的杂质不参与反应):
的流程如下(假设矿石中的杂质不参与反应):________ 价。
②烧渣主要成分为一种含铁元素的红色粉末和 ,反应的化学方程式为
,反应的化学方程式为________ 。
③上述流程Ⅰ~Ⅵ中涉及金属元素发生还原反应的步骤共有________ 步。(填1~6数字)
④ 和
和 都是两性氢氧化物,请根据化学的类推思想写出
都是两性氢氧化物,请根据化学的类推思想写出 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:________ 。
(2)①流程Ⅵ会同时生成 、KCl等产品,则每生成
、KCl等产品,则每生成 ,理论上消耗KClO的质量为
,理论上消耗KClO的质量为________ g。(结果保留1位小数)
② 极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是
极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是________ 。
③若流程Ⅴ硝酸无剩余,流程Ⅵ的KClO调整为铁粉,则可在搅拌作用下生成磁性材料,工艺中 与加入铁粉的物质的量之比最好为
与加入铁粉的物质的量之比最好为________ 。
 )综合利用,冶炼制造Cr和
)综合利用,冶炼制造Cr和 的流程如下(假设矿石中的杂质不参与反应):
的流程如下(假设矿石中的杂质不参与反应):
②烧渣主要成分为一种含铁元素的红色粉末和
 ,反应的化学方程式为
,反应的化学方程式为③上述流程Ⅰ~Ⅵ中涉及金属元素发生还原反应的步骤共有
④
 和
和 都是两性氢氧化物,请根据化学的类推思想写出
都是两性氢氧化物,请根据化学的类推思想写出 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:(2)①流程Ⅵ会同时生成
 、KCl等产品,则每生成
、KCl等产品,则每生成 ,理论上消耗KClO的质量为
,理论上消耗KClO的质量为②
 极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是
极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是③若流程Ⅴ硝酸无剩余,流程Ⅵ的KClO调整为铁粉,则可在搅拌作用下生成磁性材料,工艺中
 与加入铁粉的物质的量之比最好为
与加入铁粉的物质的量之比最好为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】钪( )是一种稀有金属。从铝土矿生产
)是一种稀有金属。从铝土矿生产 的副产品“赤泥”(主要成分为
的副产品“赤泥”(主要成分为 、
、 、
、 、
、 )中回收钪,同时生产聚合硫酸铁铝具有极其重要的工业价值,一种生产工艺流程如图所示:
)中回收钪,同时生产聚合硫酸铁铝具有极其重要的工业价值,一种生产工艺流程如图所示:
已知:①钪离子可以在不同 下生成
下生成 。
。
②该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的 值如下表所示:
值如下表所示:
回答下列问题:
(1)“浸取”时,常将赤泥粉碎,并进行搅拌,其目的是___________ 。
(2)流程中经处理后可循环利用的物质是___________ (填“物质A”或“物质B”);物质C最好选用___________ (填“ 溶液”或“氨水”)。
溶液”或“氨水”)。
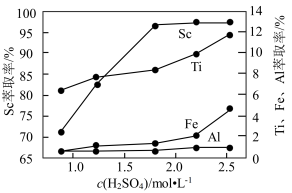
(3)Sc、Ti、Fe、Al的萃取率与浸出液的酸度关系如图所示,应选择的合适的 浓度为
浓度为______ mol∙L−1。
(4)“反萃取”时若加入过量的 溶液,
溶液,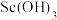 沉淀会溶解。写出
沉淀会溶解。写出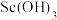 与过量
与过量 溶液反应生成n=4含钪产物的化学方程式:
溶液反应生成n=4含钪产物的化学方程式:___________ 。
(5)该工艺流程中引入“还原”与“氧化”这两个步骤的原因是___________ 。
(6)“聚合”生成聚合硫酸铁铝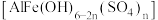 时,同时产生气体和沉淀,该步骤的离子方程式为
时,同时产生气体和沉淀,该步骤的离子方程式为___________ 。
 )是一种稀有金属。从铝土矿生产
)是一种稀有金属。从铝土矿生产 的副产品“赤泥”(主要成分为
的副产品“赤泥”(主要成分为 、
、 、
、 、
、 )中回收钪,同时生产聚合硫酸铁铝具有极其重要的工业价值,一种生产工艺流程如图所示:
)中回收钪,同时生产聚合硫酸铁铝具有极其重要的工业价值,一种生产工艺流程如图所示:
已知:①钪离子可以在不同
 下生成
下生成 。
。②该工艺条件下,溶液中相关离子开始沉淀和完全沉淀的
 值如下表所示:
值如下表所示:| 离子 |  |  |  |  |
开始沉淀的 | 7.0 | 1.9 | 3.0 | 0.3 |
完全沉淀的 | 9.0 | 3.2 | 4.7 | 2.0 |
(1)“浸取”时,常将赤泥粉碎,并进行搅拌,其目的是
(2)流程中经处理后可循环利用的物质是
 溶液”或“氨水”)。
溶液”或“氨水”)。(3)Sc、Ti、Fe、Al的萃取率与浸出液的酸度关系如图所示,应选择的合适的
 浓度为
浓度为
(4)“反萃取”时若加入过量的
 溶液,
溶液,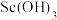 沉淀会溶解。写出
沉淀会溶解。写出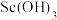 与过量
与过量 溶液反应生成n=4含钪产物的化学方程式:
溶液反应生成n=4含钪产物的化学方程式:(5)该工艺流程中引入“还原”与“氧化”这两个步骤的原因是
(6)“聚合”生成聚合硫酸铁铝
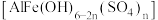 时,同时产生气体和沉淀,该步骤的离子方程式为
时,同时产生气体和沉淀,该步骤的离子方程式为
您最近一年使用:0次
【推荐1】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如图:

请回答下列问题:
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为__ 。
(2)溶液A中溶质除NaOH外,还有__ 。
(3)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有__ (任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是__ 。
③“钴渣”中LiCoO2溶解时的离子方程式为__ 。
(4)在“滤液1”中加入20﹪Na2CO3溶液,目的是__ ;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是__ 。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热。使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__ 。

请回答下列问题:
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为
(2)溶液A中溶质除NaOH外,还有
(3)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有
②工业生产中一般不用盐酸浸取“钴渣”,其原因是
③“钴渣”中LiCoO2溶解时的离子方程式为
(4)在“滤液1”中加入20﹪Na2CO3溶液,目的是
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热。使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________ 。
II.实验室模拟下图所示流程制备亚硝酸钠:
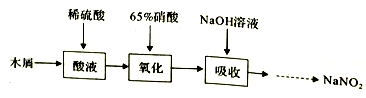
已知: ①氧化过程中,控制反应温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO ↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O
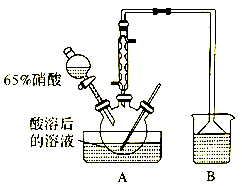
(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是______ ,氧化过程中反应温度不宜高于60℃,原因是______________ 。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________ 。
(3)装置B用于制备NaNO2,盛装的试剂除NaOH (aq) 外,还可以是______ (填字母)。
a.NaCl(aq) b.Na2CO3(aq) c.NaNO3(aq)
III.测定产品纯度:
【实验步骤】①准确称量ag产品配成200mL溶液;②从步骤①配制的溶液中移取20.00mL加入锥形瓶中;③用c mol/L酸性KMnO4溶液滴定至终点;④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为_____________ 。达到滴定终点的现象是_________ 。
(2)产品中NaNO2的纯度为__________ 。
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式
II.实验室模拟下图所示流程制备亚硝酸钠:

已知: ①氧化过程中,控制反应温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO ↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为
(3)装置B用于制备NaNO2,盛装的试剂除NaOH (aq) 外,还可以是
a.NaCl(aq) b.Na2CO3(aq) c.NaNO3(aq)
III.测定产品纯度:
【实验步骤】①准确称量ag产品配成200mL溶液;②从步骤①配制的溶液中移取20.00mL加入锥形瓶中;③用c mol/L酸性KMnO4溶液滴定至终点;④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为
(2)产品中NaNO2的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】实验室以绿矾(FeSO4●7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe],有关物质性质如下:
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
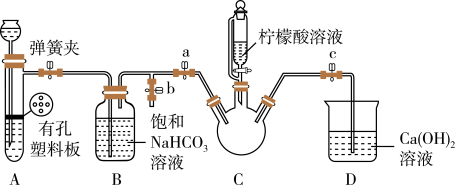
III.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器略去),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为________ (写化学式)。
(2)实验II中:生成沉淀的离子方程式为__________ 。
(3)实验III中:①C中盛柠檬酸溶液的仪器名称为__________ 。
②装置A中所盛放的试剂是________ (填字母)。
A.Na2CO3和稀H2SO4B.CaCO3和稀H2SO4C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是_________ 。
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是_________ 。
⑤洗涤实验II中得到的沉淀,所选用的最佳洗涤试剂是________ 。(填字母)
A.热水B.乙醇溶液C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为__________ %。
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
实验过程:
I.配制含0.10molFeSO4的绿矾溶液。
II.制备FeCO3:向配制好的绿矾溶液中,缓慢加入200mL1.1mol/LNH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀。
III.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器略去),将实验II得到的沉淀和含0.20mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。

回答下列问题:
(1)实验I中:实验室配制绿矾溶液时,为防止FeSO4被氧化变质,应加入的试剂为
(2)实验II中:生成沉淀的离子方程式为
(3)实验III中:①C中盛柠檬酸溶液的仪器名称为
②装置A中所盛放的试剂是
A.Na2CO3和稀H2SO4B.CaCO3和稀H2SO4C.CaCO3和稀盐酸
③确认C中空气排尽的实验现象是
④加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是
⑤洗涤实验II中得到的沉淀,所选用的最佳洗涤试剂是
A.热水B.乙醇溶液C.柠檬酸溶液
⑥若产品的质量为17.34g,则产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物和探究溴乙烷的性质。
(一)溴乙烷的制备及产物的检验:设计了下图装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:

(1)仪器A中除了加入上述物质外,还需加入___________ 。
(2)制备操作中,加入少量的水,其目的是___________ (填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等。
①检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是___________ 、___________ (填字母)。
a.苯 b.水 c.NaOH 溶液 d.硝酸银溶液
② 检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚。该同学的方案___________ (选填“正确”或“不正确”),理由是___________ 。
(4)欲除去溴乙烷中的少量杂质Br2,正确方法是___________ (填字母)。
a.KI溶液洗涤 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)溴乙烷性质的探究:某同学用右图装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质。

(5)在试管中加入10 mL 6mol•L-1 NaOH水溶液和5 mL 溴乙烷,水浴加热。当观察到___________ 现象时,表明溴乙烷与NaOH水溶液已完全反应。该反应的化学方程式为___________ 。
(6)在试管中加入10 mL饱和 NaOH乙醇溶液和5 mL 溴乙烷,水浴加热。为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,需要检验的是___________ ,检验的方法是___________ (用简要的文字说明)。
(一)溴乙烷的制备及产物的检验:设计了下图装置,其中夹持仪器、加热仪器及冷却水管没有画出。请根据实验步骤,回答下列问题:

(1)仪器A中除了加入上述物质外,还需加入
(2)制备操作中,加入少量的水,其目的是
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(3)上述反应的副产物还可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、溴化氢等。
①检验副产物中是否含有溴化氢:熄灭酒精灯,在竖直冷凝管上方塞上塞子、打开a,利用余热继续反应直至冷却,通过B、C装置检验。B、C中应盛放的试剂分别是
a.苯 b.水 c.NaOH 溶液 d.硝酸银溶液
② 检验副产物中是否含有乙醚:通过红外光谱仪鉴定所得产物中含有“-CH2CH3”基团,来确定副产物中存在乙醚。该同学的方案
(4)欲除去溴乙烷中的少量杂质Br2,正确方法是
a.KI溶液洗涤 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)溴乙烷性质的探究:某同学用右图装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质。

(5)在试管中加入10 mL 6mol•L-1 NaOH水溶液和5 mL 溴乙烷,水浴加热。当观察到
(6)在试管中加入10 mL饱和 NaOH乙醇溶液和5 mL 溴乙烷,水浴加热。为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,需要检验的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
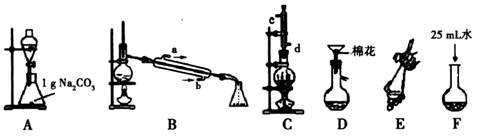
【推荐2】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。
有关数据如下表:
(1)在烧瓶中混合有机物及浓硫酸的方法是__________________________________ ,在实际实验中,甲醇、苯甲酸的物质的量之比远大于理论上物质的量之比,目的是_______________ 。装置C中除甲醇、苯甲酸与浓硫酸外还需要放置____________________________ 。
(2)B装置需加热的玻璃仪器的名称__________ ,C装置上部的冷凝管的主要作用是_____________________ 。冷却剂在冷凝管中的流动方向是__________ 。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号)________________ 。
(4)A中Na2CO3的作用是_____________________ ;D装置的作用是_______________ ;当B装置中温度计显示_____________ ℃时可收集苯甲酸甲酯。

有关数据如下表:
| 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(2)B装置需加热的玻璃仪器的名称
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号)
(4)A中Na2CO3的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】 俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
(1)亚硫酸钠法:
①需用除氧蒸馏水配制亚硫酸钠溶液。研细硫粉,用___________ 润湿后加入 溶液中,水浴加热后再经重结晶精制。
溶液中,水浴加热后再经重结晶精制。
②若未用除氧蒸馏水配制亚硫酸钠溶液,导致产品中存在的杂质为___________ ,证明含有该杂质的方法是___________ 。
(2)硫化钠法:选用以下必要的装置,利用 与
与 、
、 的混合溶液反应制备
的混合溶液反应制备 。
。___________ 。
②丁装置中 与
与 、
、 混合液反应生成
混合液反应生成 的化学方程式:
的化学方程式:___________ 。
③实验过程中,丁中的澄清溶液先变浑浊后变澄清,此时生成大量的 ,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入
,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入 ,用离子方程式解释立刻停止通入
,用离子方程式解释立刻停止通入 的原因:
的原因:___________ 。
④简述检验丁装置中导出气体中含有 的方法:
的方法:___________ 。
(3) 的用途:做冶金工业络合剂。
的用途:做冶金工业络合剂。
黄金(Au)浸取工艺:将金矿石浸泡在 、
、 的混合溶液中,并通入
的混合溶液中,并通入 。其中
。其中 作为催化剂参与反应,方程式为:
作为催化剂参与反应,方程式为: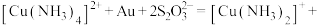
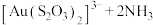 ,则浸金总反应的离子方程式为:
,则浸金总反应的离子方程式为:___________ 。
 俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:
俗称海波,水处理中常用作还原剂除氯、冶金中常用作络合剂,摄影中常用作定影剂。遇酸、受热都易分解。工业上常用以下两种方法制备:(1)亚硫酸钠法:
①需用除氧蒸馏水配制亚硫酸钠溶液。研细硫粉,用
 溶液中,水浴加热后再经重结晶精制。
溶液中,水浴加热后再经重结晶精制。②若未用除氧蒸馏水配制亚硫酸钠溶液,导致产品中存在的杂质为
(2)硫化钠法:选用以下必要的装置,利用
 与
与 、
、 的混合溶液反应制备
的混合溶液反应制备 。
。
②丁装置中
 与
与 、
、 混合液反应生成
混合液反应生成 的化学方程式:
的化学方程式:③实验过程中,丁中的澄清溶液先变浑浊后变澄清,此时生成大量的
 ,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入
,一段时间后,丁中再次出现少量浑浊,此时须立刻停止通入 ,用离子方程式解释立刻停止通入
,用离子方程式解释立刻停止通入 的原因:
的原因:④简述检验丁装置中导出气体中含有
 的方法:
的方法:(3)
 的用途:做冶金工业络合剂。
的用途:做冶金工业络合剂。黄金(Au)浸取工艺:将金矿石浸泡在
 、
、 的混合溶液中,并通入
的混合溶液中,并通入 。其中
。其中 作为催化剂参与反应,方程式为:
作为催化剂参与反应,方程式为: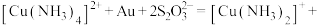
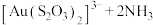 ,则浸金总反应的离子方程式为:
,则浸金总反应的离子方程式为:
您最近一年使用:0次

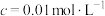 )的pH
)的pH )的pH
)的pH

