三甲基镓 是一种重要的半导体材料前驱体。实验室以镓镁合金
是一种重要的半导体材料前驱体。实验室以镓镁合金 、碘甲烷
、碘甲烷 为原料制备
为原料制备 ,实验步骤及装置如图:
,实验步骤及装置如图:
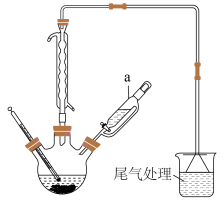
向三颈烧瓶中加入镓镁合金、碘甲烷和乙醚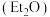 ,加热(55℃)并搅拌
,加热(55℃)并搅拌 。蒸出低沸点有机物后减压蒸馏,收集
。蒸出低沸点有机物后减压蒸馏,收集 。向
。向 中逐滴滴加
中逐滴滴加 (三正辛胺),室温下搅拌
(三正辛胺),室温下搅拌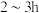 ,并用真空泵不断抽出
,并用真空泵不断抽出 蒸气,制得
蒸气,制得 。将
。将 置于真空中加热,蒸出
置于真空中加热,蒸出 。
。
已知:①常温下, 为无色透明的液体,易水解,在空气中易自燃。
为无色透明的液体,易水解,在空气中易自燃。
②相关物质的沸点信息如表:
回答下列问题:
(1)仪器a的名称是_______ ;制备 时,需在真空中加热的原因是
时,需在真空中加热的原因是_______ 。
(2)三颈烧瓶中除生成 外,还有
外,还有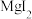 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为_______ 。
(3)用真空泵不断抽出 蒸气,有利于
蒸气,有利于 生成的理由是
生成的理由是_______ (用平衡移动原理解释);与直接分解 制备
制备 相比,采用“
相比,采用“ 配体交换”工艺制备的产品纯度更高的原因是
配体交换”工艺制备的产品纯度更高的原因是_______ 。
(4)测定 产品的纯度。取
产品的纯度。取 样品于锥形瓶中,加入
样品于锥形瓶中,加入 盐酸,至不再产生气泡,加入2滴甲基橙,用
盐酸,至不再产生气泡,加入2滴甲基橙,用 溶液滴定剩余盐酸,消耗
溶液滴定剩余盐酸,消耗 溶液的体积为
溶液的体积为 ,则
,则 的质量分数为
的质量分数为_______ (用含m、V、 、c、
、c、 的代数式表示);若滴定达终点时发现滴定管尖嘴内有气泡生成,则测定结果
的代数式表示);若滴定达终点时发现滴定管尖嘴内有气泡生成,则测定结果_______ (填“偏高”“偏低”或“无影响”)。
 是一种重要的半导体材料前驱体。实验室以镓镁合金
是一种重要的半导体材料前驱体。实验室以镓镁合金 、碘甲烷
、碘甲烷 为原料制备
为原料制备 ,实验步骤及装置如图:
,实验步骤及装置如图:
向三颈烧瓶中加入镓镁合金、碘甲烷和乙醚
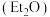 ,加热(55℃)并搅拌
,加热(55℃)并搅拌 。蒸出低沸点有机物后减压蒸馏,收集
。蒸出低沸点有机物后减压蒸馏,收集 。向
。向 中逐滴滴加
中逐滴滴加 (三正辛胺),室温下搅拌
(三正辛胺),室温下搅拌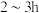 ,并用真空泵不断抽出
,并用真空泵不断抽出 蒸气,制得
蒸气,制得 。将
。将 置于真空中加热,蒸出
置于真空中加热,蒸出 。
。已知:①常温下,
 为无色透明的液体,易水解,在空气中易自燃。
为无色透明的液体,易水解,在空气中易自燃。②相关物质的沸点信息如表:
| 物质 |  |  |  |  |
| 沸点/℃ | 55.8 | 40.3 | 34.5 | 365.8 |
(1)仪器a的名称是
 时,需在真空中加热的原因是
时,需在真空中加热的原因是(2)三颈烧瓶中除生成
 外,还有
外,还有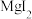 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为(3)用真空泵不断抽出
 蒸气,有利于
蒸气,有利于 生成的理由是
生成的理由是 制备
制备 相比,采用“
相比,采用“ 配体交换”工艺制备的产品纯度更高的原因是
配体交换”工艺制备的产品纯度更高的原因是(4)测定
 产品的纯度。取
产品的纯度。取 样品于锥形瓶中,加入
样品于锥形瓶中,加入 盐酸,至不再产生气泡,加入2滴甲基橙,用
盐酸,至不再产生气泡,加入2滴甲基橙,用 溶液滴定剩余盐酸,消耗
溶液滴定剩余盐酸,消耗 溶液的体积为
溶液的体积为 ,则
,则 的质量分数为
的质量分数为 、c、
、c、 的代数式表示);若滴定达终点时发现滴定管尖嘴内有气泡生成,则测定结果
的代数式表示);若滴定达终点时发现滴定管尖嘴内有气泡生成,则测定结果
更新时间:2023-12-05 08:56:59
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义,利用甲烷催化还原NOx消除氮氧化物的污染:
①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
③CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)ΔH3
N2(g)+CO2(g)+2H2O(g)ΔH3
(1)上述三个反应中ΔH3=___ ,第三个反应的平衡常数表达式为K3=___ 。
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
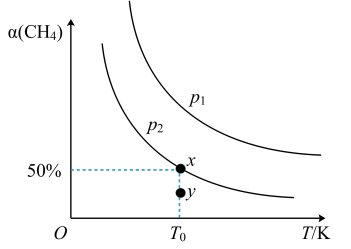
若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)___ v逆。
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=___ ;
②30min后只改变某一条件,根据上表数据判断改变的条件可能是__ (填序号)。
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
①CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1
4NO(g)+CO2(g)+2H2O(g)ΔH1=-574kJ·mol-1②CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)ΔH2=-1160kJ·mol-1③CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)ΔH3
N2(g)+CO2(g)+2H2O(g)ΔH3(1)上述三个反应中ΔH3=
(2)在2L恒容密闭容器中充入1molCH4和2molNO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。

若容器中的压强为p2,y点:v正(填“大于”“等于”或“小于”)
(3)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)
 N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:| 时间 浓度/mol•L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=
②30min后只改变某一条件,根据上表数据判断改变的条件可能是
A.加入一定量的活性炭 B.恒温恒压充入氩气
C.适当缩小容器的体积 D.加入合适的催化剂
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】工业废水中常含有一定量的Cr2O72-和CrO42-,它们对人类及生态系统产生很大损害,必须进行处理后方可排放。常用的处理方法有两种。
方法1:还原沉淀法。
该法的工艺流程为:
其中第①步存在平衡:2 CrO42-(黄色)+2H+ Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O
(1)若第①步中平衡体系的pH=2,则该溶液显_________ 色;向该溶液中加入Ba(NO3)2溶液(已知BaCrO4
为黄色沉淀)则平衡_________ 移动(填“向左”或“向右”或“不变”),溶液颜色将_________ 。
(2)能说明第①步反应达平衡状态的是_________ (选填编号)
A Cr2O72-和CrO42-的浓度相同 B 2υ(Cr2O72-)=υ(CrO42-) C 溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应_________ (选填编号)
A 平衡常数K值可以不改变 B 再达平衡前正反应速率一定大于逆反应速率
C Cr2O72-的浓度一定增大 D 平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要_________ mol的FeSO4•7H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至_________ 。
方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为________ 。
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)_________ ,溶液中同时生成的沉淀还有________ 。
方法1:还原沉淀法。
该法的工艺流程为:

其中第①步存在平衡:2 CrO42-(黄色)+2H+
 Cr2O72-(橙色)+ H2O
Cr2O72-(橙色)+ H2O(1)若第①步中平衡体系的pH=2,则该溶液显
为黄色沉淀)则平衡
(2)能说明第①步反应达平衡状态的是
A Cr2O72-和CrO42-的浓度相同 B 2υ(Cr2O72-)=υ(CrO42-) C 溶液的颜色不变
(3)若改变条件使平衡状态的第①步反应向正反应方向移动,则该反应
A 平衡常数K值可以不改变 B 再达平衡前正反应速率一定大于逆反应速率
C Cr2O72-的浓度一定增大 D 平衡移动时正反应速率一定先增大后减小
(4)第②步中,还原1 mol Cr2O72-离子,需要
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡: Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5 mol/L,溶液的pH应调至方法2:电解法。
该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)用Fe做电极的原因为
(7)在阴极附近溶液pH升高的原因是(用电极反应解释)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡_______ 移动(填“向左”、“向右”或“不”);使用催化剂反应的△H________ (填“增大”、“减小”或“不改变”)。
(2)已知:O2(g) = O2+(g)+e- H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1
O2PtF6(S)=O2+(g)+PtF6-(g) H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1
则反应O2(g)+PtF6(g) = O2+PtF6-(s)的 H=
H=_____________ kJ·mol-1。
(3)一定温度下在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0
①反应达到平衡后若再通入一定量氦气,则N2O5的转化率将_______ (填“增大”、“减小”、“不变”)。
②下表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为_________________ 。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L—1,则T2___ T1。
(1)合成氨反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡(2)已知:O2(g) = O2+(g)+e-
 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1PtF6(g)+e-=PtF6-(g)
 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1O2PtF6(S)=O2+(g)+PtF6-(g)
 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1则反应O2(g)+PtF6(g) = O2+PtF6-(s)的
 H=
H=(3)一定温度下在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0①反应达到平衡后若再通入一定量氦气,则N2O5的转化率将
②下表为反应在T1温度下的部分实验数据:
| 时间/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L—1,则T2
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】I.四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:

回答下列问题:
(1)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是______ (只要求写出一项)。
(2)若把③中制得的固体 用酸清洗除去其中的
用酸清洗除去其中的 杂质,还可制得钛白粉。已知25℃时,
杂质,还可制得钛白粉。已知25℃时, ,该温度下反应
,该温度下反应 的平衡常数K=
的平衡常数K=_______ 。
II.另一种生产TiCl4的方法是用天然TiO2晶体为原料,利用I中步骤④的反应原理获得TiCl4。产品中含有SiCl4、FeCl3等杂质。
(3)依据下表信息,要精制含少量SiCl4、FeCl3杂质的TiCl4粗产品,可采用______ 方法。
(4)某同学用滴定法测定粗产品中铁元素含量,其测定过程如图:

i滴定时应选择______ (填酸式或碱式)滴定管,若滴定终点读数时仰视刻线,则将使测量结果______ (填偏高、偏低或不变)。
ii若滴定过程中消耗c mol/LKMnO4溶液V mL,则样品中铁元素的质量分数是______ (用含a、C、V的代数式表示)

回答下列问题:
(1)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是
(2)若把③中制得的固体
 用酸清洗除去其中的
用酸清洗除去其中的 杂质,还可制得钛白粉。已知25℃时,
杂质,还可制得钛白粉。已知25℃时, ,该温度下反应
,该温度下反应 的平衡常数K=
的平衡常数K=II.另一种生产TiCl4的方法是用天然TiO2晶体为原料,利用I中步骤④的反应原理获得TiCl4。产品中含有SiCl4、FeCl3等杂质。
(3)依据下表信息,要精制含少量SiCl4、FeCl3杂质的TiCl4粗产品,可采用
| TiCl4 | SiCl4 | FeCl3 | |
| 熔点/℃ |  |  | 306 |
| 沸点/℃ | 136.4 | 57.6 | 315 |
(4)某同学用滴定法测定粗产品中铁元素含量,其测定过程如图:

i滴定时应选择
ii若滴定过程中消耗c mol/LKMnO4溶液V mL,则样品中铁元素的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】二氧化氯 (ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)某小组按照文献中制备 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是___________ 。
②装置B的作用是___________ 。
③A装置中,装 溶液的仪器名称为:
溶液的仪器名称为:___________ 。
(2)测定装置C中 溶液的浓度:取
溶液的浓度:取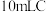 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化 (
酸化 (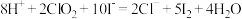 ),然后加入
),然后加入___________ 作指示剂,用 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液( ),当看到
),当看到___________ 现象时,测得标准液消耗的体积为 ,通过计算可知C中
,通过计算可知C中 溶液的浓度为
溶液的浓度为___________  。
。
(3)下列操作使测定结果偏低的是___________
(1)某小组按照文献中制备
 的方法设计了如图所示的实验装置用于制备
的方法设计了如图所示的实验装置用于制备 。
。
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是
②装置B的作用是
③A装置中,装
 溶液的仪器名称为:
溶液的仪器名称为:(2)测定装置C中
 溶液的浓度:取
溶液的浓度:取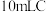 中溶液于锥形瓶中,加入足量的
中溶液于锥形瓶中,加入足量的 溶液和
溶液和 酸化 (
酸化 (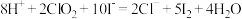 ),然后加入
),然后加入 的
的 标准液滴定锥形瓶中的溶液(
标准液滴定锥形瓶中的溶液( ),当看到
),当看到 ,通过计算可知C中
,通过计算可知C中 溶液的浓度为
溶液的浓度为 。
。(3)下列操作使测定结果偏低的是___________
| A.滴定前俯视,滴定终点仰视读数 |
B.盛放 标准溶液的滴定管未用标准液润洗 标准溶液的滴定管未用标准液润洗 |
| C.锥形瓶用蒸馏水洗净后未干燥直接装入待测液 |
| D.滴定前正常,滴定后滴定管尖嘴内有气泡 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某小组利用“氯气氧化法”制备溴酸钠( ),并测定产品纯度。
),并测定产品纯度。
Ⅰ、制备
________________________________________ 。
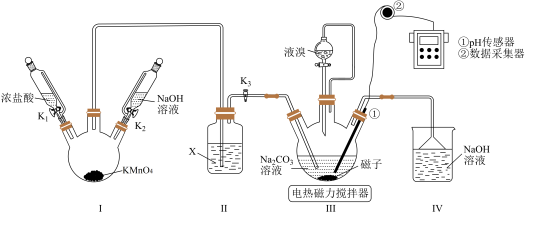
(2)向装置Ⅲ通 前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开
前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开 、
、 ,通入
,通入 至pH传感器显示接近中性,关闭
至pH传感器显示接近中性,关闭 、
、 。装置Ⅲ中发生反应的总化学方程式为
。装置Ⅲ中发生反应的总化学方程式为________________ 。反应结束后,为避免Ⅰ中残留的 污染空气,在拆卸装置前应进行的操作是
污染空气,在拆卸装置前应进行的操作是________________________ 。
Ⅱ、 的分离提纯
的分离提纯
(3)溴酸钠和氯化钠的溶解度曲线如图所示。将装置Ⅲ中所得混合液趁热过滤,将滤液________________ 、过滤、洗涤、干燥,得到 粗产品。
粗产品。 产品纯度
产品纯度
步骤1:取 粗产品溶于蒸馏水配制成
粗产品溶于蒸馏水配制成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硫酸和过量
溶液于锥形瓶中,加入适量稀硫酸和过量 溶液,再用
溶液,再用
 ,标准溶液滴定,平均消耗
,标准溶液滴定,平均消耗 标准溶液的体积为
标准溶液的体积为 。
。
(已知 、
、 ,杂质不反应)
,杂质不反应)
步骤2:另取 蒸馏水做空白实验,消耗
蒸馏水做空白实验,消耗
 标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化
标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化 带来的影响)
带来的影响)
(4)产品纯度为________________________ (用含m,c, ,
, 的代数式表示)。
的代数式表示)。
 ),并测定产品纯度。
),并测定产品纯度。Ⅰ、制备

(2)向装置Ⅲ通
 前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开
前,先打开电热磁力搅拌器,升温至50~60℃,滴入适量液溴,然后打开 、
、 ,通入
,通入 至pH传感器显示接近中性,关闭
至pH传感器显示接近中性,关闭 、
、 。装置Ⅲ中发生反应的总化学方程式为
。装置Ⅲ中发生反应的总化学方程式为 污染空气,在拆卸装置前应进行的操作是
污染空气,在拆卸装置前应进行的操作是Ⅱ、
 的分离提纯
的分离提纯(3)溴酸钠和氯化钠的溶解度曲线如图所示。将装置Ⅲ中所得混合液趁热过滤,将滤液
 粗产品。
粗产品。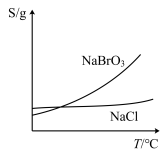
 产品纯度
产品纯度步骤1:取
 粗产品溶于蒸馏水配制成
粗产品溶于蒸馏水配制成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入适量稀硫酸和过量
溶液于锥形瓶中,加入适量稀硫酸和过量 溶液,再用
溶液,再用
 ,标准溶液滴定,平均消耗
,标准溶液滴定,平均消耗 标准溶液的体积为
标准溶液的体积为 。
。(已知
 、
、 ,杂质不反应)
,杂质不反应)步骤2:另取
 蒸馏水做空白实验,消耗
蒸馏水做空白实验,消耗
 标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化
标准溶液。(空白实验的目的是减小滴定过程中空气及溶解氧氧化 带来的影响)
带来的影响)(4)产品纯度为
 ,
, 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+ N2H4·H2O +NaCl
实验一:制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_________(填标号)。
(2)锥形瓶中发生反应的离子方程式是______________________ 。
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10 mol·L-1盐酸、酚酞试液):_______ 。
实验二:制取水合肼。(实验装置如右图所示)

(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。分液漏斗中的溶液是______ (填标号)。
(5)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
①滴定时,碘的标准溶液盛放在________ (填“酸式”或“碱式”)滴定管中;本实验滴定终点的现象为__________ 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为______________ 。
实验一:制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有_________(填标号)。
| A.容量瓶 | B.烧杯 | C.烧瓶 | D.玻璃棒 |
(3)设计实验方案:用中和滴定原理测定反应后锥形瓶中剩余NaOH的浓度(实验提供的试剂:H2O2溶液、FeCl2溶液、0.10 mol·L-1盐酸、酚酞试液):
实验二:制取水合肼。(实验装置如右图所示)

(4)控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。分液漏斗中的溶液是
| A.CO (NH2) 2溶液 | B.NaOH和NaClO混合溶液 |
①滴定时,碘的标准溶液盛放在
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
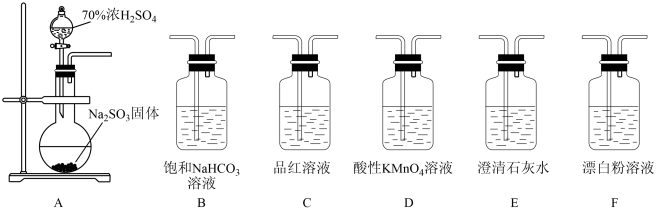
(1)装置A中反应的化学方程式为_______ 。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_______ →_______ →C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。通过_______ 现象即可证明亚硫酸酸性强于碳酸。
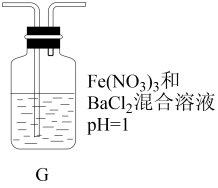
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_______ 。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0gNa2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20mol·L-1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。样品中Na2SO3质量分数是_______ 。

(1)装置A中反应的化学方程式为
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。通过
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为

(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0gNa2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20mol·L-1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。样品中Na2SO3质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.某学生用已知物质的量浓度的NaOH标准溶液来测定未知物质的量浓度的盐酸时,选择甲基橙作指示剂。请回答下列问题:
(1)配制480mL0.1000mol•L-1NaOH标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、_____ 、_____ 等。
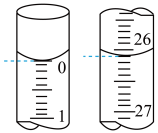
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为____ mL。
(3)下列有关本实验滴定说法不正确的是_____ 。

A.用酸式滴定管量取25.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴甲基橙试液后进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液
E.碱式滴定管尖嘴部分有气泡,滴定后消失会造成测定结果偏高
F.根据突变范围指示剂最好选择甲基橙误差最小
(4)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算,该盐酸溶液的物质的量浓度为_____ 。
II.氧化还原滴定实验与酸碱中和滴定类似。某学习小组用“间接硝量法”测定含有CuCl2•2H2O晶体试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应2Cu2++4I-=2CuI↓+I2。用0.1000mol/LNa2S2O3标准溶液滴定,I2+2S2O =S4O
=S4O +2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
+2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
(5)可选用_____ 作滴定指示剂,滴定终点的现象是_____ 。
(6)该试样中CuCl2•2H2O(M=171g/mol)的质量百分数为_____ 。
(1)配制480mL0.1000mol•L-1NaOH标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)若滴定开始和结束时,碱式滴定管中的液面如图所示,所用NaOH标准溶液的体积为

(3)下列有关本实验滴定说法不正确的是

A.用酸式滴定管量取25.00mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴甲基橙试液后进行滴定
B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.采用如图所示操作中的丙,然后轻轻挤压玻璃球使尖嘴部分充满碱液
E.碱式滴定管尖嘴部分有气泡,滴定后消失会造成测定结果偏高
F.根据突变范围指示剂最好选择甲基橙误差最小
(4)某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 29.61 |
| 第三次 | 25.00 | 0.22 | 26.31 |
II.氧化还原滴定实验与酸碱中和滴定类似。某学习小组用“间接硝量法”测定含有CuCl2•2H2O晶体试样(不含能与I-发生反应的氧化性质杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应2Cu2++4I-=2CuI↓+I2。用0.1000mol/LNa2S2O3标准溶液滴定,I2+2S2O
 =S4O
=S4O +2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
+2I-,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。(5)可选用
(6)该试样中CuCl2•2H2O(M=171g/mol)的质量百分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如图:

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl 形式存在,写出相应反应的离子方程式
形式存在,写出相应反应的离子方程式__ 。
(2)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
分析40℃时TiO2·xH2O转化率最高的原因__ 。
(3)Li2Ti5O15中Ti的化合价为+4,则1molLi2Ti5O15中含过氧根离子的数目为__ 。
(4)若“滤液②”中c(Mg2+)=0.02mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成___ ?已知:FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式___ 。

回答下列问题:
(1)“酸浸”后,钛主要以TiOCl
 形式存在,写出相应反应的离子方程式
形式存在,写出相应反应的离子方程式(2)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因
(3)Li2Ti5O15中Ti的化合价为+4,则1molLi2Ti5O15中含过氧根离子的数目为
(4)若“滤液②”中c(Mg2+)=0.02mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5mol·L-1,此时是否有Mg3(PO4)2沉淀生成
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】氮的化合物对人类生产、生活有着重要的作用。
I.NCl3是一种黄色油状液体,可用于漂白和杀菌。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用Cl2和NH4Cl溶液反应制取NCl3,所用仪器如图甲所示(忽略部分夹持装置):
(1)NCl3分子的空间结构为___________ 。
(2)图A和图G中盛装浓盐酸的仪器名称为___________ ;若药品X为氯酸钾;则A中反应的离子方程式为___________ ;根据气流方向,各仪器的连接顺序为___________ (用各接口字母表示,各接口所需橡胶塞已省略)。
(3)N2H4的制备实验中,装置存在一处缺陷会使N2H4产率降低,请提出改进方法___________ 。
(4)探究N2H4的性质:取装置F中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到无色晶体。经分析知该晶体为N2H6SO4和(N2H5)2SO4,可推出N2H4·H2O呈___________ (填“酸性”或“碱性”),其主要电离方程式为___________ 。
(5)测定NCl3(摩尔质量为120.5g·mol-1)的纯度:已知NCl3的制取是可逆反应,根据反应NCl3+4HCl=NH4Cl+3Cl2↑,利用间接碘量法测定氯气的量即可测定NCl3的纯度。
实验步骤:
ⅰ.准确称量C中的产物1.00g置于三颈烧瓶中,加入足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入300mL0.10mol/LKI溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取30.00mL吸收液,加入淀粉指示剂,用0.15mol/LNa2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液20.00mL。(已知:反应原理为I2+2Na2S2O3=Na2S4O6+2NaI)则NCl3的纯度为___________ 。(保留三位有效数字)
I.NCl3是一种黄色油状液体,可用于漂白和杀菌。已知:NCl3熔点为-40℃,沸点为70℃,95℃以上易爆炸,遇碱则迅速反应。在实验室可用Cl2和NH4Cl溶液反应制取NCl3,所用仪器如图甲所示(忽略部分夹持装置):
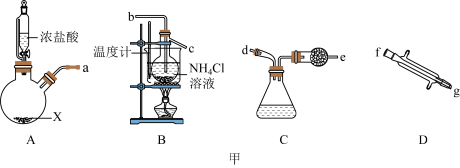
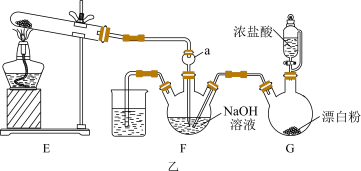
(1)NCl3分子的空间结构为
(2)图A和图G中盛装浓盐酸的仪器名称为
(3)N2H4的制备实验中,装置存在一处缺陷会使N2H4产率降低,请提出改进方法
(4)探究N2H4的性质:取装置F中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到无色晶体。经分析知该晶体为N2H6SO4和(N2H5)2SO4,可推出N2H4·H2O呈
(5)测定NCl3(摩尔质量为120.5g·mol-1)的纯度:已知NCl3的制取是可逆反应,根据反应NCl3+4HCl=NH4Cl+3Cl2↑,利用间接碘量法测定氯气的量即可测定NCl3的纯度。
实验步骤:
ⅰ.准确称量C中的产物1.00g置于三颈烧瓶中,加入足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ.将混合气通入300mL0.10mol/LKI溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气(溶液体积变化忽略不计);
ⅲ.量取30.00mL吸收液,加入淀粉指示剂,用0.15mol/LNa2S2O3标准液进行滴定,滴定至终点时消耗Na2S2O3溶液20.00mL。(已知:反应原理为I2+2Na2S2O3=Na2S4O6+2NaI)则NCl3的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫化氢(H2S)是一种具有臭鸡蛋气味的无色气体,有剧毒。某化学兴趣小组设计了制取H2S气体并验证其性质的实验。实验装置如下图所示。
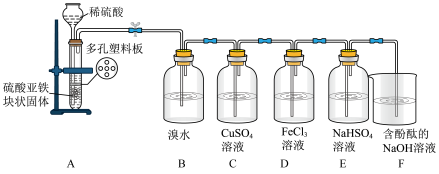
已知:①H2S在水中的溶解度为1:2(体积比),其水溶液称为氢硫酸;
②H2S可与许多金属离子反应生成沉淀;
③H2S有极强的还原性。
请回答下列问题:
(1)装置A为制备H2S气体的发生装置,该装置还可以制取的气体有___________ (任填一种)。装置A中的稀硫酸若换为稀硝酸,是否可行?其理由是_______________________________________________ 。
(2)装置B中溴水橙色褪去,证明溴的非金属性比硫_______________ (填“强”或“弱”)。
(3)装置C中有黑色沉淀(CuS)生成,装置D中有淡黄色沉淀生成,说明Fe3+的氧化性比Cu2+强,请设计实验证明这一结论:____________________________________________________________________ 。
(4)装置E中生成淡黄色沉淀,该反应的离子方程式为_____________ 。
(5)装置F中的现象为_____________________ ,该反应的离子方程式为_________ 。

已知:①H2S在水中的溶解度为1:2(体积比),其水溶液称为氢硫酸;
②H2S可与许多金属离子反应生成沉淀;
③H2S有极强的还原性。
请回答下列问题:
(1)装置A为制备H2S气体的发生装置,该装置还可以制取的气体有
(2)装置B中溴水橙色褪去,证明溴的非金属性比硫
(3)装置C中有黑色沉淀(CuS)生成,装置D中有淡黄色沉淀生成,说明Fe3+的氧化性比Cu2+强,请设计实验证明这一结论:
(4)装置E中生成淡黄色沉淀,该反应的离子方程式为
(5)装置F中的现象为
您最近一年使用:0次



