下列有关 沉淀溶解平衡的说法中错误的是
沉淀溶解平衡的说法中错误的是
 沉淀溶解平衡的说法中错误的是
沉淀溶解平衡的说法中错误的是A. 的溶度积常数与温度有关 的溶度积常数与温度有关 |
B. 难溶于水,溶液中没有 难溶于水,溶液中没有 和 和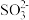 |
C.升高温度, 的溶解度增大 的溶解度增大 |
D.向 悬浊液中加入 悬浊液中加入 固体, 固体, 溶解的量减少 溶解的量减少 |
更新时间:2023-12-21 21:45:48
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知:常温下,HCOOH的酸性强于CH3COOH。现将 pH=3,体积均为V0的两种酸溶液分别加水稀释至体积 V,pH 随lg 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是

 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
| A.溶液中水的电离程度:a>b>c>d |
| B.a 点的两种酸溶液分别与 NaOH 恰好完全中和后,溶液中n(Na+)相同 |
| C.曲线I表示CH3COOH溶液的变化曲线 |
| D.同温下 pH 相同的 NaOH 溶液、CH3COONa 溶液、HCOONa 溶液、NaHCO3溶液的浓度:c(NaOH)<c(NaHCO3)<c(CH3COONa)<c(HCOONa) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法正确的是。
| A.水的离子积常数KW只与温度有关,但外加酸、碱、盐一定会影响水的电离程度 |
| B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关 |
| C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小 |
| D.室温下,CH3COOH的Ka=1.75×10-5,NH3·H2O的Kb=1.8×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)大约相等 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】下列关于弱电解质的电离平衡中,说法错误的是
A.将0.1 mol·L-1的CH3COOH溶液加水稀释, 变大 变大 |
| B.向1L 0.1mol·L-1的CH3COOH溶液滴加NaOH溶液的过程中,n(CH3COOH)与n(CH3COO-)之和始终为0.1 mol |
| C.向0.1 mol·L-1的氨水中通氨气,NH3•H2O的电离程度增大 |
D.在CuCl2溶液中存在如下平衡:[Cu(H2O)4]2+蓝色+4Cl- [CuCl4]2-黄色+4H2O ΔH>0,向黄绿色的CuCl2溶液中加水,溶液变蓝 [CuCl4]2-黄色+4H2O ΔH>0,向黄绿色的CuCl2溶液中加水,溶液变蓝 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验海带中的碘元素 | 将海带灰溶解并过滤,取少量滤液,酸化后加入过量的H2O2或新制氯水,振荡,再加入1-2滴淀粉溶液 | 若溶液变蓝,则海带中含有碘元素 |
| B | 检验NaNO2溶液的还原性 | 取一定量的NaNO2溶液于试管中,再加入少量稀H2SO4酸化的K2Cr2O7溶液 | 若溶液由橙色变为绿色,证明NaNO2具有还原性 |
| C | 探究不同沉淀之间的转化 | 往5mL0.1mol•L-1的AgNO3溶液中加入2mL0.1mol•L-1的NaCl溶液,再加入2mL0.1mol•L-1的NaI溶液 | 若产生的白色沉淀转变为黄色,则说明AgCl可转变为AgI |
| D | 检验某有机物是否含醛基 | 向其中先加入1mL0.1mol•L-1NaOH溶液,再加入2mL0.1mol•L-1的CuSO4溶液,混合加热 | 若有砖红色沉淀产生,则含有醛基 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列操作或装置不能达到实验目的的是


| A.图甲证明Ksp(AgBr)>Ksp(AgI) |
| B.图乙分离SiO2和NH4Cl |
| C.图丙进行中和热测定 |
| D.图丁制备Fe2(SO4)3晶体 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】化学与生产、生活密切相关,下列说法正确的是
| A.鸡蛋清溶液、淀粉溶液、葡萄糖溶液均为胶体 |
| B.使用含钙离子浓度较大的地下水洗衣服,肥皂的去污能力减弱 |
| C.浓硫酸具有强腐蚀性,可用浓硫酸蚀刻玻璃 |
| D.添加过量难溶MnS可除去MnCl2溶液中混有的Cu2+,说明在相同的条件下MnS的溶度积小于CuS的溶度积 |
您最近一年使用:0次
【推荐2】常温下,某研究小组用数字传感器探究 的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示
的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示 溶于
溶于 溶液形成的悬浊液。下列说法正确的是
溶液形成的悬浊液。下列说法正确的是
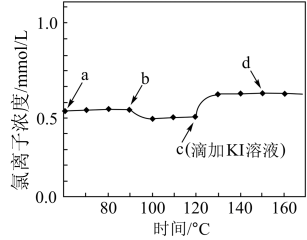
 的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示
的沉淀溶解平衡。实验测得悬浊液中氯离子浓度变化如图所示,其中a点表示 溶于
溶于 溶液形成的悬浊液。下列说法正确的是
溶液形成的悬浊液。下列说法正确的是
A.图中b点可能是滴加 溶液 溶液 | B.图中c点后无黄色沉淀生成 |
C.图中d点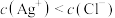 | D.由图可知: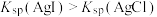 |
您最近一年使用:0次

 试纸测得
试纸测得 溶液的
溶液的 溶液的
溶液的 电离出
电离出 的能力比
的能力比 的强
的强 气体通入浓度均为
气体通入浓度均为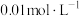 的
的 和
和 溶液中,只出现
溶液中,只出现 黑色沉淀
黑色沉淀
 受热分解产生的气体通入
受热分解产生的气体通入 溶液,产生白色沉淀
溶液,产生白色沉淀


