丙烯是三大合成材料的基本原料之一,其中生产聚丙烯时丙烯用量最大。另外,丙烯还可用于生产多种重要有机化工原料。由丙烷( )制丙烯(
)制丙烯( )的两种方法如下:
)的两种方法如下:
Ⅰ.丙烷催化脱氢法:

Ⅱ.丙烷催化氧化法:
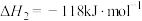
请回答下列问题:
(1)已知
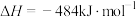 ,由此计算
,由此计算
____  。
。
(2) 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。
,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。
①下列能说明该反应达到平衡状态的是_____ (填标号)。
a.丙烷的消耗速率等于丙烯的生成速率 b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化 d.容器内气体平均相对分子质量不再变化
② 内,用
内,用 表示该反应的反应速率为
表示该反应的反应速率为______ mol·L-1·min-1。
③ 的平衡转化率为
的平衡转化率为______ ,该反应的平衡常数
____  (
( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压×物质的量分数,保留2位小数)。
总压×物质的量分数,保留2位小数)。
 )制丙烯(
)制丙烯( )的两种方法如下:
)的两种方法如下:Ⅰ.丙烷催化脱氢法:


Ⅱ.丙烷催化氧化法:

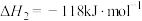
请回答下列问题:
(1)已知

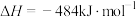 ,由此计算
,由此计算
 。
。(2)
 下,向
下,向 恒容密闭容器中充入
恒容密闭容器中充入 ,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。
,加入催化剂发生催化脱氢反应。体系内压强变化如表所示。| 时间/min | 0 | 1 | 3 | 5 | 7 |
| 压强 /kPa |  |  |  |  |  |
a.丙烷的消耗速率等于丙烯的生成速率 b.容器内气体的密度不再发生变化
c.容器内的压强不再发生变化 d.容器内气体平均相对分子质量不再变化
②
 内,用
内,用 表示该反应的反应速率为
表示该反应的反应速率为③
 的平衡转化率为
的平衡转化率为
 (
( 为以分压表示的平衡常数,分压
为以分压表示的平衡常数,分压 总压×物质的量分数,保留2位小数)。
总压×物质的量分数,保留2位小数)。
更新时间:2024-01-26 18:50:21
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】对 的资源化利用是人类常期研究的课题。
的资源化利用是人类常期研究的课题。
(1)1902年, 首次报道了
首次报道了 的甲烷化。
的甲烷化。
①已知:I.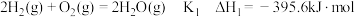
Ⅱ.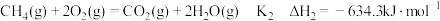
 甲烷化反应Ⅲ.
甲烷化反应Ⅲ.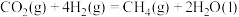 的
的
___________  ,平衡常数
,平衡常数
___________ (用 表示)。
表示)。
② 加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为
加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为___________ 。
A.反应速率快 B.平衡转化率高 C.催化剂活性高 D.主反应催化剂选择性好
(2) 负载金属
负载金属 催化
催化 甲烷化可能存在的两种反应机理如图所示。
甲烷化可能存在的两种反应机理如图所示。
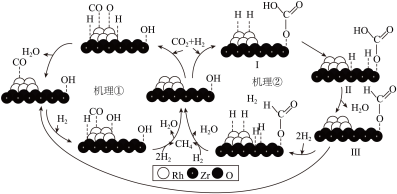
①上述两种不同机理发生机制的关键为: 和
和 在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则
在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则 吸附在
吸附在___________ 上。
②机理①和②都会产生中间体 。其产生的原因可能是
。其产生的原因可能是___________ 或吸附在载体 的
的 原子表面的(
原子表面的( 衍生物中间体)甲酸盐解离产生。
衍生物中间体)甲酸盐解离产生。
③中间体Ⅱ转化为中间体Ⅲ的过程可用反应式表示为___________ 。
(3)利用介孔限域催化温室气体加氢制甲醇,是解决能源问题与实现双碳目标的主要技术之一,主反应如下: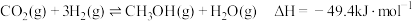 。
。
①此反应在___________ (填“高温”、“低温”或“任何温度”)下能自发进行。
②我国学者研究发现,在单原子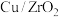 催化时,该反应的历程为:
催化时,该反应的历程为:
第一步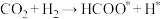
第二步
第三步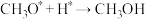
中间体 与
与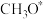 物质的量之比随时间变化如下图:
物质的量之比随时间变化如下图:
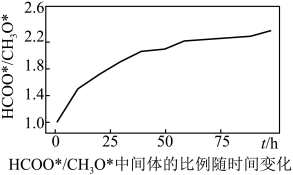
回答下列问题:
i.基态铜原子价层电子轨道表达式:___________ 。
ii.反应历程中,第___________ 步反应的活化能最高,是反应的决速步聚,判断的理由是___________ 。
 的资源化利用是人类常期研究的课题。
的资源化利用是人类常期研究的课题。(1)1902年,
 首次报道了
首次报道了 的甲烷化。
的甲烷化。①已知:I.
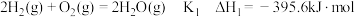
Ⅱ.
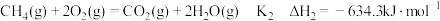
 甲烷化反应Ⅲ.
甲烷化反应Ⅲ.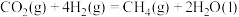 的
的
 ,平衡常数
,平衡常数
 表示)。
表示)。②
 加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为
加氢合成甲烷时,通常控制温度为500℃左右,其原因不可能为A.反应速率快 B.平衡转化率高 C.催化剂活性高 D.主反应催化剂选择性好
(2)
 负载金属
负载金属 催化
催化 甲烷化可能存在的两种反应机理如图所示。
甲烷化可能存在的两种反应机理如图所示。
①上述两种不同机理发生机制的关键为:
 和
和 在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则
在催化剂表面不同活性位点吸附、活化形成中间体。若发生机理①,则 吸附在
吸附在②机理①和②都会产生中间体
 。其产生的原因可能是
。其产生的原因可能是 的
的 原子表面的(
原子表面的( 衍生物中间体)甲酸盐解离产生。
衍生物中间体)甲酸盐解离产生。③中间体Ⅱ转化为中间体Ⅲ的过程可用反应式表示为
(3)利用介孔限域催化温室气体加氢制甲醇,是解决能源问题与实现双碳目标的主要技术之一,主反应如下:
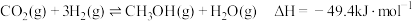 。
。①此反应在
②我国学者研究发现,在单原子
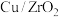 催化时,该反应的历程为:
催化时,该反应的历程为:第一步
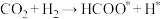
第二步

第三步
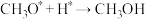
中间体
 与
与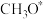 物质的量之比随时间变化如下图:
物质的量之比随时间变化如下图:
回答下列问题:
i.基态铜原子价层电子轨道表达式:
ii.反应历程中,第
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】《巴黎协定》所倡导的是全球绿色、低碳。如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图14 甲所示,总反应的化学方程式为_________________________________ 。
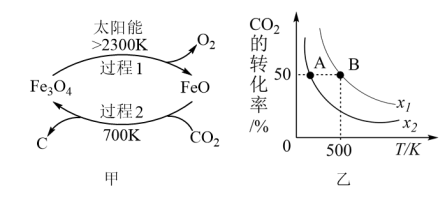
(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH。
向1L恒容密闭容器中充入2mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温
度、投料比[x=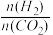 ]的关系如图乙所示。
]的关系如图乙所示。
①该反应的ΔH__________ 0(填“>”、“<”或“=”)。
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是____________ (写1条即可)。
③图中X1_________ X2(填“<”“>”.或“=”,下同)。
④若图乙中B点的投料比为2,则500℃时的平衡常数K(B)=_________________ 。
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-akJ•mol-1
CH3OH(g)+H2O(l) △H=-akJ•mol-1
2H2(g)+O2(g)=2H2O(l) △H=-bkJ•mol-1
CH3OH(g)=CH3OH(l) △H=-ckJ•mol-1
①CH3OH(l)燃烧热的热化学方程式为________________________________ 。
②合成二甲醚的总反应为2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H=-130.8kJ•mol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是
CH3OCH3(g)+3H2O(g) △H=-130.8kJ•mol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____________ (填序号)。
a.逆反应速率先增大后减小 b.H2的转化率增大 c.反应物的体积百分含量减小
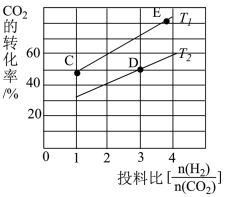
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12mol H2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____________ ;KC、KD、KE三者之间的大小关系为___________________ 。
(1)科学家提出由CO2制取C的太阳能工艺如图14 甲所示,总反应的化学方程式为

(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH。
向1L恒容密闭容器中充入2mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温
度、投料比[x=
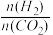 ]的关系如图乙所示。
]的关系如图乙所示。①该反应的ΔH
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
③图中X1
④若图乙中B点的投料比为2,则500℃时的平衡常数K(B)=
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
CO2(g)+3H2(g)
 CH3OH(g)+H2O(l) △H=-akJ•mol-1
CH3OH(g)+H2O(l) △H=-akJ•mol-12H2(g)+O2(g)=2H2O(l) △H=-bkJ•mol-1
CH3OH(g)=CH3OH(l) △H=-ckJ•mol-1
①CH3OH(l)燃烧热的热化学方程式为
②合成二甲醚的总反应为2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H=-130.8kJ•mol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是
CH3OCH3(g)+3H2O(g) △H=-130.8kJ•mol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是a.逆反应速率先增大后减小 b.H2的转化率增大 c.反应物的体积百分含量减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12mol H2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=

您最近一年使用:0次
【推荐3】I.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1

将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据c(8,2)表示:在8 min时H2的物质的量是2 mol。
(1)c点正反应速率_____ (填“大于”“等于”或“小于”)逆反应速率。其化学平衡常数K=__________
(2)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是________________
(3)若体积不变再充入3molCO2和4 mol H2,则H2O(g)的体积分数__ (填“增大”“不变”或“减小”)
Ⅱ.某实验小组欲探究I- 被空气中O2氧化的反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、___________________ ;反应的离子方程式为_____________________
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)

(1)电解结束后,阳极附近产生的沉淀物的主要成分为____ (填化学式)。
(2)若按上图所示连接对铅蓄电池进行充电。
总反应:Pb +PbO2+2H2SO4 =2PbSO4 +2H2O,充电一段时间后,B电极上的电极反应式为____________________________ 。充电完毕,铅蓄电池的正极是_______ 极(填“A”或“B”)。
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而18g水蒸气转化成液态水放热44 kJ,则表示CH4燃烧热的热化学方程式为______________________________ 。
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H= -49.0 kJ·mol-1
将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据c(8,2)表示:在8 min时H2的物质的量是2 mol。
(1)c点正反应速率
(2)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示。曲线I对应的实验条件改变是
(3)若体积不变再充入3molCO2和4 mol H2,则H2O(g)的体积分数
Ⅱ.某实验小组欲探究I- 被空气中O2氧化的反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、
Ⅲ. 粗镍样品中含Fe、Zn、Ag、Cu等四种金属杂质,为获得高纯度的镍,某兴趣小组同学拟用铅蓄电池为电源,粗镍及石墨为电极,电解硝酸镍溶液对粗镍进行提纯。(已知,氧化性:Fe2+<Ni2+<Cu2+)

(1)电解结束后,阳极附近产生的沉淀物的主要成分为
(2)若按上图所示连接对铅蓄电池进行充电。
总反应:Pb +PbO2+2H2SO4 =2PbSO4 +2H2O,充电一段时间后,B电极上的电极反应式为
(3)如用甲烷燃料电池为电源,在25℃、101 kPa时,若CH4在氧气中直接燃烧生成1 mol水蒸气放热401 kJ,而18g水蒸气转化成液态水放热44 kJ,则表示CH4燃烧热的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】 资源化利用是实现
资源化利用是实现 减排的首要途径。已知
减排的首要途径。已知 加氢制甲醇反应体系中,主要反应有
加氢制甲醇反应体系中,主要反应有
Ⅰ.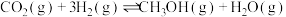


Ⅱ.


Ⅲ.

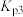
回答下列问题:
(1)
_______ 。
(2)在一定温度范围和压强范围内,只发生反应Ⅰ和Ⅱ,为了增大甲醇产率,理论上可采取的措施是_______ (写2点);
(3)已知反应Ⅰ和Ⅱ的 ,随温度的变化如图所示:
,随温度的变化如图所示:
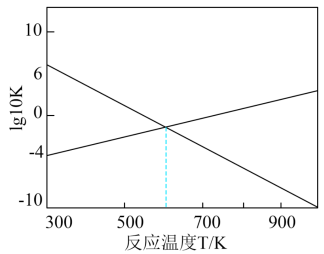
①300K时, 、
、 、
、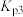 由大到小的顺序为
由大到小的顺序为_______ 。
②在600K、3MPa下,向密闭容器中充入2mol 和1mol
和1mol ,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程
,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程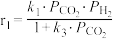 ,CO的生成速率方程
,CO的生成速率方程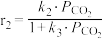 ,
, 、
、 为速率方程常数、
为速率方程常数、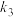 为常数。体系达到平衡时,
为常数。体系达到平衡时,
_______ , 的平衡转化率为
的平衡转化率为_______ 。
(4) 电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
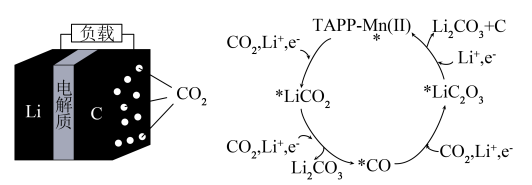
①该正极反应历程中有_______ 种中间产物;
②放电时,该电池的正极反应式为_______ 。
 资源化利用是实现
资源化利用是实现 减排的首要途径。已知
减排的首要途径。已知 加氢制甲醇反应体系中,主要反应有
加氢制甲醇反应体系中,主要反应有Ⅰ.
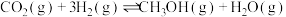


Ⅱ.



Ⅲ.


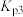
回答下列问题:
(1)

(2)在一定温度范围和压强范围内,只发生反应Ⅰ和Ⅱ,为了增大甲醇产率,理论上可采取的措施是
(3)已知反应Ⅰ和Ⅱ的
 ,随温度的变化如图所示:
,随温度的变化如图所示:
①300K时,
 、
、 、
、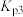 由大到小的顺序为
由大到小的顺序为②在600K、3MPa下,向密闭容器中充入2mol
 和1mol
和1mol ,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程
,只发生反应Ⅰ和Ⅱ,开始时甲醇与CO的生成速率之比为6∶1,达到平衡时,生成速率之比为3∶1,甲醇的生成速率方程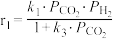 ,CO的生成速率方程
,CO的生成速率方程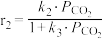 ,
, 、
、 为速率方程常数、
为速率方程常数、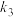 为常数。体系达到平衡时,
为常数。体系达到平衡时,
 的平衡转化率为
的平衡转化率为(4)
 电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
电池的研究取得了新的进展,在TAPP-Mn(Ⅱ)作用下,其电池结构和正极反应历程如下:
①该正极反应历程中有
②放电时,该电池的正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:I.CO2(g)+H2(g) H2O(g)+CO(g) △H1=+41.1kJ/mol
H2O(g)+CO(g) △H1=+41.1kJ/mol
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.0kJ/mol
CH3OH(g) △H2=-90.0kJ/mol
写出CO2催化氢化合成甲醇的热化学方程式:________ 。
(2)为提高CH3OH的产率,理论上应采用的条件是________ (填选项字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
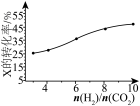
(3)250℃时,在恒容密闭容器中由CO2(g)催化氢化合成 CH3OH(g),不同投料比[n(H2)/n(CO2)]时某反应物X的平衡转化率变化曲线如图所示。反应物X是_______ (填“CO2”或“H2”),判断依据是_______ 。
(4)250℃时,在体积为2.0 L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂发生 CO2催化氢化合成甲醇的反应,10 min时反应达到平衡,测得c(CH3OH) = 0.75 mol • L-1。
①前10 min内的平均反应速率H2=_______ mol • L-1 • min-1。
②该温度下,该反应的化学平衡常数K =_______ 。
③催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下表所示:
根据上表所给数据,用CO2生产甲醇的最优选项为________ (填字母)。
(1)已知:I.CO2(g)+H2(g)
 H2O(g)+CO(g) △H1=+41.1kJ/mol
H2O(g)+CO(g) △H1=+41.1kJ/molII.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.0kJ/mol
CH3OH(g) △H2=-90.0kJ/mol写出CO2催化氢化合成甲醇的热化学方程式:
(2)为提高CH3OH的产率,理论上应采用的条件是
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃时,在恒容密闭容器中由CO2(g)催化氢化合成 CH3OH(g),不同投料比[n(H2)/n(CO2)]时某反应物X的平衡转化率变化曲线如图所示。反应物X是

(4)250℃时,在体积为2.0 L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂发生 CO2催化氢化合成甲醇的反应,10 min时反应达到平衡,测得c(CH3OH) = 0.75 mol • L-1。
①前10 min内的平均反应速率H2=
②该温度下,该反应的化学平衡常数K =
③催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下表所示:
| 试验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】化学兴趣小组同学用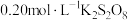 、
、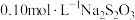 、
、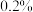 淀粉溶液、
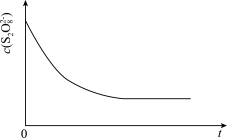
淀粉溶液、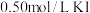 等试剂探究影响化学反应速率的因素。
等试剂探究影响化学反应速率的因素。
已知: (慢)
(慢)
 (快)
(快)
(1)向 、
、 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的___________ (填化学式)耗尽后,溶液颜色将由无色变为蓝色。为确保能观察到蓝色, 与
与 物质的量需满足的关系为
物质的量需满足的关系为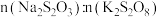
___________ (填“ ”、“
”、“ ”或“
”或“ ”)
”) 。出现蓝色之前,
。出现蓝色之前, 在反应中起到的作用是
在反应中起到的作用是___________ 。
(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
①表中 、
、 和
和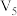 均取
均取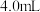 ,目的是
,目的是___________ 。
②表中的
___________ ,理由是___________ 。
③若实验①中观察到溶液变蓝的时间为 ,则用
,则用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率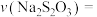
___________ 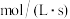 。
。
(3)已知某条件下, 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。________
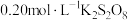 、
、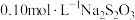 、
、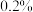 淀粉溶液、
淀粉溶液、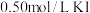 等试剂探究影响化学反应速率的因素。
等试剂探究影响化学反应速率的因素。已知:
 (慢)
(慢)  (快)
(快)(1)向
 、
、 与淀粉的混合溶液中加入一定量的
与淀粉的混合溶液中加入一定量的 溶液,当溶液中的
溶液,当溶液中的 与
与 物质的量需满足的关系为
物质的量需满足的关系为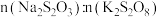
 ”、“
”、“ ”或“
”或“ ”)
”) 。出现蓝色之前,
。出现蓝色之前, 在反应中起到的作用是
在反应中起到的作用是(2)为探究反应物浓度对化学反应速率的影响,设计如下实验方案:
| 实验序号 | 溶液体积 | ||||
 溶液 溶液 |  |  溶液 溶液 |  溶液 溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 |  |  | 4.0 | 2.0 |
| ③ | 8.0 |  |  | 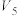 | 2.0 |
 、
、 和
和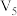 均取
均取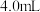 ,目的是
,目的是②表中的

③若实验①中观察到溶液变蓝的时间为
 ,则用
,则用 的浓度变化表示的平均反应速率
的浓度变化表示的平均反应速率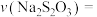
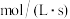 。
。(3)已知某条件下,
 随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时
随反应时间(t)的变化曲线如图,若保持其它条件不变,分别画出降低反应温度和加入催化剂时 随反应时间(t)的变化曲线示意图(进行相应的标注)。
随反应时间(t)的变化曲线示意图(进行相应的标注)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】汽车尾气中的 是空气污染源之一,利用CO催化还原
是空气污染源之一,利用CO催化还原 生成
生成 和
和 的反应是减少汽车尾气污染的有效方法。
的反应是减少汽车尾气污染的有效方法。
回答下列问题:
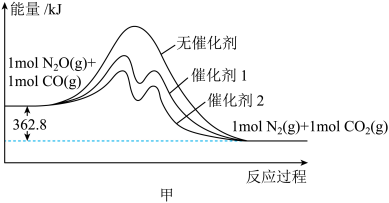
(1)用CO还原 的能量变化如图甲所示,则该反应的热化学方程式为
的能量变化如图甲所示,则该反应的热化学方程式为__________ 。
(2)不同温度和催化剂下,分别向容积为1L的密闭容器中充入 和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,
和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,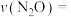
__________  ;在相同温度时,催化剂2催化下
;在相同温度时,催化剂2催化下 的转化率更大的原因是
的转化率更大的原因是__________ 。
(3)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入 、4molCO和相同催化剂,发生
、4molCO和相同催化剂,发生 反应。实验测得A、B容器中
反应。实验测得A、B容器中 的转化率随时间的变化关系如图乙所示。
的转化率随时间的变化关系如图乙所示。
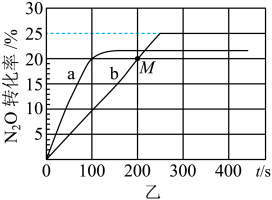
①B容器中 的转化率随时间的变化关系是图乙中的
的转化率随时间的变化关系是图乙中的__________ 曲线(填“a”或“b”)。
②要缩短b曲线对应容器达到平衡的时间,但不改变 的平衡转化率,在催化剂一定的情况下可调节的条件是
的平衡转化率,在催化剂一定的情况下可调节的条件是__________ (填序号)。
A.向体系内充入He气 B.升高温度 C.减小容器体积
③500℃时,该反应的化学平衡常数
__________ (用分数表示)。
④实验测定该反应的反应速率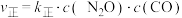 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
__________ (保留到小数点后一位)。
 是空气污染源之一,利用CO催化还原
是空气污染源之一,利用CO催化还原 生成
生成 和
和 的反应是减少汽车尾气污染的有效方法。
的反应是减少汽车尾气污染的有效方法。回答下列问题:
(1)用CO还原
 的能量变化如图甲所示,则该反应的热化学方程式为
的能量变化如图甲所示,则该反应的热化学方程式为
(2)不同温度和催化剂下,分别向容积为1L的密闭容器中充入
 和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,
和1molCO进行实验,经过t秒测得实验数据如下,实验Ⅰ中,使用催化剂1时,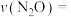
 ;在相同温度时,催化剂2催化下
;在相同温度时,催化剂2催化下 的转化率更大的原因是
的转化率更大的原因是实验 | 温度/℃ | 催化剂 |
|
实验Ⅰ | 400 | 催化剂1 | 9.5 |
400 | 催化剂2 | 10.6 | |
实验Ⅱ | 500 | 催化剂3 | 12.3 |
500 | 催化剂4 | 13.5 |
(3)在容积均为1L的密闭容器A(起始500℃,恒温)、B(起始500℃,绝热)两个容器中分别加入
 、4molCO和相同催化剂,发生
、4molCO和相同催化剂,发生 反应。实验测得A、B容器中
反应。实验测得A、B容器中 的转化率随时间的变化关系如图乙所示。
的转化率随时间的变化关系如图乙所示。
①B容器中
 的转化率随时间的变化关系是图乙中的
的转化率随时间的变化关系是图乙中的②要缩短b曲线对应容器达到平衡的时间,但不改变
 的平衡转化率,在催化剂一定的情况下可调节的条件是
的平衡转化率,在催化剂一定的情况下可调节的条件是A.向体系内充入He气 B.升高温度 C.减小容器体积
③500℃时,该反应的化学平衡常数

④实验测定该反应的反应速率
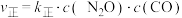 ,
, ,
, 、
、 分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
分别是正、逆反应速率常数,c为物质的量浓度。计算M点处的
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】水煤气可作为燃料以及合成氨、有机合成、氢气制造等的原料。金属氧化物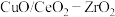 是制备水煤气的高效催化剂。回答下列问题:
是制备水煤气的高效催化剂。回答下列问题:
(1)一定温度下,在催化剂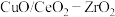 (用
(用 表示)的作用下合成水煤气的过程经历如下反应:
表示)的作用下合成水煤气的过程经历如下反应:
反应ⅰ:
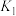
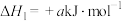
反应ⅱ:

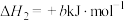 (已知
(已知 、
、 均大于0)
均大于0)
反应ⅲ:


_______  (用含
(用含 、
、 的代数式表示),平衡常数
的代数式表示),平衡常数
_______ (用含 、
、 的代数式表示)。
的代数式表示)。
(2)在恒容密闭容器中,加入足量的催化剂、碳单质和 水蒸气发生上述反应,达到平衡时各气体的物质的量与温度的关系如图所示。已知
水蒸气发生上述反应,达到平衡时各气体的物质的量与温度的关系如图所示。已知 时,容器中起始压强为
时,容器中起始压强为 。
。 的曲线的是
的曲线的是_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
② ,水蒸气的平衡转化率为
,水蒸气的平衡转化率为_______ 。
③ ,反应ⅲ的分压平衡常数
,反应ⅲ的分压平衡常数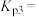
_______ ;升高温度,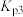
_______ (填“增大”“减小”或“不变”)。
④ ,若起始压强由
,若起始压强由 升高为
升高为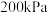 ,反应体系重新达到平衡时,反应ⅱ的分压平衡常数
,反应体系重新达到平衡时,反应ⅱ的分压平衡常数
_______ (填“增大”“减小”或“不变”);容器中 的分压
的分压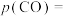
_______ 。
 是制备水煤气的高效催化剂。回答下列问题:
是制备水煤气的高效催化剂。回答下列问题:(1)一定温度下,在催化剂
 (用
(用 表示)的作用下合成水煤气的过程经历如下反应:
表示)的作用下合成水煤气的过程经历如下反应:反应ⅰ:

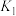
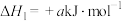
反应ⅱ:


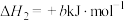 (已知
(已知 、
、 均大于0)
均大于0)反应ⅲ:



 (用含
(用含 、
、 的代数式表示),平衡常数
的代数式表示),平衡常数
 、
、 的代数式表示)。
的代数式表示)。(2)在恒容密闭容器中,加入足量的催化剂、碳单质和
 水蒸气发生上述反应,达到平衡时各气体的物质的量与温度的关系如图所示。已知
水蒸气发生上述反应,达到平衡时各气体的物质的量与温度的关系如图所示。已知 时,容器中起始压强为
时,容器中起始压强为 。
。
 的曲线的是
的曲线的是②
 ,水蒸气的平衡转化率为
,水蒸气的平衡转化率为③
 ,反应ⅲ的分压平衡常数
,反应ⅲ的分压平衡常数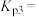
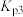
④
 ,若起始压强由
,若起始压强由 升高为
升高为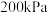 ,反应体系重新达到平衡时,反应ⅱ的分压平衡常数
,反应体系重新达到平衡时,反应ⅱ的分压平衡常数
 的分压
的分压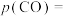
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,写出其热反应方程式:_____________________________________ 。
(2)N2O4与NO2之间存在反应N2O4(g) 2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①由图推测该反应ΔH_______ 0(填“>”或“<”),理由为__________________________ 。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp =____________ 。(保留一位小数,并带单位。用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)

③在一定条件下,该反应N2O4、NO2两者的消耗速率与自身压强间存在关系:v消耗(N2O4)=k1· P(N2O4),v消耗(NO2)=k2·P2(NO2),其中k1、k2是与反应温度有关的速率常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=________________ 。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。N2H4 (1)与N2O4(g)生成4 mol H2O(g)时放出热量1077 kJ,写出其热反应方程式:
(2)N2O4与NO2之间存在反应N2O4(g)
 2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2 (g)将一定量的 N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。①由图推测该反应ΔH
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp =

③在一定条件下,该反应N2O4、NO2两者的消耗速率与自身压强间存在关系:v消耗(N2O4)=k1· P(N2O4),v消耗(NO2)=k2·P2(NO2),其中k1、k2是与反应温度有关的速率常数。则一定温度下,k1、k2与平衡常数Kp的关系是k1=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】页岩气中含有 、
、 、
、 等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。
Ⅰ.Ni催化 加
加 形成
形成 ,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中
,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中 的百分含量及
的百分含量及 的转化率随温度的变化如图2所示。
的转化率随温度的变化如图2所示。

(1)260℃时生成主要产物所发生反应的化学方程式为___________ 。
(2)温度高于320℃, 的转化率下降的原因是
的转化率下降的原因是___________ 。
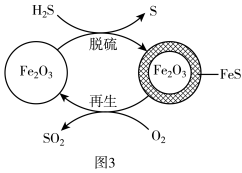
Ⅱ. 的处理:
的处理: 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的可能反应机理如图3所示。
再生的可能反应机理如图3所示。
(3)再生时需控制通入 的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是___________ 。
(4)脱硫剂再生时可以使用水汽代替 。700℃条件下,用水汽代替
。700℃条件下,用水汽代替 再生时,生成
再生时,生成 、
、 和
和 ,
, 也可作脱硫剂。
也可作脱硫剂。
①写出水汽作用条件下脱硫剂再生反应的化学方程式:___________ 。
②用 再生时会生成污染性气体
再生时会生成污染性气体 ,用水汽再生时会排放出有毒的
,用水汽再生时会排放出有毒的 ,采用
,采用 和水汽混合再生的方法,可以将产生的
和水汽混合再生的方法,可以将产生的 和
和 转化为S单质。则为不排放出
转化为S单质。则为不排放出 和
和 ,理论上
,理论上 和水汽的体积比应为
和水汽的体积比应为___________ (写出计算过程)。
 、
、 、
、 等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。Ⅰ.Ni催化
 加
加 形成
形成 ,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中
,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中 的百分含量及
的百分含量及 的转化率随温度的变化如图2所示。
的转化率随温度的变化如图2所示。
(1)260℃时生成主要产物所发生反应的化学方程式为
(2)温度高于320℃,
 的转化率下降的原因是
的转化率下降的原因是Ⅱ.
 的处理:
的处理: 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的可能反应机理如图3所示。
再生的可能反应机理如图3所示。
(3)再生时需控制通入
 的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是(4)脱硫剂再生时可以使用水汽代替
 。700℃条件下,用水汽代替
。700℃条件下,用水汽代替 再生时,生成
再生时,生成 、
、 和
和 ,
, 也可作脱硫剂。
也可作脱硫剂。①写出水汽作用条件下脱硫剂再生反应的化学方程式:
②用
 再生时会生成污染性气体
再生时会生成污染性气体 ,用水汽再生时会排放出有毒的
,用水汽再生时会排放出有毒的 ,采用
,采用 和水汽混合再生的方法,可以将产生的
和水汽混合再生的方法,可以将产生的 和
和 转化为S单质。则为不排放出
转化为S单质。则为不排放出 和
和 ,理论上
,理论上 和水汽的体积比应为
和水汽的体积比应为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】研究 、
、 在一定条件下与
在一定条件下与 催化合成
催化合成 等有机化工产品,对实现“碳中和”目标具有重要的意义。回答下列问题:
等有机化工产品,对实现“碳中和”目标具有重要的意义。回答下列问题:
(1)在一定条件下 与
与 可发生反应:
可发生反应:
 ,结合下图信息,该反应的
,结合下图信息,该反应的
_______  。
。

(2)通过下列反应可实现 合成
合成 、
、 。
。
Ⅰ.

Ⅱ.

在密闭容器中通入
 和
和
 ,分别在压强为
,分别在压强为 和
和 下进行反应。实验中对平衡体系的含碳物质(
下进行反应。实验中对平衡体系的含碳物质( 、
、 、
、 )进行分析,其中温度对
)进行分析,其中温度对 和
和 在三种物质中的体积分数影响如图所示。
在三种物质中的体积分数影响如图所示。

则 时,表示
时,表示 和
和 平衡体积分数随温度变化关系的曲线分别是
平衡体积分数随温度变化关系的曲线分别是_______ 和_______ ;图中M点 的平衡转化率为
的平衡转化率为_______ 。
(3)若在一定温度下,在体积可变的密闭容器中充入
 和
和
 ,此时测得容器内的压强为
,此时测得容器内的压强为 ,发生反应Ⅰ和Ⅱ,
,发生反应Ⅰ和Ⅱ, 达到平衡后,测得反应前后容器中气体的物质的量之比是5:4,且
达到平衡后,测得反应前后容器中气体的物质的量之比是5:4,且 物质的量为
物质的量为 ,在此温度下,
,在此温度下, 内用
内用 分压变化表示的速率
分压变化表示的速率 为
为_______ MPa·min-1,反应Ⅰ的平衡常数
_______ (MPa)-2( 为以分压表示的平衡常数,
为以分压表示的平衡常数,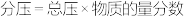 )。
)。
 、
、 在一定条件下与
在一定条件下与 催化合成
催化合成 等有机化工产品,对实现“碳中和”目标具有重要的意义。回答下列问题:
等有机化工产品,对实现“碳中和”目标具有重要的意义。回答下列问题:(1)在一定条件下
 与
与 可发生反应:
可发生反应:
 ,结合下图信息,该反应的
,结合下图信息,该反应的
 。
。
(2)通过下列反应可实现
 合成
合成 、
、 。
。Ⅰ.


Ⅱ.


在密闭容器中通入

 和
和
 ,分别在压强为
,分别在压强为 和
和 下进行反应。实验中对平衡体系的含碳物质(
下进行反应。实验中对平衡体系的含碳物质( 、
、 、
、 )进行分析,其中温度对
)进行分析,其中温度对 和
和 在三种物质中的体积分数影响如图所示。
在三种物质中的体积分数影响如图所示。
则
 时,表示
时,表示 和
和 平衡体积分数随温度变化关系的曲线分别是
平衡体积分数随温度变化关系的曲线分别是 的平衡转化率为
的平衡转化率为(3)若在一定温度下,在体积可变的密闭容器中充入

 和
和
 ,此时测得容器内的压强为
,此时测得容器内的压强为 ,发生反应Ⅰ和Ⅱ,
,发生反应Ⅰ和Ⅱ, 达到平衡后,测得反应前后容器中气体的物质的量之比是5:4,且
达到平衡后,测得反应前后容器中气体的物质的量之比是5:4,且 物质的量为
物质的量为 ,在此温度下,
,在此温度下, 内用
内用 分压变化表示的速率
分压变化表示的速率 为
为
 为以分压表示的平衡常数,
为以分压表示的平衡常数,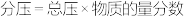 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】碳元素及其化合物与人类的生活、生产息息相关,请回答下列问题:
(1)自然界中的碳循环对人类的生存与发展具有重要意义。
①绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)+(s)+12e- = C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:_________________ 。
②溶洞的形成是石灰岩中的主要成分碳酸钙在一定条件下溶解和沉积形成,请站在活化能的角度解释溶洞形成过程极为缓慢的原因____________ 。
(2) 工业上碳及其化合物是重要的工业原料。
①以CO2、NaCl、NH3为原料制得Na2CO3是“侯氏制碱法”的重要步骤,相关物质的溶解度曲线如图所示,请写出常温下向饱和氯化钠溶液中先后通入足量的NH3、CO2发生反应的离子方程式:___ 。
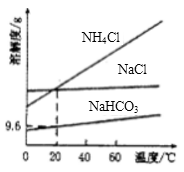
常温常压下,在NaHCO3溶液中存在如下平衡:
HCO3-+H2O H2CO3+OH- Kh=2.27×10-8
H2CO3+OH- Kh=2.27×10-8
HCO3- CO32-+H+ Ka2=4.7×10-11
CO32-+H+ Ka2=4.7×10-11
H2O H++OH- Kw=1.0×10-14
H++OH- Kw=1.0×10-14
请用K定量解释NaHCO3溶液显碱性的原因:____________ ,在NaHCO3溶液中继续通入CO2,至溶液中n(HCO3-):n(H2CO3)= ____________ 时溶液可以达中性。
②工业上可以利用甲醇制备氢气。
甲醇蒸汽重整法制备氢气的胡政尧反应为CH3OH(g) CO(g)+2H2(g),设在容积为2.0L的密闭容器中充入0.60mol的CH3OH(g)体系压强为p1,在一定条件下达到平衡时,体系压强为p2,且p2:p1=2.2,则该条件下CH3OH的平衡转化率为
CO(g)+2H2(g),设在容积为2.0L的密闭容器中充入0.60mol的CH3OH(g)体系压强为p1,在一定条件下达到平衡时,体系压强为p2,且p2:p1=2.2,则该条件下CH3OH的平衡转化率为__________________ 。
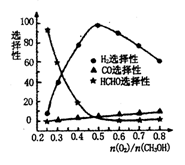
工业上还可以利用甲醇部分氧化法制备氢气,在一定温度下以Ag/CeO2-ZnO为催化剂,原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图所示.则当
n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为__________ ;在制备H2时最好控制n(O2)/n(CH3OH)=________ 。
(1)自然界中的碳循环对人类的生存与发展具有重要意义。
①绿色植物的光合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)+(s)+12e- = C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式为:
②溶洞的形成是石灰岩中的主要成分碳酸钙在一定条件下溶解和沉积形成,请站在活化能的角度解释溶洞形成过程极为缓慢的原因
(2) 工业上碳及其化合物是重要的工业原料。
①以CO2、NaCl、NH3为原料制得Na2CO3是“侯氏制碱法”的重要步骤,相关物质的溶解度曲线如图所示,请写出常温下向饱和氯化钠溶液中先后通入足量的NH3、CO2发生反应的离子方程式:

常温常压下,在NaHCO3溶液中存在如下平衡:
HCO3-+H2O
 H2CO3+OH- Kh=2.27×10-8
H2CO3+OH- Kh=2.27×10-8HCO3-
 CO32-+H+ Ka2=4.7×10-11
CO32-+H+ Ka2=4.7×10-11 H2O
 H++OH- Kw=1.0×10-14
H++OH- Kw=1.0×10-14请用K定量解释NaHCO3溶液显碱性的原因:
②工业上可以利用甲醇制备氢气。
甲醇蒸汽重整法制备氢气的胡政尧反应为CH3OH(g)
 CO(g)+2H2(g),设在容积为2.0L的密闭容器中充入0.60mol的CH3OH(g)体系压强为p1,在一定条件下达到平衡时,体系压强为p2,且p2:p1=2.2,则该条件下CH3OH的平衡转化率为
CO(g)+2H2(g),设在容积为2.0L的密闭容器中充入0.60mol的CH3OH(g)体系压强为p1,在一定条件下达到平衡时,体系压强为p2,且p2:p1=2.2,则该条件下CH3OH的平衡转化率为工业上还可以利用甲醇部分氧化法制备氢气,在一定温度下以Ag/CeO2-ZnO为催化剂,原料气比例对反应选择性(选择性越大,表示生成的该物质越多)影响关系如图所示.则当
n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为
您最近一年使用:0次



