关于第Ⅳ 族的元素——碳(
族的元素——碳( )、硅(
)、硅( )、锗(
)、锗( )、锡(
)、锡( )和铅(
)和铅( ),它们可形成许多结构各异的物质。回答下列问题:
),它们可形成许多结构各异的物质。回答下列问题:
(1)基态 原子的价电子轨道表示式为
原子的价电子轨道表示式为______ ,有______ 种不同运动状态的电子。
(2) 中
中 原子的杂化类型是
原子的杂化类型是______ , 的空间结构是
的空间结构是______ 。
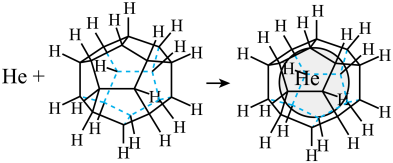
(3)1999年,科学家成功地将一个 原子“装入”了一个
原子“装入”了一个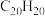 的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为
的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为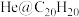 )。则
)。则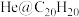 中,
中, 与
与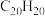 之间的作用力为
之间的作用力为______ 。
(4)第Ⅳ 族的金属元素可形成
族的金属元素可形成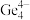 、
、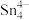 和
和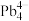 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,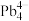 中的键角为
中的键角为______ 。
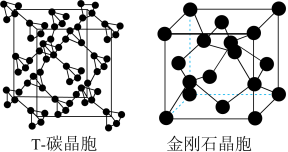
(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成 碳,
碳, 碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
碳的密度约为金刚石的一半 , 碳晶体的晶胞、金刚石的晶胞如图所示。则
碳晶体的晶胞、金刚石的晶胞如图所示。则 碳晶胞的棱长是金刚石晶胞棱长的
碳晶胞的棱长是金刚石晶胞棱长的______ 倍。
(6) 与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。
与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。 与
与 形成的一种超导材料的晶胞如图所示,图中白球表示
形成的一种超导材料的晶胞如图所示,图中白球表示 ,黑球表示钾原子。
,黑球表示钾原子。
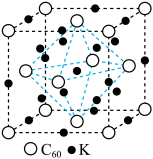
①该材料的化学式是____________ 。
②已知晶胞边长为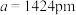 ,则该超导材料的理论密度为
,则该超导材料的理论密度为
____________  (写出表达式)。
(写出表达式)。
 族的元素——碳(
族的元素——碳( )、硅(
)、硅( )、锗(
)、锗( )、锡(
)、锡( )和铅(
)和铅( ),它们可形成许多结构各异的物质。回答下列问题:
),它们可形成许多结构各异的物质。回答下列问题:(1)基态
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)
 中
中 原子的杂化类型是
原子的杂化类型是 的空间结构是
的空间结构是(3)1999年,科学家成功地将一个
 原子“装入”了一个
原子“装入”了一个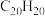 的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为
的空腔内,得到了“世界上最小的氦气球”(如图所示,产物记为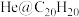 )。则
)。则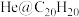 中,
中, 与
与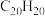 之间的作用力为
之间的作用力为
(4)第Ⅳ
 族的金属元素可形成
族的金属元素可形成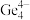 、
、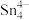 和
和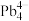 等阴离子,根据等电子体原理判断,
等阴离子,根据等电子体原理判断,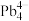 中的键角为
中的键角为(5)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成
 碳,
碳, 碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
碳的晶体结构可以看成金刚石晶体中每个碳原子被一个由四个碳原子组成的正四面体结构单元取代,
 碳晶体的晶胞、金刚石的晶胞如图所示。则
碳晶体的晶胞、金刚石的晶胞如图所示。则 碳晶胞的棱长是金刚石晶胞棱长的
碳晶胞的棱长是金刚石晶胞棱长的
(6)
 与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。
与碱金属形成的盐具有特别的意义,他们能在低温时转变为超导材料。 与
与 形成的一种超导材料的晶胞如图所示,图中白球表示
形成的一种超导材料的晶胞如图所示,图中白球表示 ,黑球表示钾原子。
,黑球表示钾原子。
①该材料的化学式是
②已知晶胞边长为
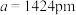 ,则该超导材料的理论密度为
,则该超导材料的理论密度为
 (写出表达式)。
(写出表达式)。
更新时间:2024-02-14 17:31:39
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】青蒿素是从黄花蒿中提取的一种无色针状晶体,其结构如图1,请回答下列问题:

(1)基态O原子的价电子排布图为___ 。
(2)组成青蒿素的三种元素中电负性最大的是__ (填元素符号,下同),第一电离能最大的是__ 。
(3)基态N原子的未成对电子数为___ 。
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
BH4-的空间构型为__ ;B2H6分子的结构如图2,B2H6中B的杂化方式为__ 。
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是___ 。
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是__ ;设晶胞中阴、阳离子为刚性球体且恰好相切,阴、阳离子的半径比约为__ (已知 ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。

(1)基态O原子的价电子排布图为
(2)组成青蒿素的三种元素中电负性最大的是
(3)基态N原子的未成对电子数为
(4)双氢青蒿素是青蒿素的重要衍生物,其抗疟疾疗效优于青蒿素,双氢青蒿素的合成一般是在相转移催化剂聚乙二醇的作用下,用硼氢化钠(NaBH4)还原青蒿素。两种硼氢化物的合成原理如下:
2LiH+B2H6=2LiBH4;4NaH+BF3=NaBH4+3NaF
BH4-的空间构型为
聚乙二醇[HO(CH2CH2O)nH]随着n值的增大,水溶性降低,原因是
(5)NaH的晶胞与NaCl相同,NaH晶体中阳离子的配位数是
 ≈1.414,结果保留三位有效数字)。
≈1.414,结果保留三位有效数字)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。硫酸镍与硫酸铜类似,向其中加入足量氨水同样可以形成 蓝色溶液。完成下列填空。
蓝色溶液。完成下列填空。
(1)在 中
中 与
与 之间形成的化学键是
之间形成的化学键是_______ ,该物质中配位数是_______ 。
(2)在 分子中,中心原子的杂化形式是
分子中,中心原子的杂化形式是_______ ,在 分子中,中心原子的杂化形式是
分子中,中心原子的杂化形式是_______ 。
(3)氨的沸点高于膦( )的沸点,原因是
)的沸点,原因是_______ 。
(4)某镍白铜合金的立方晶胞结构如图所示。

晶胞中铜原子与镍原子的数量比为_______ ,若合金的密度为 ,该立方晶胞的边长为
,该立方晶胞的边长为_______ cm。
(5)分子 可用
可用 表示其结构,推测其分子中
表示其结构,推测其分子中 键与
键与 键之比为
键之比为_______ 。推测该物质中 键与
键与 键之间的键角约为
键之间的键角约为_______ 。
 蓝色溶液。完成下列填空。
蓝色溶液。完成下列填空。(1)在
 中
中 与
与 之间形成的化学键是
之间形成的化学键是(2)在
 分子中,中心原子的杂化形式是
分子中,中心原子的杂化形式是 分子中,中心原子的杂化形式是
分子中,中心原子的杂化形式是(3)氨的沸点高于膦(
 )的沸点,原因是
)的沸点,原因是(4)某镍白铜合金的立方晶胞结构如图所示。

晶胞中铜原子与镍原子的数量比为
 ,该立方晶胞的边长为
,该立方晶胞的边长为(5)分子
 可用
可用 表示其结构,推测其分子中
表示其结构,推测其分子中 键与
键与 键之比为
键之比为 键与
键与 键之间的键角约为
键之间的键角约为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物,单质铁.砷及它们的化合物广泛应用于超导体材料等领域,请回答下列问题:
(1)Fe2+的核外电子排布式为____ 。
(2)NH3是一种很好的配体,NH3的沸点____ (填“>”、“=”或“<”)AsH3。
(3)科学家通过X射线衍射测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力有____ 。

(4)As的卤化物的熔点如表:
表中卤化物熔点差异的原因是____ 。
(5)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与N原子之间形成的化学键是____ ,Fe3+的配位数为____ 。

(1)Fe2+的核外电子排布式为
(2)NH3是一种很好的配体,NH3的沸点
(3)科学家通过X射线衍射测得胆矾结构示意图可简单表示如图,图中虚线表示的作用力有

(4)As的卤化物的熔点如表:
| 物质 | AsCl3 | AsBr3 | AsI3 |
| 熔点/K | 256.8 | 304 | 413 |
(5)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图所示,图中M代表Fe3+,则Fe3+与N原子之间形成的化学键是

您最近一年使用:0次
【推荐1】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第___________ 周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为___________ 。Fe2+的价电子排布图___________
(2)铜能与类卤素(CN)2反应生成Cu(CN)2,1 mol (CN)2分子中含有π键的数目为___________ 。
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为___________ 。
②[Cu(NH3)4]SO4中,不存在的化学键的类型有___________ (填选项)。
A.离子键 B.配位键 C.非极性键 D.极性键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为___________ 。
(1)钕(Nd)为60号元素,在周期表中位于第
(2)铜能与类卤素(CN)2反应生成Cu(CN)2,1 mol (CN)2分子中含有π键的数目为
(3)Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为
②[Cu(NH3)4]SO4中,不存在的化学键的类型有
A.离子键 B.配位键 C.非极性键 D.极性键
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
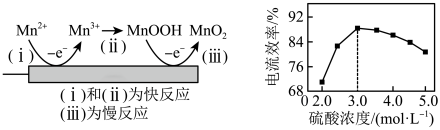
【推荐2】以软锰矿与黄铁矿为主要原料制备高品质 的工艺流程:
的工艺流程:
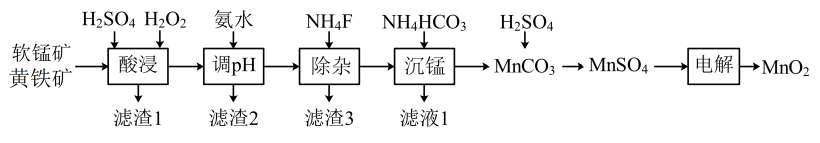
已知:①软锰矿与黄铁矿的主要成分分别为 、
、 ,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
回答下列问题:
(1)基态 的价层电子排布图为
的价层电子排布图为___________ 。
(2)“酸浸”过程中,为提高反应速率可以采取的措施有___________ (写一条)。
(3)“酸浸”加入 后,主要反应的离子方程式:
后,主要反应的离子方程式:
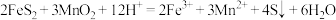

滤渣1的主要成分为S、___________ ,加入 后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:
后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:___________ 。
(4)“调pH”操作中需调节溶液pH范围为4.7~6.0,此时滤渣2的主要成分为___________ (填化学式)。
(5)“沉锰”步骤发生主要反应的离子方程式为___________ 。
(6)利用惰性电极电解 体系获得
体系获得 的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过
的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过 时,电流效率η降低的原因是
时,电流效率η降低的原因是___________ 。( )
)
 的工艺流程:
的工艺流程:
已知:①软锰矿与黄铁矿的主要成分分别为
 、
、 ,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;
,还均含少量Fe、Ca、Mg、Al、Si等元素的氧化物;②该工艺条件下,相关金属离子形成氢氧化物沉淀的pH:
| 金属离子 |  |  |  |  |  |
| 开始沉淀的pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全( )的pH )的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
(1)基态
 的价层电子排布图为
的价层电子排布图为(2)“酸浸”过程中,为提高反应速率可以采取的措施有
(3)“酸浸”加入
 后,主要反应的离子方程式:
后,主要反应的离子方程式: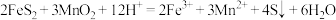

滤渣1的主要成分为S、
 后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:
后迅速产生大量气泡,可减少滤渣1在矿粉表面的附着,有利于酸浸。分析迅速产生气泡的原因:(4)“调pH”操作中需调节溶液pH范围为4.7~6.0,此时滤渣2的主要成分为
(5)“沉锰”步骤发生主要反应的离子方程式为
(6)利用惰性电极电解
 体系获得
体系获得 的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过
的机理如图所示,硫酸浓度与电流效率η的关系如图所示。硫酸浓度超过 时,电流效率η降低的原因是
时,电流效率η降低的原因是 )
)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】已知X、Y、Z、W、Q、R为前四周期元素,且只有R为金属元素。X原子是元素周期表中半径最小的原子;Y原子的电子占据2个能层且原子中成对的电子数是未成对电子数的2倍;Z的基态原子中有7种运动状态不同的电子;W元素在地壳中含量最多;Q是元素周期表中电负性最大的元素;R+离子的核外电子占据3个能层且完全充满电子。回答下列问题:
(1)R的基态原子的价层电子轨道表示式为:______ 。
(2)Y、Z、W、Q元素的第一电离能由小到大的顺序为(用元素符号表示)______ 。
(3)Z2Q2分子中Z的杂化方式为:______ ;1molZ2Q2分子有______ molσ键。
(4)ZW 的空间结构为:
的空间结构为:______ 。
(5)2019年《Science》杂志报道了制取X2W2的绿色方法,原理如图所示______ mole-
②用该电池电解一定浓度R元素的硫酸盐溶液(电解池电极为惰性电极),写出阳极的电极反应式:______
(1)R的基态原子的价层电子轨道表示式为:
(2)Y、Z、W、Q元素的第一电离能由小到大的顺序为(用元素符号表示)
(3)Z2Q2分子中Z的杂化方式为:
(4)ZW
 的空间结构为:
的空间结构为:(5)2019年《Science》杂志报道了制取X2W2的绿色方法,原理如图所示

②用该电池电解一定浓度R元素的硫酸盐溶液(电解池电极为惰性电极),写出阳极的电极反应式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼 的是:___________ (填元素符号),检验太阳光中是否含有该元素的方法是___________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________ ,碱性最强的化合物的电子式 是:___________ 。
(3)⑩简单氢化物的VSEPR构型是___________ 形,①⑥形成的化合物可作溶剂,该分子中心原子杂化轨道是___________ ,分子构型___________ 形。
(4)用电子式表示元素④与⑥的化合物的形成过程:___________
(5)表示①与⑦的化合物的电子式___________ ,该化合物是___________ 分子(填“极性”“非极性”)的理由:___________ 。
(6)试用一个离子方程式说明②和③的简单氢化物结合Cu2+的能力___________ 。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ⑧ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)⑩简单氢化物的VSEPR构型是
(4)用电子式表示元素④与⑥的化合物的形成过程:
(5)表示①与⑦的化合物的电子式
(6)试用一个离子方程式说明②和③的简单氢化物结合Cu2+的能力
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】三价铬离子( )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
(1)Cr的核外电子排布式为_______ 。
(2) 分子的 空间结构为
分子的 空间结构为_______ ,其中心原子的杂化方式为_______ 。
(3) 分子可以与
分子可以与 结合生成
结合生成 ,这个过程发生改变的是
,这个过程发生改变的是_______ (填序号)。
a.微粒的空间结构 b.N原子的杂化类型 c.H-N-H键角 d.微粒的电子数
(4)C、N、O三种元素的第一电离能从大到小的顺序为_______ 。
(5) 的沸点高于
的沸点高于 是因为
是因为_______ 。
(6)Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如图所示,该合金的化学式为_______ 。

 )是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:
)是葡萄糖耐量因子(GTF)的重要组成成分,GTF能够协助胰岛素发挥作用。构成葡萄糖耐量因子和蛋白质的元素有C、HO、N、S、Cr等。回答下列问题:(1)Cr的核外电子排布式为
(2)
 分子的 空间结构为
分子的 空间结构为(3)
 分子可以与
分子可以与 结合生成
结合生成 ,这个过程发生改变的是
,这个过程发生改变的是a.微粒的空间结构 b.N原子的杂化类型 c.H-N-H键角 d.微粒的电子数
(4)C、N、O三种元素的第一电离能从大到小的顺序为
(5)
 的沸点高于
的沸点高于 是因为
是因为(6)Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如图所示,该合金的化学式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】亚硝酰氯(NOCl)是有机药物制备的重要试剂,可按以下流程合成和利用。
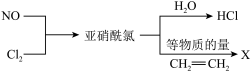
已知:亚硝酰氯有毒,沸点-5.5℃,分子中各原子均满足8电子稳定结构。
请回答:
(1)NOCl的电子式为___________ ,化合物X的结构简式为___________ 。
(2)下列说法正确的是___________。
(3)已知浓盐酸和浓硝酸混合配制王水时会产生亚硝酰氯,写出该反应的化学方程式___________ 。
(4)设计实验验证化合物X中含有Cl元素___________ 。

已知:亚硝酰氯有毒,沸点-5.5℃,分子中各原子均满足8电子稳定结构。
请回答:
(1)NOCl的电子式为
(2)下列说法正确的是___________。
| A.NOCl中的氮元素呈正价 |
| B.NOCl分子的空间结构为V形 |
C.化合物X的沸点低于氯乙酰胺(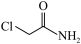 ) ) |
| D.工业上可以用蒸馏水吸收多余的NOCl,防止污染环境 |
(3)已知浓盐酸和浓硝酸混合配制王水时会产生亚硝酰氯,写出该反应的化学方程式
(4)设计实验验证化合物X中含有Cl元素
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________ ,Ni在元素周期表中的位置是_________ 。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______ ,中心原子的轨道杂化类型是_______ 。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________ ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(4)一种钛镍合金的立方晶胞结构如图所示:
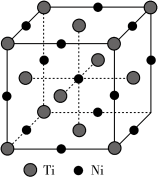
①该合金中Ti的配位数为________ 。
②若合金的密度为d g/cm3,晶胞边长a=________ pm。(用含d的计算式表示)
(1)写出基态Ti原子的电子排布式:
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是
(4)一种钛镍合金的立方晶胞结构如图所示:

①该合金中Ti的配位数为
②若合金的密度为d g/cm3,晶胞边长a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水。A和E可形成离子化合物,其晶胞结构如下图所示:

(1)A和E所形成的化合物的电子式是_________
(2)A、B、C、D四种元素的原子半径由小到大的顺序为_______________ (用元素符号表示)
(3)A和D的氢化物中,后者沸点较低,原因是____________
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有______ 个;
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)____________ 。

(1)A和E所形成的化合物的电子式是
(2)A、B、C、D四种元素的原子半径由小到大的顺序为
(3)A和D的氢化物中,后者沸点较低,原因是
(4)A和E的化合物晶体中,每个阳离子的周围与它最近且等距离的阳离子共有
(5)已知A和E所形成的化合物晶体的晶胞体积为1.6×10-22cm3,则A和E组成的离子化合物的密度为(结果保留一位小数)
您最近一年使用:0次
【推荐3】下图为①冰 ②金刚石 ③铜 ④氧化镁 ⑤氯化钙 ⑥干冰六种晶体或晶胞:

(1)上述晶体中,粒子之间以共价键结合形成的晶体是_______ (用序号填空,下同)。
(2)①冰、②金刚石、④MgO、⑤CaCl2、⑥干冰5种晶体熔点由高到低的顺序为_______ 。
(3)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_______ 。
(4)每个Cu晶胞中实际占有_______ 个Cu原子,CaCl2晶体中Ca2+的配位数_______ 。
(5)MgO晶胞密度为d g/cm3,则MgO晶胞的边长为_______ cm。

(1)上述晶体中,粒子之间以共价键结合形成的晶体是
(2)①冰、②金刚石、④MgO、⑤CaCl2、⑥干冰5种晶体熔点由高到低的顺序为
(3)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是
(4)每个Cu晶胞中实际占有
(5)MgO晶胞密度为d g/cm3,则MgO晶胞的边长为
您最近一年使用:0次



