氮及其化合物在科技、社会生活中有着广泛的应用。请按要求回答下列问题。
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)=5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是___________ (填字母)。
a.ΔH不变
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.化学平衡常数K不变
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v正___________ v逆(填“>”“<”或“=”)。
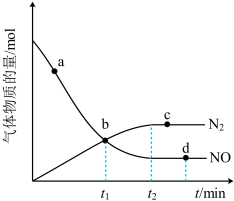
(2)298K时,若已知生成标准状况下2.24LNH3时放出热量为4.62kJ。在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4kJ,其原因是___________ 。
(3)CO2和H2在铁系催化剂作用下发生化学反应:
 ΔH1
ΔH1
 ΔH2>0
ΔH2>0
在容积为VL的密闭容器中通入1molCO2和3molH2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图所示。
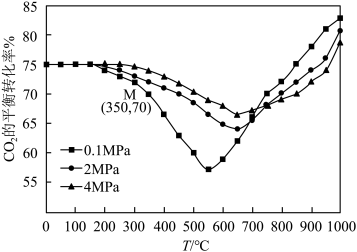
图中点M(350.70),此时乙烯的选择性为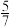 (选择性转化的CO2中生成C2H4和CO的百分比),计算该温度时,反应Ⅱ的平衡常数K=
(选择性转化的CO2中生成C2H4和CO的百分比),计算该温度时,反应Ⅱ的平衡常数K=___________ 。
(1)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)=5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是
a.ΔH不变
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.化学平衡常数K不变
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中b点对应的速率关系是v正

(2)298K时,若已知生成标准状况下2.24LNH3时放出热量为4.62kJ。在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量总小于92.4kJ,其原因是
(3)CO2和H2在铁系催化剂作用下发生化学反应:
 ΔH1
ΔH1 ΔH2>0
ΔH2>0在容积为VL的密闭容器中通入1molCO2和3molH2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图所示。

图中点M(350.70),此时乙烯的选择性为
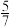 (选择性转化的CO2中生成C2H4和CO的百分比),计算该温度时,反应Ⅱ的平衡常数K=
(选择性转化的CO2中生成C2H4和CO的百分比),计算该温度时,反应Ⅱ的平衡常数K=
更新时间:2024-01-31 20:20:43
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】努力实现碳达峰、碳中和展现了我国积极参与和引领全球气候治理的大国担当。 的综合利用是实现碳中和的保证。
的综合利用是实现碳中和的保证。
I.回收利用 解决空间站供氧问题物质转化如图所示:
解决空间站供氧问题物质转化如图所示:

(1)反应A为 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。
已知:
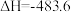 kJ⋅mol-1
kJ⋅mol-1

 kJ⋅mol-1
kJ⋅mol-1
反应A的
_______ kJ⋅mol-1
(2)将原料气按 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。

①理论上,能提高 平衡转化率的措施有
平衡转化率的措施有_______ (选填编号)
a.降温
b.缩小容器体积
c.向容器中冲入Ar,增大压强
d.提高原料气中 的比例
的比例
②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高 的转化效率,原因是
的转化效率,原因是_______ 。
(3)下列关于空间站内物质和能量变化的说法中,不正确的是_______ (填字母)。
a.反应B的主要能量变化是“电能→化学能”或“光能→化学能”
b.物质转化中O、H原子的利用率均为100%
c.不用 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用
(4)用 代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是_______ 。
II.利用 生产乙烯:
生产乙烯: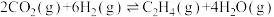
 ;在三个容积均为1 L的密闭容器中以不同的氢碳比
;在三个容积均为1 L的密闭容器中以不同的氢碳比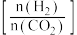 充入
充入 和
和 ,在一定条件下
,在一定条件下 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。

(5)下列说法正确的是_______
a.该反应的
b.氢碳比:①>②
c.在氢碳比为2.0时,Q点: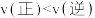
(6)若起始时, 、
、 浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则
浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则计算 可得P点对应温度的平衡常数为_______ (mol⋅L-1)-3。
 的综合利用是实现碳中和的保证。
的综合利用是实现碳中和的保证。I.回收利用
 解决空间站供氧问题物质转化如图所示:
解决空间站供氧问题物质转化如图所示:
(1)反应A为
 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。已知:

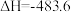 kJ⋅mol-1
kJ⋅mol-1
 kJ⋅mol-1
kJ⋅mol-1反应A的

(2)将原料气按
 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高
 平衡转化率的措施有
平衡转化率的措施有a.降温
b.缩小容器体积
c.向容器中冲入Ar,增大压强
d.提高原料气中
 的比例
的比例②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
 的转化效率,原因是
的转化效率,原因是(3)下列关于空间站内物质和能量变化的说法中,不正确的是
a.反应B的主要能量变化是“电能→化学能”或“光能→化学能”
b.物质转化中O、H原子的利用率均为100%
c.不用
 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用(4)用
 代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是II.利用
 生产乙烯:
生产乙烯: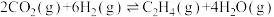
 ;在三个容积均为1 L的密闭容器中以不同的氢碳比
;在三个容积均为1 L的密闭容器中以不同的氢碳比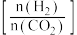 充入
充入 和
和 ,在一定条件下
,在一定条件下 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
(5)下列说法正确的是
a.该反应的

b.氢碳比:①>②
c.在氢碳比为2.0时,Q点:
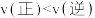
(6)若起始时,
 、
、 浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则
浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】近几年经济发展迅速,汽车数量越来越多,在方便我们的工作和生活的同时,也带来了严重的环境问题,为了消除汽车尾气对大气环境和人体健康造成的影响,科学家们想了很多处理尾气的方法。
(1)活性炭可用于处理汽车尾气中的NO,有关反应为C(s)+2NO(g) N2(g)+CO2(g)。
N2(g)+CO2(g)。
①判断该反应达到平衡的标志为___ 。(填标号)
A.容器内气体的物质的量恒定
B.NO、N2、CO2的物质的量之比为2:1:1
C.v正(NO)=2v逆(CO2)
D.容器内气体密度恒定
②某温度时,向4L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g) C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:

a.图中A点v正___ v逆(填“>”“<”或“=”)。
b.0~20min内的N2平均反应速率v=___ ;在此过程中,气体的平均相对分子质量___ (填“增大”、“减小”或“不变”)。
c.第20min时,外界改变的条件可能是___ 。
(2)CO可以与NO2反应:4CO(g)+2NO2(g) N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图象,根据图象分析:△H
N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图象,根据图象分析:△H___ 0(填“>”或“<”,下同);p1__ p2。

(1)活性炭可用于处理汽车尾气中的NO,有关反应为C(s)+2NO(g)
 N2(g)+CO2(g)。
N2(g)+CO2(g)。①判断该反应达到平衡的标志为
A.容器内气体的物质的量恒定
B.NO、N2、CO2的物质的量之比为2:1:1
C.v正(NO)=2v逆(CO2)
D.容器内气体密度恒定
②某温度时,向4L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)
 C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
C(s)+2NO(g);其中CO2、NO物质的量随时间变化的曲线如图所示。请回答下列问题:
a.图中A点v正
b.0~20min内的N2平均反应速率v=
c.第20min时,外界改变的条件可能是
(2)CO可以与NO2反应:4CO(g)+2NO2(g)
 N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图象,根据图象分析:△H
N2(g)+4CO2(g),如图为该反应中CO的平衡转化率在不同压强下随温度变化的图象,根据图象分析:△H
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。将氯化氢转化为氯气的技术成为化学研究的热点。
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1 时HCl平衡转化率随温度变化的关系:
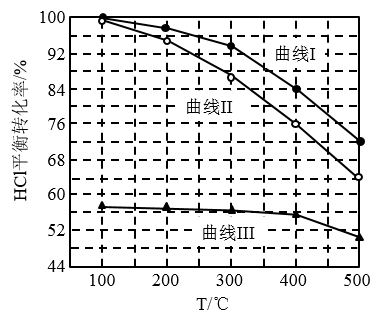
①图1中进料浓度比c(HCl):c(O2)=4:1的曲线是_______ 。(填“曲线I”、“曲线II”、“曲线III” )
②设HCl初始浓度为c0,根据进料浓度比c(HCl):c(O2)=1:1的数据计算K(400℃)=_______ (只需列出数据计算式,不必化简)。
③进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是_______ 、_________ 。
④若HCl和O2的物质的量之比为n:1,相应平衡体系中Cl2的物质的量分数为x,请在下图中绘制x随n变化的示意图____ 。

(2)Deacon直接氧化法可按下列催化过程进行:按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
O2(g)=CuO(s)+  Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
①4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_______ kJ·mol-1。
②在一定温度的条件下,进一步提高HCl的转化率的方法是_______ (写出2种)。
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1 时HCl平衡转化率随温度变化的关系:

①图1中进料浓度比c(HCl):c(O2)=4:1的曲线是
②设HCl初始浓度为c0,根据进料浓度比c(HCl):c(O2)=1:1的数据计算K(400℃)=
③进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是
④若HCl和O2的物质的量之比为n:1,相应平衡体系中Cl2的物质的量分数为x,请在下图中绘制x随n变化的示意图

(2)Deacon直接氧化法可按下列催化过程进行:按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。
CuCl2(s)=CuCl(s)+
 Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1CuCl(s)+
 O2(g)=CuO(s)+
O2(g)=CuO(s)+  Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
①4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=
②在一定温度的条件下,进一步提高HCl的转化率的方法是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.在恒温条件下将一定量M和N的混合气体通入容积为2L的密闭容器中,M和N两物质的物质的量随时间的变化情况如图所示。

(1)该反应的化学方程式为______ (反应物或生成物用符号M、N表示)。
(2)反应开始至4min,M的平均反应速率为____________ 。
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的点是____________ 。
Ⅱ.在恒温条件下,将amol 与amol
与amol 的混合气体通入一个固定容积的密闭容器中,
的混合气体通入一个固定容积的密闭容器中,
发生如下反应: 。
。
(4)反应进行到某时刻t时, ,
,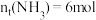 ,则a的值为
,则a的值为_______ 。
(5)在合成氨过程中,正反应是放热反应。下列有关说法错误的是_______ (填序号)。
a.使用催化剂是为了提高正反应速率,提高生产效率
b.在上述条件下, 不可能100%地转化为
不可能100%地转化为
c.通过控制反应条件,不能提高该反应进行的程度
(6)某合成氨速率方程为: ,根据表中数据,
,根据表中数据,
_______ 。

(1)该反应的化学方程式为
(2)反应开始至4min,M的平均反应速率为
(3)a、b、c、d四个点中,表示化学反应处于平衡状态的点是
Ⅱ.在恒温条件下,将amol
 与amol
与amol 的混合气体通入一个固定容积的密闭容器中,
的混合气体通入一个固定容积的密闭容器中,发生如下反应:
 。
。(4)反应进行到某时刻t时,
 ,
,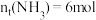 ,则a的值为
,则a的值为(5)在合成氨过程中,正反应是放热反应。下列有关说法错误的是
a.使用催化剂是为了提高正反应速率,提高生产效率
b.在上述条件下,
 不可能100%地转化为
不可能100%地转化为
c.通过控制反应条件,不能提高该反应进行的程度
(6)某合成氨速率方程为:
 ,根据表中数据,
,根据表中数据,
实验 |
|
|
|
|
1 | m | n | p | q |
2 | 2m | n | p | 2q |
3 | m | n | 0.1p | 10q |
4 | m | 2n | p | 2.828q |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】碘化钾是常用的化工原料。某实验小组设计实验探究 的还原性。
的还原性。
I.探究不同条件下空气中氧气氧化 的速率。
的速率。
(1)酸性条件下 能被空气中氧气氧化,发生反应的离子方程式为
能被空气中氧气氧化,发生反应的离子方程式为_______ 。
(2)通过实验组别1和组别2探究温度对氧化速率的影响。其中
_______ ,
_______ 。
(3)设计实验组别3的目的是_______ 。
Ⅱ.探究反应“ ”为可逆反应。
”为可逆反应。
试剂: 溶液,
溶液, 溶液,淀粉溶液,
溶液,淀粉溶液, 溶液,
溶液, 溶液。实验如下:
溶液。实验如下:

(4)甲同学通过试管i和试管ⅱ中现象结合可证明该反应为可逆反应,则试管i中现象为:_______ ;乙同学认为该现象无法证明该反应为可逆反应,原因为_______ 。
(5)请选择上述试剂重新设计实验,证明该反应为可逆反应_______ 。
 的还原性。
的还原性。I.探究不同条件下空气中氧气氧化
 的速率。
的速率。| 组别 | 温度 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | 淀粉溶液 | ||
 | V |  | V | ||||
| 1 |  |  |  |  |  |  | 3滴 |
| 2 |  |  | 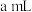 | 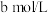 |  |  | 3滴 |
| 3 |  |  |  | 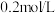 |  |  | 3滴 |
 能被空气中氧气氧化,发生反应的离子方程式为
能被空气中氧气氧化,发生反应的离子方程式为(2)通过实验组别1和组别2探究温度对氧化速率的影响。其中


(3)设计实验组别3的目的是
Ⅱ.探究反应“
 ”为可逆反应。
”为可逆反应。试剂:
 溶液,
溶液, 溶液,淀粉溶液,
溶液,淀粉溶液, 溶液,
溶液, 溶液。实验如下:
溶液。实验如下:
(4)甲同学通过试管i和试管ⅱ中现象结合可证明该反应为可逆反应,则试管i中现象为:
(5)请选择上述试剂重新设计实验,证明该反应为可逆反应
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】实验中学高二化学某班学生甲、乙小组,分别用实验探究溶液中 、
、 的化学性质回答下列问题:
的化学性质回答下列问题:
(1)将硫酸亚铁溶液滴入硫酸酸化的 溶液中,振荡混合后,溶液中含有
溶液中,振荡混合后,溶液中含有 、
、 等。以下请用离子方程式回答:
等。以下请用离子方程式回答:
①25℃时硫酸亚铁溶液 的原因:
的原因:___________ 。
②请写出硫酸亚铁溶液与硫酸酸化的 溶液反应的原理:
溶液反应的原理:___________ 。
(2)甲组同学取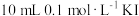 溶液,加入
溶液,加入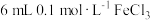 溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:
溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入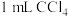 充分振荡、静置,
充分振荡、静置, 层显紫色;
层显紫色;
②第二支试管中加入1滴 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红实验。
②检验的离子是___________ (填离子符号);
实验①和③说明:在 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有___________ (填离子符号),由此可以证明该氧化还原反应为___________ (填可逆反应或不可逆反应)。
(3)乙组同学向盛有 溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:
溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:___________ 。一段时间后,溶液中有气泡出现,试管微热,随后有红褐色沉淀生成。产生气泡的原因是___________ 。
 、
、 的化学性质回答下列问题:
的化学性质回答下列问题:(1)将硫酸亚铁溶液滴入硫酸酸化的
 溶液中,振荡混合后,溶液中含有
溶液中,振荡混合后,溶液中含有 、
、 等。以下请用离子方程式回答:
等。以下请用离子方程式回答:①25℃时硫酸亚铁溶液
 的原因:
的原因:②请写出硫酸亚铁溶液与硫酸酸化的
 溶液反应的原理:
溶液反应的原理:(2)甲组同学取
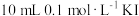 溶液,加入
溶液,加入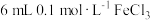 溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:
溶液混合。充分反应后,分别取2 mL此溶液于3支试管中进行如下实验:①第一支试管中加入
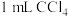 充分振荡、静置,
充分振荡、静置, 层显紫色;
层显紫色;②第二支试管中加入1滴
 溶液,生成蓝色沉淀;
溶液,生成蓝色沉淀;③第三支试管中加入1滴KSCN溶液,溶液变红实验。
②检验的离子是
实验①和③说明:在
 过量的情况下,溶液中仍含有
过量的情况下,溶液中仍含有(3)乙组同学向盛有
 溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:
溶液的试管中加入几滴硫酸酸化的硫酸亚铁溶液,溶液变成棕黄色,发生反应的离子方程式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】当前,我国公布了实现“碳达峰、碳中和”目标的具体时间。因此,含碳化合物的综合利用,有效缓解温室效应成为研究热点。回答下列问题:
(1)CO2可与 H2制甲醇:
在催化剂作用下,发生以下反应:
I. CO2(g)+3 H2 (g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1 = - 49 kJ·mol-1
H1 = - 49 kJ·mol-1
II. CO2(g)+ H2 (g) CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2 = + 41 kJ·mol-1
H2 = + 41 kJ·mol-1
则:III. CO (g) + 2H2(g) CH3OH(g)
CH3OH(g)  H =
H = ___________ 。若将等物质的量的 CO 和 H2 充入恒温恒容密闭容器中进行反应III,下列事实能说明此反应已达到平衡状态的是 ___________ 。
A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和 H2 的物质的量之比为 1: 2
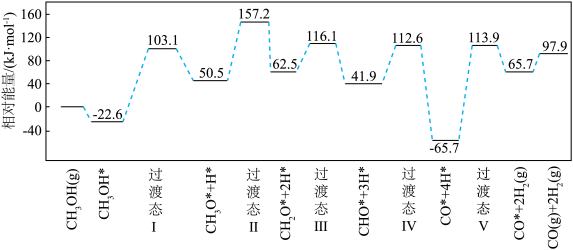
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea =___________ kJ·mol-1,写出该步骤的化学方程式:___________ 。
(3)利用 CO2和 CH4重整也是实现“碳中和”目标的重要途径: CO2 (g)+CH4 (g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)  H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
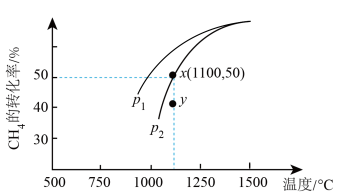
①结合图示,p1___________ p2,在p2下,y点时v正 ___________ v逆 (填“>”“<”或“=”)
②用平衡分压代替平衡浓度可以得到平衡常数 Kp,则x点对应温度下反应的平衡常数Kp =__________ (已知:气体分压 = 气体总压 X 气体的物质的量分数)。
(1)CO2可与 H2制甲醇:
在催化剂作用下,发生以下反应:
I. CO2(g)+3 H2 (g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  H1 = - 49 kJ·mol-1
H1 = - 49 kJ·mol-1II. CO2(g)+ H2 (g)
 CO(g)+ H2O(g)
CO(g)+ H2O(g)  H2 = + 41 kJ·mol-1
H2 = + 41 kJ·mol-1则:III. CO (g) + 2H2(g)
 CH3OH(g)
CH3OH(g)  H =
H = A.生成 CH3OH 的速率与生成 H2的速率相等
B.CO 的体积分数保持不变
C.混合气体的平均相对分子质量不变
D.CO和 H2 的物质的量之比为 1: 2
(2)在钯基催化剂表面上,甲醇制氢的反应历程如图所示,其中吸附在钯催化剂表面上的物种用*标注。该历程中最大能垒(活化能)Ea =

(3)利用 CO2和 CH4重整也是实现“碳中和”目标的重要途径: CO2 (g)+CH4 (g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)  H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
H > 0,在密闭容器中通入物质的量均为 0.1 mol 的 CH4和CO2,在一定条件下发生上述反应, CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
①结合图示,p1
②用平衡分压代替平衡浓度可以得到平衡常数 Kp,则x点对应温度下反应的平衡常数Kp =
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+ 4C(s) 3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1
3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1
②C(s)+ CO2(g) 2CO(g) △H=+172.5kJ·mol﹣1
2CO(g) △H=+172.5kJ·mol﹣1
则Fe3O4(s)+ 4CO(g) 3Fe(s)+ 4CO2(g) △H=
3Fe(s)+ 4CO2(g) △H=________________ .
(2)反应Fe(s)+ CO2(g) FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:
①从表中数据可推断,该反应是___________ (填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是_____________ (填字母).
A.c(CO2)= c(CO) B.v正(CO2)= v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+ CO2(g) CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:
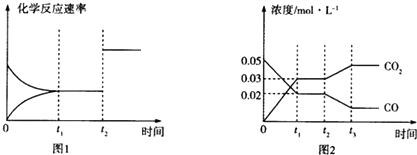
①图2中,若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=____ mol·L﹣1·min ﹣1。
②图1中t2时刻改变的条件是________________________________ (任写两种,下同);图2中t2时刻改变的条件是_________________________________ .
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为_______________________ ;若使用该电池电解熔融Al2O3制取10.8g Al,则理论上需要氧气的体积为__________ L.(标准状况下)。
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+ 4C(s)
 3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1
3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1②C(s)+ CO2(g)
 2CO(g) △H=+172.5kJ·mol﹣1
2CO(g) △H=+172.5kJ·mol﹣1则Fe3O4(s)+ 4CO(g)
 3Fe(s)+ 4CO2(g) △H=
3Fe(s)+ 4CO2(g) △H=(2)反应Fe(s)+ CO2(g)
 FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:| 温度/K | 973 | 1173 | 1373 | 1573 |
| K | 1.47 | 2.15 | 3.36 | 8.92 |
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是
A.c(CO2)= c(CO) B.v正(CO2)= v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+ CO2(g)
 CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:
①图2中,若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=
②图1中t2时刻改变的条件是
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和CO2,熔融碳酸钠作为电解质,工作时负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】甲醇(CH3OH)是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
反应Ⅲ:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
回答下列问题:
(1)反应I进行的过程中体系内化学能减少,则反应I为______ (填“吸热”或“放热”)反应。
(2)已知反应Ⅱ为吸热反应,若反应Ⅱ在一绝热恒容密闭容器中进行,能说明反应已达到平衡状态的是______ (填字母)。
a.v(CO)=v(H2O)
b.温度不变
c.容器内CO2的体积分数保持不变
(3)250℃时,向体积为2L的恒容密闭容器中充入3molH2和1molCO2发生反应Ⅱ。经过5min达到平衡状态,平衡时测得CO2的转化率为50%。
①该温度下,反应开始至5min时,该反应的平均反应速率v(H2)=______ 。
②平衡时,H2的体积分数为_______ %,CO的物质的量浓度为______ mol•L-1。
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ中CO2与CO 反应的离子方程式。
反应的离子方程式。
I.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ._______
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
②根据①中反应步骤,可以判断Li-CO2电池中,在负极参与反应的物质为_______ (填“Li”或“CO2”)。
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g);
CO(g)+H2O(g);反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。回答下列问题:
(1)反应I进行的过程中体系内化学能减少,则反应I为
(2)已知反应Ⅱ为吸热反应,若反应Ⅱ在一绝热恒容密闭容器中进行,能说明反应已达到平衡状态的是
a.v(CO)=v(H2O)
b.温度不变
c.容器内CO2的体积分数保持不变
(3)250℃时,向体积为2L的恒容密闭容器中充入3molH2和1molCO2发生反应Ⅱ。经过5min达到平衡状态,平衡时测得CO2的转化率为50%。
①该温度下,反应开始至5min时,该反应的平均反应速率v(H2)=
②平衡时,H2的体积分数为
(4)我国科学家研究Li-CO2电池,取得了重大科研成果。
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ中CO2与CO
 反应的离子方程式。
反应的离子方程式。I.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3②根据①中反应步骤,可以判断Li-CO2电池中,在负极参与反应的物质为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】天然气的主要成分为CH4,还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g) C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:
C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:
①ΔH=___________ kJ•mol-1。
②提高该反应平衡转化率的方法有___________ 、___________ 。
(2)密闭容器中通入等物质的量的乙烷和氢气,在等温等压下(p)发生上述反应C2H6(g) C2H4(g)+H2(g)。
C2H4(g)+H2(g)。
①可判断该反应达平衡的标志为___________ (填选项字母)。
A.容器内混合气体的密度恒定
B.容器内混合气体的压强恒定
C.容器内乙烷和氢气的物质的量之比恒定
D.生成乙烯的速率和乙烷消耗的速率相等
②如果乙烷的平衡转化率为α,反应的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=___________ r1。
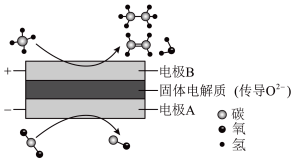
(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:___________ 。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为___________ 。
(1)乙烷在一定条件可发生如下反应:C2H6(g)
 C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:
C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:| 物质 | C2H6(g) | C2H4(g) | H2(g) |
| 燃烧热ΔH/(kJ•mol-1) | —1560 | —1411 | —286 |
②提高该反应平衡转化率的方法有
(2)密闭容器中通入等物质的量的乙烷和氢气,在等温等压下(p)发生上述反应C2H6(g)
 C2H4(g)+H2(g)。
C2H4(g)+H2(g)。①可判断该反应达平衡的标志为
A.容器内混合气体的密度恒定
B.容器内混合气体的压强恒定
C.容器内乙烷和氢气的物质的量之比恒定
D.生成乙烯的速率和乙烷消耗的速率相等
②如果乙烷的平衡转化率为α,反应的平衡常数Kp=
(3)高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
C2H6+H2,反应在初期阶段的速率方程为:r=kc(CH4),其中k为反应速率常数,设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=(4)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为
您最近一年使用:0次
【推荐2】燃煤烟气中含有大量NOx和SO2,可经处理消除。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g)⇌ 4NO(g)+CO2(g)+ 2H2O(g); ∆H1=574.0 kJ ·mol-1
CH4(g)+4NO(g)⇌ 2N2(g)+ CO2(g)+ 2H2O(g); ∆H2= 1160.0 kJ·mol-1
①反应CH4(g)+2NO2(g) ⇌N2(g)+CO2(g)+ 2H2O(g); ∆H3=_____ ;
②若该反应中将NOx还原为N2,消耗标准状况下5.6L CH4,则反应过程中转移的电子物质的量为___ ;
(2)用CH4原NO2的反应为CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向两个容积均为2L温度分别为T1°C、T2°C的恒温恒容密闭容器中分别加入物质的量为1 mol的CH4和2molNO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
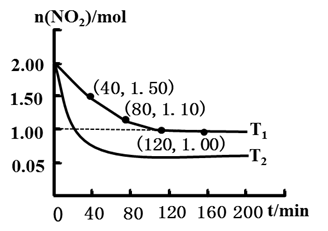
①T1_______ T2(填“>”或“<”);
②T1°C时,40~80 min,用N2的浓度变化表示的平均反应速率为v(N2)=_____ ,此温度下的化学平衡常数K=______ ;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_____ 移动(填“正向”、 “逆向”或“不”);
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)碱性混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式:__________________________ ;
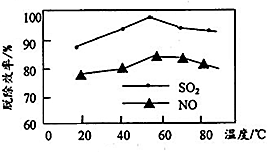
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是____________________________ ( 答出一点即可);
(4)用碱液脱硝是目前研究的课题之一。
①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液。请写出该反应的离子方程式______________________________ 。
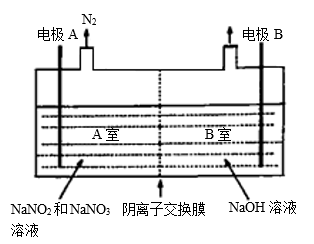
②将工业上氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到下图所示的电解槽中进行电解。写出A室NO2发生的电极反应:____________________ 。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g)⇌ 4NO(g)+CO2(g)+ 2H2O(g); ∆H1=574.0 kJ ·mol-1
CH4(g)+4NO(g)⇌ 2N2(g)+ CO2(g)+ 2H2O(g); ∆H2= 1160.0 kJ·mol-1
①反应CH4(g)+2NO2(g) ⇌N2(g)+CO2(g)+ 2H2O(g); ∆H3=
②若该反应中将NOx还原为N2,消耗标准状况下5.6L CH4,则反应过程中转移的电子物质的量为
(2)用CH4原NO2的反应为CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向两个容积均为2L温度分别为T1°C、T2°C的恒温恒容密闭容器中分别加入物质的量为1 mol的CH4和2molNO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1°C时,40~80 min,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)碱性混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式:
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是

(4)用碱液脱硝是目前研究的课题之一。
①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液。请写出该反应的离子方程式
②将工业上氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到下图所示的电解槽中进行电解。写出A室NO2发生的电极反应:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氢气是一种清洁能源,具有很大的发展潜力。
(1)氢能发展和推广目前还面临的困难有___________ 。(写出两点)
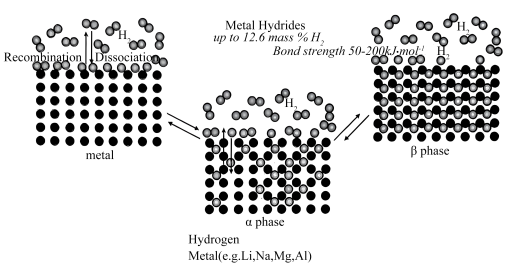
(2)储氢合金促进了氢能的推广和使用。储氢合金(M)的储氢和脱氢机理模型如图所示:
①已知:常温下α phase能自发地与H2反应生成β phase( ),反应自发进行的原因是
),反应自发进行的原因是___________ 。
②根据平衡移动原理判断,有利于储氢合金储氢后释放出氢气的条件是___________ 。(写出两点)
③文献指出,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是___________ 。
④在容积恒定的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入ag的储氢合金(M)和bmol氢气发生反应,三个容器的反应温度分别为T1、T3、T3(T1<T2<T3)且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时储氢效率(η)是 ,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是
,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是___________ ,当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是___________ 。
(3)利用有机物相互转化也可实现储氢和脱氢。乙苯与苯乙烯之间的可逆反应实现脱氢和储氢过程如图所示。
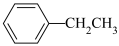 (g)
(g)
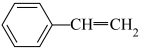 (g)+H2(g)
(g)+H2(g)
①在密闭容器中,维持体系总压恒定,在温度T℃时,物质的量为nmol、体积为VL的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为a,则在该温度下反应的平衡常数
___________ ( 为浓度平衡常数,计算结果用字母符号表示)。
为浓度平衡常数,计算结果用字母符号表示)。
②以上制氢过程也可以通过电解实现。电极使用多孔惰性电极,电解槽使用高分子电解质膜(只允许 通过)分开,则阳极发生的电极反应式为
通过)分开,则阳极发生的电极反应式为___________ 。
(1)氢能发展和推广目前还面临的困难有
(2)储氢合金促进了氢能的推广和使用。储氢合金(M)的储氢和脱氢机理模型如图所示:

①已知:常温下α phase能自发地与H2反应生成β phase(
 ),反应自发进行的原因是
),反应自发进行的原因是②根据平衡移动原理判断,有利于储氢合金储氢后释放出氢气的条件是
③文献指出,储氢合金表面氢化物的形成会阻碍储氢合金吸附新的氢气分子,若把储氢合金制成纳米颗粒,单位时间内储氢效率会大幅度提高,可能的原因是
④在容积恒定的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入ag的储氢合金(M)和bmol氢气发生反应,三个容器的反应温度分别为T1、T3、T3(T1<T2<T3)且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时储氢效率(η)是
 ,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是
,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是(3)利用有机物相互转化也可实现储氢和脱氢。乙苯与苯乙烯之间的可逆反应实现脱氢和储氢过程如图所示。
 (g)
(g)
 (g)+H2(g)
(g)+H2(g)①在密闭容器中,维持体系总压恒定,在温度T℃时,物质的量为nmol、体积为VL的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为a,则在该温度下反应的平衡常数

 为浓度平衡常数,计算结果用字母符号表示)。
为浓度平衡常数,计算结果用字母符号表示)。②以上制氢过程也可以通过电解实现。电极使用多孔惰性电极,电解槽使用高分子电解质膜(只允许
 通过)分开,则阳极发生的电极反应式为
通过)分开,则阳极发生的电极反应式为
您最近一年使用:0次







