下列说法不正确 的是
| A.增大反应物浓度,可增大单位体积内活化分子数目,从而使反应速率增大 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),不能增加活化分子的百分数 |
| C.活化分子间所发生的碰撞为有效碰撞 |
| D.升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数 |
更新时间:2024-03-03 15:47:15
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列说法中,正确的是
| A.降低温度能使化学反应速率减小,主要原因是降低了反应物分子中活化分子的百分数 |
B. 的反应均是自发进行的反应 的反应均是自发进行的反应 |
C.在恒容密闭容器中发生反应: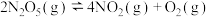 ,充入少量氩气,反应速率减小 ,充入少量氩气,反应速率减小 |
D.氢气燃烧热的热化学方程式为 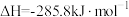 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列关于有效碰撞理论的说法一定正确的是
| A.增大压强,所有反应的有效碰撞概率增大,反应速率加快 |
| B.升高温度,所有反应的活化能增大,反应速率加快 |
| C.催化剂参与了反应,使用正催化剂,活化分子数增大,反应速率加快 |
| D.增大反应物浓度,活化分子百分数增大,反应速率加快 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】下列有关化学反应进行的方向和限度的说法中正确的是
A. ,平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动 ,平衡时若增加A的物质的量,活化分子百分数不变,单位体积内活化分子数增大,正反应速率增大,平衡正向移动 |
B. 在常温下能自发进行,则该反应的 在常温下能自发进行,则该反应的 |
C.对于反应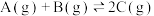 ,起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变 ,起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时若给体系加压则A的体积分数不变 |
D.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中,在恒定温度下发生分解反应: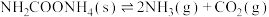 , , 的体积分数不再改变,则反应已达平衡 的体积分数不再改变,则反应已达平衡 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下图表示以太阳能为热源分解Fe3O4制H2的过程。下列有关叙述错误的是


| A.过程I是将太阳能转化为了化学能 |
| B.过程I既是分解反应,又是氧化还原反应 |
| C.过程II中每消耗72gFeO转移2mol电子 |
| D.该方法具有节约能源、产物易分离等优点 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】一定能使反应速率加快的方法是。
①升温 ②改变生成物浓度 ③增加反应物浓度 ④加压
①升温 ②改变生成物浓度 ③增加反应物浓度 ④加压
| A.①③ | B.①④ | C.①②③ | D.②③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列有关概念的说法中不正确的是
| A.增大反应物浓度可以增大单位体积内活化分子数,但活化分子百分数不变,从而使反应速率增大 |
| B.在化学反应中,能量较高、能发生碰撞的分子称为活化分子 |
| C.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可降低NO和CO反应的活化能 |
| D.溶液中的离子反应瞬间发生,其反应的活化能接近为零 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】用稀硫酸与过量锌粒反应制取氢气,欲加快化学反应速率而不改变产生氢气的量,下列措施可行的是
| A.滴加少量水 | B.改用等质量的锌片 | C.滴加少量硫酸铜溶液 | D.滴加少量浓硫酸 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】在催化剂作用下,向容积为1L 的容器中加入1molX 和3molY,发生反应 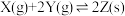 ,平衡时和反应10min 时X的转化率α (X)随温度的变化分别如曲线 I、Ⅱ所示。下列说法错误的是
,平衡时和反应10min 时X的转化率α (X)随温度的变化分别如曲线 I、Ⅱ所示。下列说法错误的是

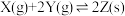 ,平衡时和反应10min 时X的转化率α (X)随温度的变化分别如曲线 I、Ⅱ所示。下列说法错误的是
,平衡时和反应10min 时X的转化率α (X)随温度的变化分别如曲线 I、Ⅱ所示。下列说法错误的是
| A.该反应ΔH 0 |
B.200℃时,前10min的平均反应速率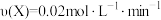 |
| C.400℃时,反应的平衡常数 K = 2 |
| D.ab 段变化可能是随温度升高反应速率加快,bc 段变化可能是催化剂在温度高于 400℃时活性降低导致 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】少量铁片与过量的l00mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②改用50mL 1mol/L HNO3溶液 ③滴入几滴浓盐酸 ④加入少量铜粉
⑤滴入几滴硫酸铜溶液 ⑥升高温度(不考虑盐酸挥发)⑦改用50mL 0.1mol/L盐酸.
①加H2O ②改用50mL 1mol/L HNO3溶液 ③滴入几滴浓盐酸 ④加入少量铜粉
⑤滴入几滴硫酸铜溶液 ⑥升高温度(不考虑盐酸挥发)⑦改用50mL 0.1mol/L盐酸.
| A.②⑥⑦ | B.③④⑤ | C.③④⑥⑦ | D.③⑤⑥ |
您最近一年使用:0次



