(1)已知一定条件下,发生反应:
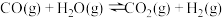
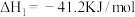
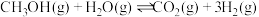
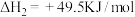
该条件下,水煤气(CO与H2的混合气体)转化成甲醇的热化学方程式是
(2)工业上使用水煤气转化成甲醇,CO的平衡转化率与温度、压强的关系如图所示:
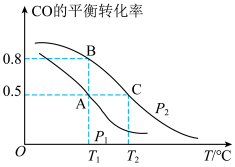
①要使A点变到B点除增大压强外还可以
②A、C两点的平衡转化率相等的原因是
③C点条件下假设压强为P2千帕,往容器内充入1molCO与2.5molH2发生反应。平衡时H2的体积分数是
(3)工业上也可以用CO2和H2合成甲醇:
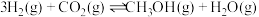
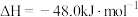 。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下。
。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下。| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 3molH2(g) 1molCO2(g) | 1molCH3OH(g) 1molH2O(g) | 2molCH3OH(g) 2molH2O(g) | |
| 平衡数据 | 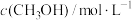 | c1 | c2 | c3 |
| 反应的能量变化/kJ | x | y | z | |
| 体系压强/Pa | p1 | p2 | p3 | |
| 反应物转化率 | a1 | a2 | a3 | |
②下列说法正确的是
A. 2c2<c3 B. z>2y,x=y C. p3<2p1 D. a1=a2
③若反应
 在四种不同情况下的反应速率分别为:
在四种不同情况下的反应速率分别为:A.
 B.
B. 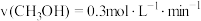
C.
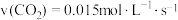 D.
D. 
该反应进行由慢到快的顺序为
相似题推荐
(1)已知:900 K时,4HCl(g)+O2(g)
 2Cl2(g)+2H2O(g),反应自发。
2Cl2(g)+2H2O(g),反应自发。①该反应是放热还是吸热,判断并说明理由
②900 K时,体积比为4:l的HCl和O2在恒温恒容的密闭容器中发生反应,HCl的平衡转化率α(HCl) 随压强(P)变化曲线如图。保持其他条件不变,升温到T K(假定反应历程不变),请画出压强在1.5×l05~4.5×105Pa范围内,HCl的平衡转化率α(HCl)随压强(P)变化曲线示意图
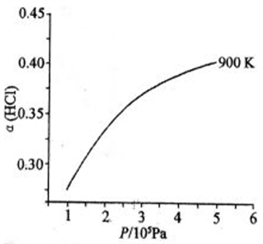
(2)已知:Cl2(g)+2NaOH(aq)==NaCl(aq)+NaClO(aq)+H2O(l) △Hl=―102 kJ·mol-1
3Cl2(g)+6NaOH(aq)==5NaCl(aq)+NaClO3(aq)+3H2O(1) △H2=―422 kJ·mol—1
①写出在溶液中NaClO分解生成NaClO3的热化学方程式
②用过量的冷NaOH溶液吸收氯气,制得NaClO溶液(不含NaClO3),此时ClO―的浓度为c0 mol·L-1;加热时NaClO转化为NaClO3,测得t时刻溶液中ClO―浓度为ct mol·L-1,写出该时刻溶液中Cl―浓度的表达式;c(Cl―)=
③有研究表明,生成NaClO3的反应分两步进行:
I、2ClO―=ClO2―+Cl―
II、ClO2―+ClO―=ClO3―+Cl―
常温下,反应II能快速进行,但氯气与NaOH溶液反应很难得到NaClO3,试用碰撞理论解释其原因:
(3)电解NaClO3水溶液可制备NaClO4。在电解过程中由于阴极上吸附氢气,会使电解电压升高,电解效率下降。为抑制氢气的产生,可选择合适的物质(不引入杂质),写出该电解的总化学方程式
(1)以
 和
和 为原料合成尿素是利用
为原料合成尿素是利用 的成功范例。在尿素合成塔中的主要反应:
的成功范例。在尿素合成塔中的主要反应:反应Ⅰ:


反应Ⅱ:


总反应Ⅲ:

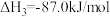
①反应Ⅰ的

②一定温度下,恒容的密闭容器中按化学计量数比投料进行反应Ⅲ,下列能说明反应Ⅲ达到化学平衡状态的是
A.容器内气体总压强不再变化B.
 与
与 的浓度相等
的浓度相等C.
 D.
D. 保持不变
保持不变(2)利用工业废气中的
 可以制取甲醇,
可以制取甲醇, ,一定条件下往1L的密闭容器中充入
,一定条件下往1L的密闭容器中充入 和
和 ,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内
,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:
①b点v(正)
②温度为
 时,该反应的平衡常数K=
时,该反应的平衡常数K=③若某温度下反应已达平衡,下列措施中有利于提高
 平衡转化率的是
平衡转化率的是A.使用高效催化剂B.不断分离出产物C.提高原料气中
 的比例D.升温
的比例D.升温(3)电解法转化
 可实现
可实现 资源化利用,电解
资源化利用,电解 制CH4的原理如图所示。铜电极上发生的电极反应式是
制CH4的原理如图所示。铜电极上发生的电极反应式是
 作为自然界丰富的“碳源”化合物,将
作为自然界丰富的“碳源”化合物,将 转化为
转化为 、
、 等燃料,不仅能缓解碳排放带来的环境问题,还将成为理想的能源补充形式。
等燃料,不仅能缓解碳排放带来的环境问题,还将成为理想的能源补充形式。(1)已知25℃和101
 时,①
时,① 的燃烧热
的燃烧热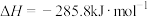 ;
;②
 的燃烧热
的燃烧热
 ;
;
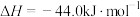 。
。则
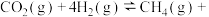
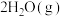

 。
。(2)控制起始时
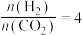 ,
, (
( 表示标准大气压),在恒容密闭容器中,发生反应[同时有副反应
表示标准大气压),在恒容密闭容器中,发生反应[同时有副反应
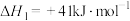 发生],平衡时各物质的物质的量分数随温度的变化如图所示:
发生],平衡时各物质的物质的量分数随温度的变化如图所示: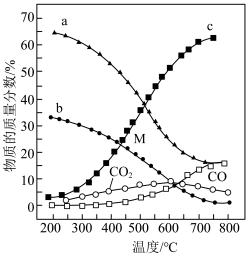
①平衡时
 的物质的量分数随温度变化的曲线为
的物质的量分数随温度变化的曲线为②温度高于500℃时,
 的物质的量分数不断增大的原因是
的物质的量分数不断增大的原因是(3)催化制氢是目前大规模制取氢气的方法之一:


 。在
。在 ℃时,将0.10
℃时,将0.10
 与0.40
与0.40
 充入5L的容器中,反应平衡后
充入5L的容器中,反应平衡后 的体积分数
的体积分数 。
。①反应平衡常数

②保持K不变,提高
 平衡转化率的措施有
平衡转化率的措施有③由
 ℃时上述实验数据计算得到
℃时上述实验数据计算得到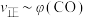 (体积分数,下同)和
(体积分数,下同)和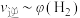 的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,表示
的关系可用如图表示。当升高到某一温度时,反应重新达到平衡,表示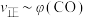 的点是
的点是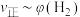 的点是
的点是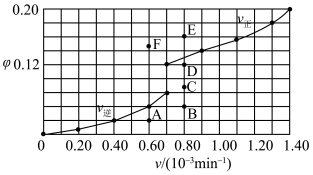
(4)近年来,生物电催化技术运用微生物电解池实现了
 的甲烷化,其工作原理如图所示。
的甲烷化,其工作原理如图所示。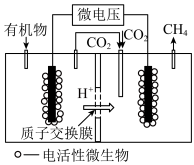
①微生物电解池实现
 甲烷化的阴极的电极反应式为
甲烷化的阴极的电极反应式为②如果处理有机物[
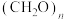 ]产生标准状况下112
]产生标准状况下112
 ,那么理论上导线中通过电子的物质的量为
,那么理论上导线中通过电子的物质的量为(1)热化学碘硫循环脱硫,涉及以下三个反应:
bunsen反应:SO2(g)+I2(g)+2H2O(l)═2HI (g)+H2SO4(l) △H
硫酸分解反应:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(l) △H=+462kJ·mol-1
碘化氢分解反应:2HI( g)=H2( g)+I2( g)△H=+10kJ·mol-1
已知氢气的燃烧热为286kJ·mol-1,则bunsen反应的△H=
(2)在活性炭催化下,SO2与Cl2发生反应:SO2(g)+Cl2(g)
 SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10 L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。
SO2Cl2(g)△H<0。在定温定压条件下,容器体积为10 L的容器中加入等物质的量的SO2和Cl2,充分混合(二者物质的量均为nmol)后,达到平衡后容器体积为8L。①SO2Cl2能与水发生非氧化还原反应,生成两种酸,则这两种酸的化学式为
②下列事实中,不能作为判断硫元素和氯元素非金属性强弱的依据是
A.硫化氢的分解温度为300℃左右,氯化氢1500℃才分解
B.氢硫酸(H2S的水溶液)是一种弱酸,盐酸是强酸
C. 将氯气通入氢硫酸中,溶液中产生黄色浑浊
D.高氯酸在无机含氧酸中酸性最强
③该 温 度下,SO2 的平衡转化率α1=
④下列措施中不能进一步提高氯气的平衡转化率的是
A.平衡后将容器的体积压缩为4L B.增大二氧化硫的浓度
C.升高温度 D.将SO2Cl2 (g )液化分离
⑤若向该容器中初始投入SO2和Cl2的物质的量均为0.5nmol,则达到平衡时SO2的平衡转化率:α2
| 时间/S | 0 | 10 | 20 | 30 | 40 | 50 |
| n(NO)/mol | 0.2 | 0.1 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)用O2表示从0~20s内该反应的速率为
(2)若升温到850℃,平衡后n(NO)= n(NO2),则该反应是
(3)若改变某一条件,达新平衡时n(NO)= 0.06 mol,下列说法正确的是
A.平衡一定正向移动
B.可能是向容器中加入了一定量的NO气体
C.可能是缩小了容器的体积
(4)假设在一定条件下0.2molNO气体与氧气反应,达到平衡时测得放出热量akJ,此时NO转化率为80%,写出在此条件下该反应的热化学方程式
(5)等温时,a、b容器开始体积相等,各充入2molNO和1molO2,平衡时NO的转化率a

(1)下图是一定温度和压强下,N2和H2反应生成1molNH3过程中能量变化示意图,则N2(g)+3H2(g)
 2NH3(g)的△H=
2NH3(g)的△H=
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应: N2(g)+3H2O(l)
 2NH3(g)+
2NH3(g)+ O2(g) △H=a kJ·mol-1为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:
O2(g) △H=a kJ·mol-1为进一步研究NH3生成量与温度的关系,测得常压下达到平衡时部分实验数据如下表:| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
此合成反应中,a
(3)某温度下,体积均为0.25L的两个恒容密闭容器中发生下列反应:N2(g)+3H2(g)
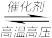 2NH3(g) △H= -92.4kJ·mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示
2NH3(g) △H= -92.4kJ·mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示| 容器 编号 | 起始时各物质的物质的量/mol | 反应达平衡时的焓变 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | 0 | △H1=-23.1 kJ·mol-1 |
| B | 0.9 | 2.7 | 0.2 | △H2 |
容器B中反应达到平衡状态时的反应热△H2=
(1)在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1mol
 (g),发生下列反应生成水煤气
(g),发生下列反应生成水煤气I.
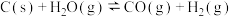
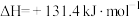
II.
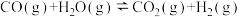
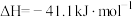
①反应I在该温度下能够自发进行的原因为
②
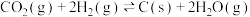

③下列说法正确的是
A.将炭块粉碎,可加快反应速率
B.平衡时向容器中充入惰性气体,反应I的平衡逆向移动
C.混合气体的密度保持不变时,说明反应体系已达到平衡
D.平衡时
 的体积分数可能大于
的体积分数可能大于
④反应平衡时,
 (g)的转化率为50%,CO的物质的量为0.1mol,此时反应II的平衡常数
(g)的转化率为50%,CO的物质的量为0.1mol,此时反应II的平衡常数
(2)一种脱除和利用水煤气中
 方法的示意图如下:
方法的示意图如下:
①某温度下,吸收塔中
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的pH=
,则该溶液的pH= 的
的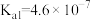 ,
,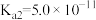 )。
)。②再生塔中产生
 的离子方程式为
的离子方程式为③利用电化学原理,将
 电催化还原为
电催化还原为 ,阴极上除发生AgCl转化为Ag的反应外,另一个反应式为
,阴极上除发生AgCl转化为Ag的反应外,另一个反应式为 制备甲醇的过程可能涉及的反应如下:
制备甲醇的过程可能涉及的反应如下:反应Ⅰ:

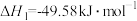
反应Ⅱ:


反应Ⅲ:
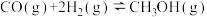
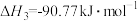
回答下列问题:
(1)反应Ⅱ的
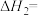
(2)恒温恒容密闭容器中,对于反应Ⅱ,下列说法中能说明该反应达到化学平衡状态的是
A. 混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.
 、
、 、
、 、
、 的物质的量之比为
的物质的量之比为
D.甲醇的百分含量不再变化
(3)对于反应Ⅰ,不同温度对
 的转化率及催化剂的效率影响如图所示,下列有关说法正确的是
的转化率及催化剂的效率影响如图所示,下列有关说法正确的是
A.其他条件不变,若不使用催化剂,则
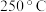 时
时 的平衡转化率可能位于
的平衡转化率可能位于
B.温度低于250℃时,随温度升高甲醇的产率减小
C.
 点时平衡常数比
点时平衡常数比 点时平衡常数大
点时平衡常数大D.实际反应应尽可能在较低的温度下进行,以提高
 的转化率
的转化率(4)若在
 密闭容器中充入
密闭容器中充入 和
和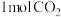 发生反应Ⅰ,250℃时反应
发生反应Ⅰ,250℃时反应 达到平衡,则
达到平衡,则
 ,平衡常数
,平衡常数
(5)甲醇燃料电池的工作原理如图所示,
 孔进入的气体是
孔进入的气体是 电极的电极反应式为
电极的电极反应式为
【推荐3】CO、CO2、CH4等含碳化合物的综合利用是当今科技的重点研究对象之一。
(1)双功能催化剂的催化作用,突破了低温下水煤气转换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]时高转化率与高反应速率不能兼得的难题。反应过程示意图如下:

下列说法正确的是
A.过程I、过程II、过程皿均为吸热反应
B.图示的三个过程都与H2O有关
C.图示的三个过程中均有极性共价键的断裂和生成
D.使用催化剂降低了整个水煤气变换反应过程的ΔH
(2)已知:
①2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746kJ·mol-1
②N2(g)+O2(g)=2NO(g) ΔH=+180kJ·mol-1
表示CO燃烧热的热化学方程式为
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2(g)=2CO2(g),向容积相同的恒容密闭容器中分别充入等物质的量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(α)如图所示。

①图中a、b、c、d、e五个点对应状态下,反应速率最慢的是
②N型催化剂条件下,从a点到e点,CO的转化率先增大,后减小,e点时突然减小的原因为
③若b点容器中c(O2)=0.4mol·L-1,则T℃时该反应的平衡常数K=
(4)在一定条件下,CH4(g)+CO2(g)=2H2(g)+2CO(g),可制得合成气H2和CO。在2L密闭容器中充入CO2和CH4,使其物质的量浓度均为0.5mol·L-1,达到平衡时CO的体积分数为X,若恒温恒容下,向平衡体系中再充入1mol CO2和1mol CH4。回答下列问题:
①化学平衡
②再次平衡时,CO的体积分数
 2NH3(g) △H=﹣92.2kJ/mol。
2NH3(g) △H=﹣92.2kJ/mol。(1)该反应的化学平衡常数表达式是K=
(2)该反应的化学平衡常数K与温度T的关系如下表所示:
T/K | 473 | 573 | 673 | … |
K | 4.4×10﹣2 | K1 | K2 | … |
(3)合成氨在农业和国防中有很重要的意义,在实际工作生成中,常采用下列措施,其中可以用勒夏特列原理解释的是
①采用较高温度(400℃~500℃) ②采用较高压强(20MPa~50MPa)
③用铁触媒加快化学反应速率 ④将生成的氨液化并及时从体系中分离出来
II.工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l) △H<0,
(1)将2molNH3和1molCO2投到一温度恒定、体积恒定的容器中进行反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
a.2v正(NH3)=v逆(CO2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO2、NH3的体积分数均不再变化
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 =x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
=x,如图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是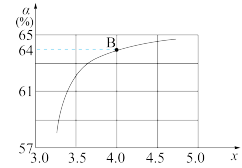
 的综合利用是实现碳中和的保证。
的综合利用是实现碳中和的保证。I.回收利用
 解决空间站供氧问题物质转化如图所示:
解决空间站供氧问题物质转化如图所示:
(1)反应A为
 ,是回收利用
,是回收利用 的关键步骤。
的关键步骤。已知:

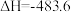 kJ⋅mol-1
kJ⋅mol-1
 kJ⋅mol-1
kJ⋅mol-1反应A的

(2)将原料气按
 置于恒容密闭容器中发生反应A,在相同时间内测得
置于恒容密闭容器中发生反应A,在相同时间内测得 的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图所示(虚线为平衡时的曲线)。
①理论上,能提高
 平衡转化率的措施有
平衡转化率的措施有a.降温
b.缩小容器体积
c.向容器中冲入Ar,增大压强
d.提高原料气中
 的比例
的比例②空间站的反应器内,通常采用反应器前段加热,后段冷却的方法来提高
 的转化效率,原因是
的转化效率,原因是(3)下列关于空间站内物质和能量变化的说法中,不正确的是
a.反应B的主要能量变化是“电能→化学能”或“光能→化学能”
b.物质转化中O、H原子的利用率均为100%
c.不用
 作供氧剂的原因可能是
作供氧剂的原因可能是 不易实现循环利用
不易实现循环利用(4)用
 代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是
代替反应A,可实现氢、氧元素完全循环利用,缺点是一段时间后催化剂的催化效果会明显下降,其原因是II.利用
 生产乙烯:
生产乙烯: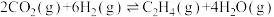
 ;在三个容积均为1 L的密闭容器中以不同的氢碳比
;在三个容积均为1 L的密闭容器中以不同的氢碳比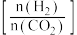 充入
充入 和
和 ,在一定条件下
,在一定条件下 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。
(5)下列说法正确的是
a.该反应的

b.氢碳比:①>②
c.在氢碳比为2.0时,Q点:
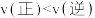
(6)若起始时,
 、
、 浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则
浓度分别为0.5 mol⋅L-1和1.0 mol⋅L-1,则(1)丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯丙烷、异丙醇等产品。
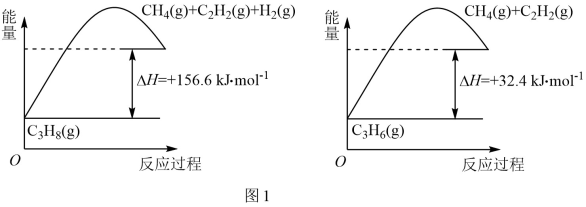
①丙烷脱氢制备丙烯。由图可得C3H8(g)
 C3H6(g)+H2(g) ∆H=
C3H6(g)+H2(g) ∆H=②目前在丙烷脱氢制丙烯时常通入适量的O2,让其同时发生下列反应:2C3H8(g)+O2(g)
 2C3H6(g)+2H2O(g) ∆H=-235kJ/ mol,通入O2的作用是
2C3H6(g)+2H2O(g) ∆H=-235kJ/ mol,通入O2的作用是(2)乙苯催化脱氢制取苯乙烯的反应为:
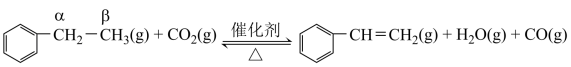
其反应历程如下:

①关于该反应,下列说法正确的是
A.苯环α位的碳氢键键能小于苯环β位的碳氢键键能
B.催化剂可通过吸附作用,拉近反应物之间的距离,从而增加有效碰撞的概率
C.催化剂的作用是提供反应界面,但不参与化学反应过程。
D.增加催化剂用量可提高反应的平衡转化率
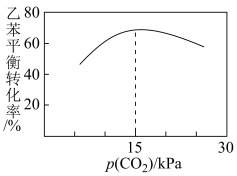
②在相同时间内乙苯的转化率与p(CO2)的关系如图所示,乙苯转化率随着p(CO2)变化的原因是
(3)工业上可用丙烯加成法制备1,2-二氯丙烷(CH2ClCHClCH3),主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g)
 CH2ClCHClCH3(g)
CH2ClCHClCH3(g)II.CH2=CHCH3(g)+Cl2(g)
 CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应,容器内气体的压强随时间的变化如表所示。
| 时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
| 压强/kPa | 80 | 74.2 | 69.2 | 65.2 | 61.6 | 60.0 | 60.0 |
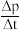 ,则前120min内平均反应速率v(CH2ClCHClCH3)=
,则前120min内平均反应速率v(CH2ClCHClCH3)=②该温度下,若平衡时HCl的体积分数为12.5%,反应I的平衡常数Kp=



