2SO2(g)+O2(g) 2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:

(1)a=_____ kJ•mol-1.
(2)该反应常用V2O5作催化剂使图中ΔH_____ (填“升高”“降低”或“不变”)。
(3)已知单质硫的燃烧热为296kJ•mol-1,写出反应的热化学方程式:_____ 。
(4)工业上用H2和Cl2反应制HCl,各键能数据为:H—H:436kJ/mol,Cl—Cl:243kJ/mol,H—Cl:431kJ/mol。该反应的热化学方程式是_____ 。
(5)已知:①C(s)+O2(g)=CO2(g) ΔH=ΔH1;②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_____ 。(列出关于ΔH1、ΔH2、ΔH3的表达式)
 2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
2SO3(g) ΔH=akJ•mol-1,反应过程的能量变化如图所示。已知1molSO2(g)完全转化为1molSO3(g)放热99kJ。请回答:
(1)a=
(2)该反应常用V2O5作催化剂使图中ΔH
(3)已知单质硫的燃烧热为296kJ•mol-1,写出反应的热化学方程式:
(4)工业上用H2和Cl2反应制HCl,各键能数据为:H—H:436kJ/mol,Cl—Cl:243kJ/mol,H—Cl:431kJ/mol。该反应的热化学方程式是
(5)已知:①C(s)+O2(g)=CO2(g) ΔH=ΔH1;②2CO(g)+O2(g)=2CO2(g) ΔH=ΔH2;③TiO2(g)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=ΔH3;则TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
更新时间:2024-03-20 22:50:52
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】碳和氯元素及其化合物与人类的生产、生活密切相关。
(1)①一定条件下,氯气与氨气反应可以制备氯胺(NH2C1),已知部分化学键的键能:
则上述反应的热化学方程式为:____________ 。
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为______________ :
Ⅱ、碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(2)在三个容积均为1L的密闭容器中以不同的氢碳比 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
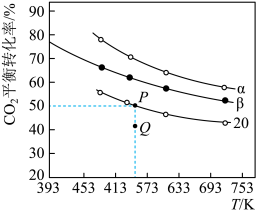
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
①反应的△H_____ 0,氢碳比α____ β,Q点v(正)_____ v(逆)(填“大于”或“小于”)
②若起始时,CO2的浓度为0.5mol·L-1;则P点对应温度的平衡常数的值为_______ 。
(3)已知:碳酸H2CO3,K1=4.3×10-7、K2=5.6×10-11、草酸H2C2O4,K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是_______ (填字母)。
a. 、
、 b.H2CO3、
b.H2CO3、 c.
c.  、
、 d.H2C2O4、
d.H2C2O4、
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是_________ 。
③通过技术判断中和反应2Fe(OH)3(s)+3H2C2O4 2Fe3++6H2O+3
2Fe3++6H2O+3 在常温下能否发生反应
在常温下能否发生反应________ 。(已知:Ksp[Fe(OH)3]=1.0×10-39;66=4.67×104)
(1)①一定条件下,氯气与氨气反应可以制备氯胺(NH2C1),已知部分化学键的键能:
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
则上述反应的热化学方程式为:
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
Ⅱ、碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。
(2)在三个容积均为1L的密闭容器中以不同的氢碳比
 充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g)
充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g)+4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(α、β、2.0分别代表三种氢碳比时的变化曲线)。请回答下列问题:
①反应的△H
②若起始时,CO2的浓度为0.5mol·L-1;则P点对应温度的平衡常数的值为
(3)已知:碳酸H2CO3,K1=4.3×10-7、K2=5.6×10-11、草酸H2C2O4,K1=6.0×10-2、K2=6.0×10-5
①下列微粒可以大量共存的是
a.
 、
、 b.H2CO3、
b.H2CO3、 c.
c.  、
、 d.H2C2O4、
d.H2C2O4、
②若将等物质的量浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子(除OH-外)浓度由大到小的顺序是
③通过技术判断中和反应2Fe(OH)3(s)+3H2C2O4
 2Fe3++6H2O+3
2Fe3++6H2O+3 在常温下能否发生反应
在常温下能否发生反应
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】人们常常利用化学反应中的能量变化为人类服务
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。氢气燃烧生成水蒸气的能量变化如下图所示:
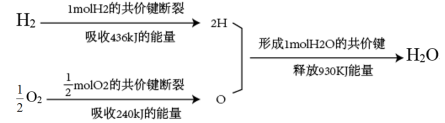
根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着_______ 变化, 完全燃烧生成1mol水蒸气时,释放的能量是
完全燃烧生成1mol水蒸气时,释放的能量是_______ kJ。
(2)下列化学反应在理论上可以设计成原电池的是_______ 。
a.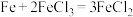 b.
b.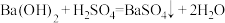
c. d.
d.
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录如下:
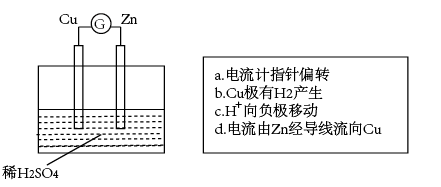
①实验报告中记录合理的是_______ (填序号)。
②负极材料为_______ ,该电极反应式为_______ 。
③若有1mol电子流过导线,则理论上产生H2的质量为_____ g。
④将稀H2SO4换成CuSO4溶液,电极质量增加的是_____ (填“锌极”或“铜极”),其原因为___ (用电极反应式表示)。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。氢气燃烧生成水蒸气的能量变化如下图所示:

根据上图可知,在化学反应中,不仅存在物质的变化,而且伴随着
 完全燃烧生成1mol水蒸气时,释放的能量是
完全燃烧生成1mol水蒸气时,释放的能量是(2)下列化学反应在理论上可以设计成原电池的是
a.
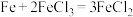 b.
b.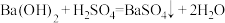
c.
 d.
d.
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录如下:

①实验报告中记录合理的是
②负极材料为
③若有1mol电子流过导线,则理论上产生H2的质量为
④将稀H2SO4换成CuSO4溶液,电极质量增加的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】I、依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为________________________ 。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为______________ 。
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为________ 。
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH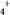 +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O
(1)X是电池的________ (填“正”或“负”,下同)极,Y是电池的________ 极。
(2)该电池总反应的离子方程式为:_______________________ 。
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为________ 。
(1)在25 ℃、101 kPa下,1 g甲烷燃烧生成CO2和液态水时放热55.625 kJ。则表示甲烷燃烧热的热化学方程式为
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,则表示该反应的热化学方程式为
(3)在25 ℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(1)的燃烧热分别为393.5 kJ/mol、285.8 kJ/mol、870.3 kJ/mol,则2C(s)+2H2(g)+O2(g)===CH3COOH(1)的反应热ΔH为
II、锌锰干电池是应用最普遍的电池之一。其基本反应为:
X极:Zn-2e-===Zn2+
Y极:2MnO2+2NH
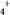 +2e-===Mn2O3+2NH3+H2O
+2e-===Mn2O3+2NH3+H2O(1)X是电池的
(2)该电池总反应的离子方程式为:
(3)若反应消耗16.25gZn,则电池中转移电子的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁氧化合物循环分解水制
已知: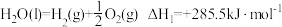
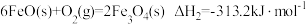
则: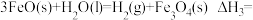
_______
(2)甲烷是重要的资源。 与
与 重整的主要反应的热化学方程式为
重整的主要反应的热化学方程式为
反应Ⅰ: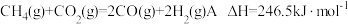
反应Ⅱ: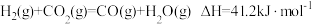
则: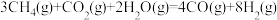 的
的
_______ 。
(3)肼 是一种应用广泛的化工原料。发射火箭时用肼为燃料,
是一种应用广泛的化工原料。发射火箭时用肼为燃料,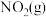 作氧化剂,两者反应生成氮气和气态水。已知
作氧化剂,两者反应生成氮气和气态水。已知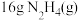 在上述反应中放出
在上述反应中放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式_______ 。
(1)铁氧化合物循环分解水制

已知:
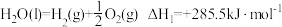
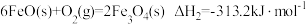
则:
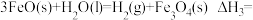
(2)甲烷是重要的资源。
 与
与 重整的主要反应的热化学方程式为
重整的主要反应的热化学方程式为反应Ⅰ:
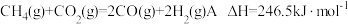
反应Ⅱ:
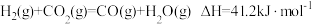
则:
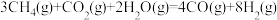 的
的
(3)肼
 是一种应用广泛的化工原料。发射火箭时用肼为燃料,
是一种应用广泛的化工原料。发射火箭时用肼为燃料,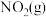 作氧化剂,两者反应生成氮气和气态水。已知
作氧化剂,两者反应生成氮气和气态水。已知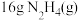 在上述反应中放出
在上述反应中放出 的热量,写出该反应的热化学方程式
的热量,写出该反应的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
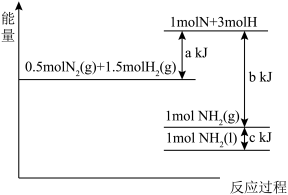
【推荐2】I、根据能量变化示意图,请写出氮气和氢气合成液态 的氨气的热化学方程式_____ ;
Ⅱ、已知:NO2(g)+ SO2(g) SO3(l)+ NO(g)ΔH=-51.5kJ·mol-1
SO3(l)+ NO(g)ΔH=-51.5kJ·mol-1
若在一定条件下,将 NO2与 SO2以体积比 1:2 置于恒容密闭容器 中发生上述反应,
①下列能说明反应达到平衡状态的是_____ 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和 NO 的物质的量之比保持不变 d.每消耗 1 mol SO3的同时生成 1 molNO2
e.容器内气体密度不变
②恒容密闭容器中发生上述反应时,若加入 Ar 气,反 应速率_____ (变大、变小或不变)。

Ⅱ、已知:NO2(g)+ SO2(g)
 SO3(l)+ NO(g)ΔH=-51.5kJ·mol-1
SO3(l)+ NO(g)ΔH=-51.5kJ·mol-1若在一定条件下,将 NO2与 SO2以体积比 1:2 置于恒容密闭容器 中发生上述反应,
①下列能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和 NO 的物质的量之比保持不变 d.每消耗 1 mol SO3的同时生成 1 molNO2
e.容器内气体密度不变
②恒容密闭容器中发生上述反应时,若加入 Ar 气,反 应速率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某氮肥厂氨氮废水中的氮元素多以NH3•H2O和 的形式存在,该废水的处理流程如下:
的形式存在,该废水的处理流程如下:
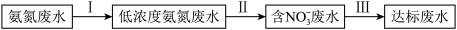
(1)步骤I的操作如下:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。NH3•H2O的分解反应属于___________ (填“吸热”或“放热”)反应。
(2)步骤II:在微生物作用下, 经过连续两步反应被氧化成
经过连续两步反应被氧化成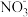 两步反应的能量变化示意图如下:
两步反应的能量变化示意图如下:
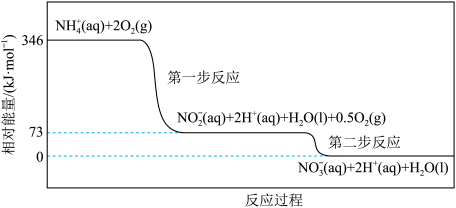
两步反应的反应热分别记为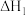 、
、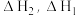
___________ 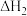 ,(填“>”或“<”);第一步反应是
,(填“>”或“<”);第一步反应是___________ (填“放热”或“吸热”)反应,热化学方程式是___________ 。
(3)步骤III:—定条件下,向废水中加入CH3OH,将HNO3还原成N2,该反应的 ,由此判断氧化还原反应一定是放热反应,对吗?
,由此判断氧化还原反应一定是放热反应,对吗?___________ (填“对”或“不对”),请举例说明理由:___________ 。
 的形式存在,该废水的处理流程如下:
的形式存在,该废水的处理流程如下: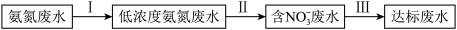
(1)步骤I的操作如下:加NaOH溶液,调节pH至9后,升温至30℃,通空气将氨赶出并回收。NH3•H2O的分解反应属于
(2)步骤II:在微生物作用下,
 经过连续两步反应被氧化成
经过连续两步反应被氧化成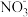 两步反应的能量变化示意图如下:
两步反应的能量变化示意图如下:
两步反应的反应热分别记为
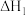 、
、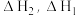
 ,(填“>”或“<”);第一步反应是
,(填“>”或“<”);第一步反应是(3)步骤III:—定条件下,向废水中加入CH3OH,将HNO3还原成N2,该反应的
 ,由此判断氧化还原反应一定是放热反应,对吗?
,由此判断氧化还原反应一定是放热反应,对吗?
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
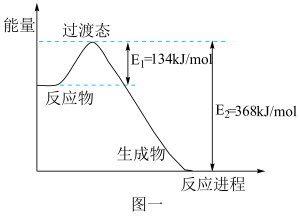
(1)图一是NO2和CO反应生成CO2和NO 过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:________ 。在反应体系中加入适宜的催化剂(正催化剂),E1和E2的变化是:E1_______ ,E2_____ (填“增大”、“减小”或“不变”),对反应热有无影响?________ ,原因是_______ 。
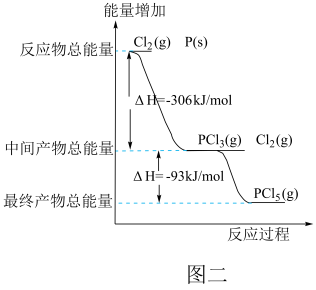
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
①PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式_______ 。
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______ △H1(填“大于”、“小于”或“等于”)。
(1)图一是NO2和CO反应生成CO2和NO 过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:


(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
①PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
您最近一年使用:0次
【推荐2】铁及其化合物用途非常广泛。
(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1
(b) Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1
(c) Fe3O4(s)+CO(g) 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1
①上述反应(a)平衡常数表达式为K=___________________ 。
②反应FeO(s)+CO(g) Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =__________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是__________________________________ ;电解时阳极发生的电极反应为____________ 。
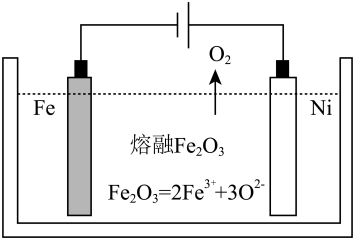
(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为_________ ;如图所示,纯铁处于a、b、c三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填字母)_____________ 。

(1)已知赤铁矿还原冶炼时是逐级进行的,已知:
(a) 3Fe2O3(s)+CO(g)
 2Fe3O4(s)+CO2(g)
2Fe3O4(s)+CO2(g)  H = a kJ·mol-1
H = a kJ·mol-1(b) Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)  H =b kJ·mol-1
H =b kJ·mol-1(c) Fe3O4(s)+CO(g)
 3FeO(s)+CO2 (g)
3FeO(s)+CO2 (g)  H = c kJ·mol-1
H = c kJ·mol-1①上述反应(a)平衡常数表达式为K=
②反应FeO(s)+CO(g)
 Fe(s)+CO2(g)
Fe(s)+CO2(g)  H =
H =(2)用类似冶炼铝的方法, 在600~1000℃时电解熔融的Fe2O3冶炼铁(装置示意图如图),该法除消耗能量较少外,另一最突出的优点是

(3)生铁在自然界中可发生析氢腐蚀和吸氧腐蚀,析氢腐蚀的负极的电极反应式为

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】我国首创以铝组成的金属—海水—空气电池作为新型海水标志灯的能源,它以海水为电解质溶液,靠空气中的氧气使铝组成的金属不断氧化而产生电流。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为__________ ;
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的__________ 极,该电极反应式为__________ ;
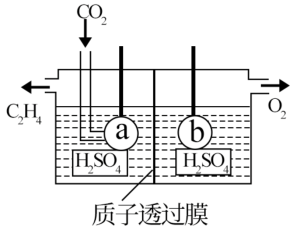
(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为__________ ;
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为__________ ;
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+ ,写出正极反应式
,写出正极反应式__________ 。
(1)只要把灯放入海水中数分钟,就会发出耀眼的白光,则该电池的负极反应式为
(2)电解法可制取碳的一种气态氢化物C2H4(如图所示)电极a接电源的

(3)将SO2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体NO,有关反应的离子方程式为
(4)处理NOx的一种方法是利用甲烷催化还原NOx,
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)ΔH=-574kJ•mol-1;
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)ΔH=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为
(5)H2O2在工业、农业、医药上都有广泛的用途。用碱性氢氧燃料电池可合成H2O2,具有效率高、无污染等特点。电池总反应式为H2+O2+OH-=H2O+
 ,写出正极反应式
,写出正极反应式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
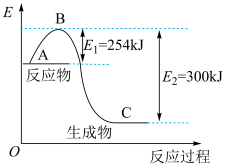
【推荐1】(1)如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:_____ 。

(2)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和____ (填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量____ (填“大于”、“小于”或“等于”)572kJ。
(3)已知拆开1molN﹣N键、1molN﹣H键、1molN≡N键、O=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1mol火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1molH2O(g)完全断键时共吸收____ kJ的能量。
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,反应物的总键能_____ (填“大于”、“小于”或“等于”)生成物的总键能。


(2)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)═2H2O(l)。请回答下列问题:
①该反应的生成物能量总和
②若2mol氢气完全燃烧生成水蒸气,则放出的热量
(3)已知拆开1molN﹣N键、1molN﹣H键、1molN≡N键、O=O键需要的能量分别是3akJ、2.5akJ、8akJ、4akJ,完全燃烧1mol火箭燃料肼(N2H4)生成氮气和水蒸气放出能量为5akJ,则1molH2O(g)完全断键时共吸收
(4)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,反应物的总键能

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】填空
(1)已知: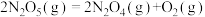
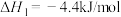

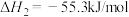
则反应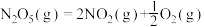

_______ kJ/mol。
(2)已知相关的化学键键能数据如下:
则

_______ kJ/mol。
(3)下图是 和
和 反应生成
反应生成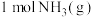 过程中能量变化示意图,合成氨反应的热化学方程式为
过程中能量变化示意图,合成氨反应的热化学方程式为_______ 。
(4)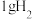 燃烧生成
燃烧生成 放热121 kJ,
放热121 kJ, 蒸发吸热44 kJ,
蒸发吸热44 kJ, 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(5)①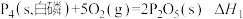
②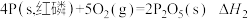
常温时红磷比白磷稳定,则
_______  (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
(1)已知:
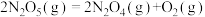
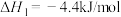

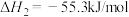
则反应
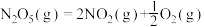

(2)已知相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | 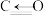 |
键能/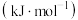 | 413 | 745 | 436 | 1075 |


(3)下图是
 和
和 反应生成
反应生成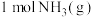 过程中能量变化示意图,合成氨反应的热化学方程式为
过程中能量变化示意图,合成氨反应的热化学方程式为
(4)
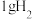 燃烧生成
燃烧生成 放热121 kJ,
放热121 kJ, 蒸发吸热44 kJ,
蒸发吸热44 kJ, 燃烧热的热化学方程式为
燃烧热的热化学方程式为(5)①
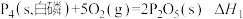
②
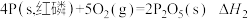
常温时红磷比白磷稳定,则

 (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
您最近一年使用:0次

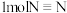 键分别需要吸收能量436 kJ。391 kJ、946 kJ,则合成氨反应的热化学方程式为
键分别需要吸收能量436 kJ。391 kJ、946 kJ,则合成氨反应的热化学方程式为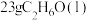 和一定量的氧气混合点燃,恰好完全反应,生成27 g液态水和
和一定量的氧气混合点燃,恰好完全反应,生成27 g液态水和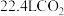 (标准状况),并放出683.5 kJ的热量,该反应的热化学方程式为
(标准状况),并放出683.5 kJ的热量,该反应的热化学方程式为

