以石膏矿(主要含2CaSO4•H2O,还含有少量Al2O3、Fe2O3、SiO2)为原料制取CaCl2溶液和(NH4)2SO4晶体,一种工艺流程如下:
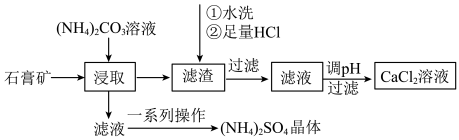
(1)浸取前将石膏矿粉碎,其目的是___________ 。
(2)“浸取”时,发生反应:CaSO4(s)+CO (aq)
(aq) CaCO3(s)+SO
CaCO3(s)+SO (aq)。达到平衡时,溶液中
(aq)。达到平衡时,溶液中 =
=___________ 。[已知:Ksp(CaSO4)=4.8×10-5,Ksp(CaCO3)=3×10-9]
(3)将氨水和NH4HCO3溶液混合,可得到(NH4)2CO3溶液,其化学方程式为___________ ,浸取时控制反应温度在60~70℃,控温方法是___________ 。
(4)“滤渣”的主要成分是Al2O3、Fe2O3、___________ ;“一系列操作”为:加入适量稀硫酸,然后经过减压蒸发浓缩、___________ 、过滤、洗涤、干燥。
(5)已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
则“调pH”中需要调节的pH范围___________ 。

(1)浸取前将石膏矿粉碎,其目的是
(2)“浸取”时,发生反应:CaSO4(s)+CO
 (aq)
(aq) CaCO3(s)+SO
CaCO3(s)+SO (aq)。达到平衡时,溶液中
(aq)。达到平衡时,溶液中 =
=(3)将氨水和NH4HCO3溶液混合,可得到(NH4)2CO3溶液,其化学方程式为
(4)“滤渣”的主要成分是Al2O3、Fe2O3、
(5)已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe3+ | Al3+ | Ca2+ |
| 开始沉淀的pH | 1.8 | 3.4 | 11.3 |
| 沉淀完全的pH | 3.2 | 4.8 | … |
| pH=8.3时,Al(OH)3开始溶解 | |||
更新时间:2024-03-28 09:48:21
|
相似题推荐
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐1】高铁酸钾( )是一种暗紫色固体,在低温碱性条件下比较稳定,微溶于KOH浓溶液。工业上湿法制备
)是一种暗紫色固体,在低温碱性条件下比较稳定,微溶于KOH浓溶液。工业上湿法制备 的流程如图:
的流程如图:
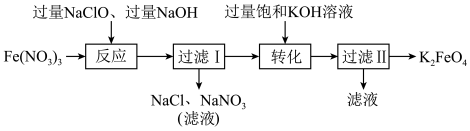
(1)基态Fe原子的价层电子的运动状态有_______ 种。
(2)请比较工业上湿法制备 的条件下
的条件下 和
和 的溶解度大小:
的溶解度大小:
_______ (填“>”、“<”或“=”) 。
。
(3)将 粗品[含有
粗品[含有 、NaCl等杂质]转化为
、NaCl等杂质]转化为 的实验方案为:
的实验方案为:
a.在不断搅拌下,将 粗品溶于冷的3
粗品溶于冷的3  KOH溶液中,快速过滤除去
KOH溶液中,快速过滤除去 等难溶的物质。
等难溶的物质。
b.将滤液置于_______ 中,向滤液中加入_______ ,过滤。
c.对产品进行洗涤时使用乙醇,其目的是_______ (答两点)。
(4)测定高铁酸钾样品的纯度:
①称取0.5000 g高铁酸钾样品,完全溶解于KOH浓溶液中,再加入足量亚铬酸钾{ }反应后配成100.00 mL溶液。
}反应后配成100.00 mL溶液。
②取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至 ,用0.1000
,用0.1000  的硫酸亚铁铵
的硫酸亚铁铵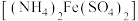 滴定,消耗标准硫酸亚铁铵溶液12.00 mL。
滴定,消耗标准硫酸亚铁铵溶液12.00 mL。
已知测定过程中发生如下反应: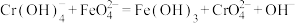 ,
,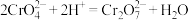 ,
, 。计算样品中
。计算样品中 的质量分数:
的质量分数:_______ 。
(5)高铁酸盐具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨、重金属等。 的浓度与pH关系如图1所示;用
的浓度与pH关系如图1所示;用 除去某氨氮(
除去某氨氮(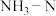 )废水,氨氮去除率与pH关系如图2所示;用
)废水,氨氮去除率与pH关系如图2所示;用 处理
处理 浓度为0.12
浓度为0.12  的含锌废水{
的含锌废水{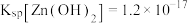 },锌残留量与pH关系如图3所示。[已知:
},锌残留量与pH关系如图3所示。[已知: 与
与 反应生成
反应生成 的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀]
的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀]

①图2中,pH越大氨氮的去除率越大,其原因可能是_______ 。
②图3中, 时锌的去除率比
时锌的去除率比 时大得多,其原因是
时大得多,其原因是_______ 。(从锌元素的存在形态角度说明)
 )是一种暗紫色固体,在低温碱性条件下比较稳定,微溶于KOH浓溶液。工业上湿法制备
)是一种暗紫色固体,在低温碱性条件下比较稳定,微溶于KOH浓溶液。工业上湿法制备 的流程如图:
的流程如图:
(1)基态Fe原子的价层电子的运动状态有
(2)请比较工业上湿法制备
 的条件下
的条件下 和
和 的溶解度大小:
的溶解度大小:
 。
。(3)将
 粗品[含有
粗品[含有 、NaCl等杂质]转化为
、NaCl等杂质]转化为 的实验方案为:
的实验方案为:a.在不断搅拌下,将
 粗品溶于冷的3
粗品溶于冷的3  KOH溶液中,快速过滤除去
KOH溶液中,快速过滤除去 等难溶的物质。
等难溶的物质。b.将滤液置于
c.对产品进行洗涤时使用乙醇,其目的是
(4)测定高铁酸钾样品的纯度:
①称取0.5000 g高铁酸钾样品,完全溶解于KOH浓溶液中,再加入足量亚铬酸钾{
 }反应后配成100.00 mL溶液。
}反应后配成100.00 mL溶液。②取上述溶液20.00 mL于锥形瓶中,加入稀硫酸调至
 ,用0.1000
,用0.1000  的硫酸亚铁铵
的硫酸亚铁铵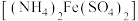 滴定,消耗标准硫酸亚铁铵溶液12.00 mL。
滴定,消耗标准硫酸亚铁铵溶液12.00 mL。已知测定过程中发生如下反应:
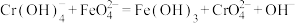 ,
,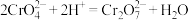 ,
, 。计算样品中
。计算样品中 的质量分数:
的质量分数:(5)高铁酸盐具有强氧化性,溶液pH越小氧化性越强,可用于除去废水中的氨、重金属等。
 的浓度与pH关系如图1所示;用
的浓度与pH关系如图1所示;用 除去某氨氮(
除去某氨氮( )废水,氨氮去除率与pH关系如图2所示;用
)废水,氨氮去除率与pH关系如图2所示;用 处理
处理 浓度为0.12
浓度为0.12  的含锌废水{
的含锌废水{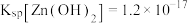 },锌残留量与pH关系如图3所示。[已知:
},锌残留量与pH关系如图3所示。[已知: 与
与 反应生成
反应生成 的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀]
的过程中,可以捕集某些难溶金属的氢氧化物形成共沉淀]
①图2中,pH越大氨氮的去除率越大,其原因可能是
②图3中,
 时锌的去除率比
时锌的去除率比 时大得多,其原因是
时大得多,其原因是
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】二氧化钛和三氧化钨(TiO2/WO3)纳米异质结薄膜广泛应用于光催化、光电催化和传感器等领域。从废弃薄膜中回收钛和钨等稀缺金属既有利于资源综合利用又避免污染环境,以下是TiO2/WO3纳米异质结薄膜回收的工艺流程:

已知:I.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2,呈碱性,与酸发生反应:CH3CH2NH2+H =
= 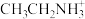
Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2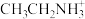 +
+
 (CH3CH2NH3)2WO4
(CH3CH2NH3)2WO4
Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2,室温时,Ksp[TiO(OH)2]=1.0×10−27。
回答下列问题:
(1)“碱浸”时需要不断搅拌的原因___________ 。
(2)“萃取”前,需要将“滤液I”的pH调整到3.5左右,目的是________ 。
(3)“反萃取”步骤中,加入的试剂a最佳是________ (填标号)。
A.NaOH溶液 B.氨水 C.NH4Cl溶液
(4)写出“酸煮”步骤的化学反应方程式___________ 。
(5)在制TiO2 “水煮”时加水并加热的目的是___________ 。
(6)检验“过滤Ⅲ”所得H2TiO3是否洗涤干净的方法是___________ 。
(7)室温下测得“滤液Ⅲ”的pH=2,则此时滤液中c(TiO2+)为___________ 。

已知:I.乙胺是无色极易挥发的液体,结构简式为CH3CH2NH2,呈碱性,与酸发生反应:CH3CH2NH2+H
 =
= 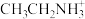
Ⅱ.酸性条件下,Na2WO4与乙胺“萃取”发生反应:2
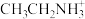 +
+
 (CH3CH2NH3)2WO4
(CH3CH2NH3)2WO4Ⅲ.TiOSO4易溶于水,属于强电解质;偏钛酸难溶于水,其化学式可表示为H2TiO3或TiO(OH)2,室温时,Ksp[TiO(OH)2]=1.0×10−27。
回答下列问题:
(1)“碱浸”时需要不断搅拌的原因
(2)“萃取”前,需要将“滤液I”的pH调整到3.5左右,目的是
(3)“反萃取”步骤中,加入的试剂a最佳是
A.NaOH溶液 B.氨水 C.NH4Cl溶液
(4)写出“酸煮”步骤的化学反应方程式
(5)在制TiO2 “水煮”时加水并加热的目的是
(6)检验“过滤Ⅲ”所得H2TiO3是否洗涤干净的方法是
(7)室温下测得“滤液Ⅲ”的pH=2,则此时滤液中c(TiO2+)为
您最近半年使用:0次
【推荐3】工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为:CrO
 Cr2O
Cr2O
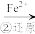 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
(1)流程第①步存在平衡:2 CrO +2H+⇌ Cr2O
+2H+⇌ Cr2O +H2O,能说明第①步反应达平衡状态的是
+H2O,能说明第①步反应达平衡状态的是_____ 。(填序号)
A.Cr2O 和CrO
和CrO 的浓度相同 B.2v Cr2O
的浓度相同 B.2v Cr2O =v CrO
=v CrO C.溶液的颜色不变
C.溶液的颜色不变
(2)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)。常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为_____ 。
方法2:电解法
该法用Fe做电极电解含Cr2O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释下列原因:
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释下列原因:
(3)用Fe做电极的原因是_____ ,在阴极附近溶液pH升高的原因是_____ 。
 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。方法1:还原沉淀法。该法的工艺流程为:CrO

 Cr2O
Cr2O
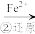 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓(1)流程第①步存在平衡:2 CrO
 +2H+⇌ Cr2O
+2H+⇌ Cr2O +H2O,能说明第①步反应达平衡状态的是
+H2O,能说明第①步反应达平衡状态的是A.Cr2O
 和CrO
和CrO 的浓度相同 B.2v Cr2O
的浓度相同 B.2v Cr2O =v CrO
=v CrO C.溶液的颜色不变
C.溶液的颜色不变(2)流程第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)。常温下Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L时溶液的pH为
方法2:电解法
该法用Fe做电极电解含Cr2O
 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释下列原因:
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。请用电极反应方程式解释下列原因:(3)用Fe做电极的原因是
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐1】为回收利用废镍催化剂 主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等
主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等 ,科研人员研制了一种回收镍的新工艺。工艺流程如图所示:
,科研人员研制了一种回收镍的新工艺。工艺流程如图所示:

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
常温下,Ksp(CaF2) =2.7×10-11。请回答下列问题:
(1)加快酸浸速率的常用措施有______________  任写一条即可得分。
任写一条即可得分。
(2)“浸出渣”主要成分为CaSO4·2H2O和______ 两种物质。
(3)“操作B”的过程是:先在40~50℃加入H2O2,其作用是_______________ (用离子方程式表示);再调pH至___________ ,其目的是______________ 。
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol/L,则溶液中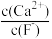 =
= _______ 。
 主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等
主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等 ,科研人员研制了一种回收镍的新工艺。工艺流程如图所示:
,科研人员研制了一种回收镍的新工艺。工艺流程如图所示:
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(1)加快酸浸速率的常用措施有
 任写一条即可得分。
任写一条即可得分。(2)“浸出渣”主要成分为CaSO4·2H2O和
(3)“操作B”的过程是:先在40~50℃加入H2O2,其作用是
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol/L,则溶液中
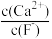 =
=
您最近半年使用:0次
【推荐2】I.某固体混合物可能由KNO3、K2SO4、KCl、CuCl2和Na2CO3中的一种或几种组成,依次进行如下实验,观察到的实验现象记录如下:
i.混合物加水得到无色溶液;
ii.向上述溶液中滴加过量BaCl2溶液,有白色沉淀生成,将该沉淀滤出,此沉淀可完全溶于稀HNO3;
iii.向ii的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
(1)据此,可判断出混合物中肯定会有_____ ,肯定没有______ ,可能含有_____ 。
(2)写出步骤ii中涉及的相关反应的方程式:_______ 。
II.
(3)某溶液中含有较大量的Cl-、OH-、 等三种离子,如果只取一次该溶液就能够将三种离子依次检验出来,操作步骤正确的顺序为
等三种离子,如果只取一次该溶液就能够将三种离子依次检验出来,操作步骤正确的顺序为_______ 。
①滴加过量Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④加Ba(NO3)2溶液
i.混合物加水得到无色溶液;
ii.向上述溶液中滴加过量BaCl2溶液,有白色沉淀生成,将该沉淀滤出,此沉淀可完全溶于稀HNO3;
iii.向ii的滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
(1)据此,可判断出混合物中肯定会有
(2)写出步骤ii中涉及的相关反应的方程式:
II.
(3)某溶液中含有较大量的Cl-、OH-、
 等三种离子,如果只取一次该溶液就能够将三种离子依次检验出来,操作步骤正确的顺序为
等三种离子,如果只取一次该溶液就能够将三种离子依次检验出来,操作步骤正确的顺序为①滴加过量Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④加Ba(NO3)2溶液
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】某同学设计如下实验方案,以分离NaCl和BaCl2两种固体混合物,回答下列问题:
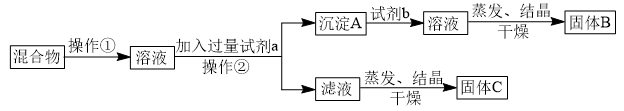
供选试剂:Na2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是___________ 。
(2)试剂a是___________ (填化学式,下同),试剂b是___________ ,固体B是___________ 。
(3)加入试剂a所发生的化学反应方程式为________________________ 。
(4)该方案能否达到实验目的?___________ (填“能”或“不能”)。若不能,应如何改进(若能,此问不用回答)________________________ 。

供选试剂:Na2CO3溶液、Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是
(2)试剂a是
(3)加入试剂a所发生的化学反应方程式为
(4)该方案能否达到实验目的?
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】工业上常利用含硫废水生产 ,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
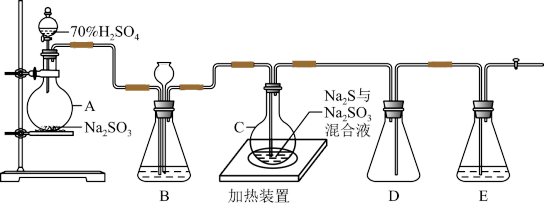
烧瓶C中发生反应如下:
 (Ⅰ)
(Ⅰ)
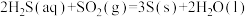 (Ⅱ)
(Ⅱ)
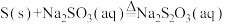 (Ⅲ)
(Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若____________ ,则整个装置气密性良好。装置D的作用是____________ 。装置E中为____________ 溶液。
(2)装置B的作用之一是观察 的生成速率,其中的液体最好选择
的生成速率,其中的液体最好选择____________ 。
a 蒸馏水 b 饱和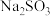 溶液
溶液
c 饱和 溶液 d 饱和
溶液 d 饱和 溶液
溶液
实验中,为使 缓慢进入烧瓶C,采用的操作是
缓慢进入烧瓶C,采用的操作是____________ 。
(3)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出 ,其中可能含有
,其中可能含有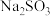 、
、 等杂质。利用所给试剂设计实验,检测产品中是否存在
等杂质。利用所给试剂设计实验,检测产品中是否存在 ,简要说明实验操作、现象和结论:
,简要说明实验操作、现象和结论:__________________ 。
已知 遇酸易分解:
遇酸易分解: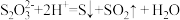 供选择的试剂:稀盐酸、稀硫酸、稀硝酸、
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、 溶液、
溶液、 溶液
溶液
 ,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
,实验室可用如图所示装置(略去部分夹持仪器)模拟生产过程。
烧瓶C中发生反应如下:
 (Ⅰ)
(Ⅰ)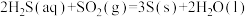 (Ⅱ)
(Ⅱ)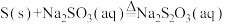 (Ⅲ)
(Ⅲ)(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若
(2)装置B的作用之一是观察
 的生成速率,其中的液体最好选择
的生成速率,其中的液体最好选择a 蒸馏水 b 饱和
 溶液
溶液c 饱和
 溶液 d 饱和
溶液 d 饱和 溶液
溶液实验中,为使
 缓慢进入烧瓶C,采用的操作是
缓慢进入烧瓶C,采用的操作是(3)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出
 ,其中可能含有
,其中可能含有 、
、 等杂质。利用所给试剂设计实验,检测产品中是否存在
等杂质。利用所给试剂设计实验,检测产品中是否存在 ,简要说明实验操作、现象和结论:
,简要说明实验操作、现象和结论:已知
 遇酸易分解:
遇酸易分解: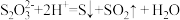 供选择的试剂:稀盐酸、稀硫酸、稀硝酸、
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、 溶液、
溶液、 溶液
溶液
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】亚磷酸二乙酯[HPO(OC2H5)2]是一种液态阻燃增塑剂。实验室采用PCl3和无水乙醇制备高纯度亚磷酸二乙酯,反应方程式为:PCl3 + 4C2H5OH → HPO(OC2H5)2 + HCl↑+2C2H5Cl + H2O;实验步骤如下:

①将45 mL CHCl3和46.00 g(1.0 mol)无水乙醇混合后加入250 mL三颈烧瓶中。
②从仪器A中滴加20 mL CHCl3和41.25 g (0.3 mol)PCl3混合溶液,用冰水控温6~8℃,开动搅拌器,约1 h滴加完毕。
③将反应物倒入烧杯中,用10%的Na2CO3溶液调节pH至7~8,再用去离子水洗涤三次,在仪器B中分离。
④减压蒸馏,收集产品,得29.60 g产品。
(1)装置图中仪器A为恒压滴液漏斗,其中支管的作用为______ ;倒置漏斗的作用为______ ;步骤③中仪器B名称为______ 。
(2)用碳酸钠溶液洗涤的目的是为了除去酸性物质______ (填化学式)以及PCl3;
(3)从无水乙醇利用角度计算,本次实验产率为______ (填数值)。

①将45 mL CHCl3和46.00 g(1.0 mol)无水乙醇混合后加入250 mL三颈烧瓶中。
②从仪器A中滴加20 mL CHCl3和41.25 g (0.3 mol)PCl3混合溶液,用冰水控温6~8℃,开动搅拌器,约1 h滴加完毕。
③将反应物倒入烧杯中,用10%的Na2CO3溶液调节pH至7~8,再用去离子水洗涤三次,在仪器B中分离。
④减压蒸馏,收集产品,得29.60 g产品。
(1)装置图中仪器A为恒压滴液漏斗,其中支管的作用为
(2)用碳酸钠溶液洗涤的目的是为了除去酸性物质
(3)从无水乙醇利用角度计算,本次实验产率为
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
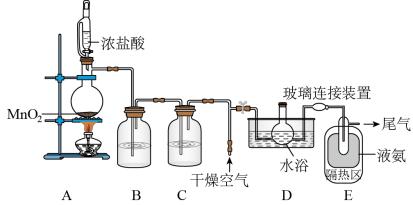
【推荐3】 (一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成
(一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 ,遇有机物易燃烧或爆炸,
,遇有机物易燃烧或爆炸, 以上易分解.某化学研究小组设计如图装置以制备
以上易分解.某化学研究小组设计如图装置以制备 (支撑及夹持等转置已省略).
(支撑及夹持等转置已省略).
已知: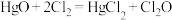 (反应放热);②D装置中的特型烧瓶内装有附着
(反应放热);②D装置中的特型烧瓶内装有附着 粉末的玻璃丝.
粉末的玻璃丝.
请回答:
(1)装置B、C中盛有的最佳试剂依次是_____________ 、_____________ (写名称);
(2)写出装置A中制备 的离子方程式
的离子方程式_____________________________________
反应中每生成 ,则被氧化的
,则被氧化的 为
为_____________  ,转移的电子个数为
,转移的电子个数为_____________
(3)装置A中使用该恒压漏斗的目的是_____________________________________
(4)装置D中采用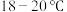 水浴的原因之一:温度过低,反应速率慢;另一个原因
水浴的原因之一:温度过低,反应速率慢;另一个原因______________________________________________________
(5) 是市场上一种比较理想的饮用水消毒剂,
是市场上一种比较理想的饮用水消毒剂, 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,提供相数目的电子,消耗一氧化二氯和氯气的物质的量之比为
,提供相数目的电子,消耗一氧化二氯和氯气的物质的量之比为__________________________________
(6) 的另一种制备方法是利用
的另一种制备方法是利用 与适量潮湿的
与适量潮湿的 反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式
反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式_______________________________________________
 (一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成
(一氧化二氯)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 ,遇有机物易燃烧或爆炸,
,遇有机物易燃烧或爆炸, 以上易分解.某化学研究小组设计如图装置以制备
以上易分解.某化学研究小组设计如图装置以制备 (支撑及夹持等转置已省略).
(支撑及夹持等转置已省略).已知:
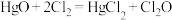 (反应放热);②D装置中的特型烧瓶内装有附着
(反应放热);②D装置中的特型烧瓶内装有附着 粉末的玻璃丝.
粉末的玻璃丝.
请回答:
(1)装置B、C中盛有的最佳试剂依次是
(2)写出装置A中制备
 的离子方程式
的离子方程式反应中每生成
 ,则被氧化的
,则被氧化的 为
为 ,转移的电子个数为
,转移的电子个数为(3)装置A中使用该恒压漏斗的目的是
(4)装置D中采用
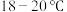 水浴的原因之一:温度过低,反应速率慢;另一个原因
水浴的原因之一:温度过低,反应速率慢;另一个原因(5)
 是市场上一种比较理想的饮用水消毒剂,
是市场上一种比较理想的饮用水消毒剂, 和
和 在消毒时自身均被还原为
在消毒时自身均被还原为 ,提供相数目的电子,消耗一氧化二氯和氯气的物质的量之比为
,提供相数目的电子,消耗一氧化二氯和氯气的物质的量之比为(6)
 的另一种制备方法是利用
的另一种制备方法是利用 与适量潮湿的
与适量潮湿的 反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式
反应来制取,同时生成了氯化钠和碳酸氢钠两种盐,写出该反应的化学方程式
您最近半年使用:0次



