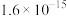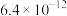铝镍合金粉经活化处理制得的雷尼镍触媒是一种高活性催化剂,主要应用于催化加氢、有机合成等生产过程。经反复使用后,其活性逐渐降低,失活后变成废镍催化剂,该废镍催化剂的原料组成见下表:
工业上对该催化剂进行处理并回收Al和Ni.工艺流程如下,请回答下列问题:
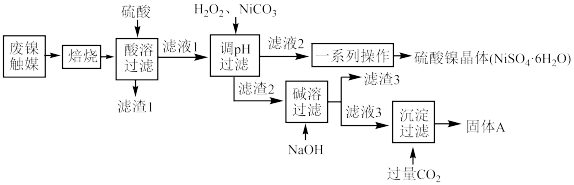
(1)焙烧的目的是___________ 。
(2)请任写一条“滤渣1”在工业上的用途:___________ 。
(3)调pH之前先加入 的目的是
的目的是___________ 。“滤液3”与过量 发生的离子方程式为
发生的离子方程式为___________ 。
(4)“一系列操作”是___________ 。
(5)“滤渣3”中含有两种金属元素,向“滤渣3”中加入过量___________ (填试剂名称),过滤,可以分离两种元素。
(6)氧化镍(NiO)是一种重要的半导体材料,其晶体结构与NaCl相同,其中每个镍离子周围有___________ 个最近的氧离子, 与最近的
与最近的 核间距离为anm,则NiO晶体的密度是
核间距离为anm,则NiO晶体的密度是___________  (写出表达式即可)。
(写出表达式即可)。
| 名称 | 有机物 | Ni | Al | Fe | Cu |  |
| 质量分数/% | 13.5 | 40.2 | 36.3 | 2.7 | 1.3 | 6 |

(1)焙烧的目的是
(2)请任写一条“滤渣1”在工业上的用途:
(3)调pH之前先加入
 的目的是
的目的是 发生的离子方程式为
发生的离子方程式为(4)“一系列操作”是
(5)“滤渣3”中含有两种金属元素,向“滤渣3”中加入过量
(6)氧化镍(NiO)是一种重要的半导体材料,其晶体结构与NaCl相同,其中每个镍离子周围有
 与最近的
与最近的 核间距离为anm,则NiO晶体的密度是
核间距离为anm,则NiO晶体的密度是 (写出表达式即可)。
(写出表达式即可)。
更新时间:2024-04-02 11:15:11
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】某生产企业的工业废水中含有FeSO4和CuSO4.为了变废为宝,技术人员计划从该废水中回收FeSO4和金属Cu,工艺流程如图所示。回答下列问题:
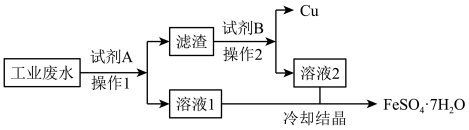
(1)“操作1”与“操作2”的名称为________ ,在实验室中进行该操作时,所需要的玻璃仪器除烧杯外,还有_______ 。
(2)加入试剂A的目的是将Cu2+全部转化为Cu,以便回收铜单质,发生反应的离子方程式为______ 。
(3)溶液1加入过量氯水后发生反应的离子方程式为________ 。
(4)“滤渣”的成分为______ ,加入的试剂B为_______ (填化学式)。
(5)A小组同学要鉴别“溶液2”中的金属阳离子,所需实验操作及实验现象是___________ 。
(6)B小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。试剂:酸化的0.5 mol·L-1 溶液1,5% H2O2溶液
①上述实验中H2O2溶液与溶液1反应的离子方程式是___________ 。
②产生气泡的原因是___________ 。

(1)“操作1”与“操作2”的名称为
(2)加入试剂A的目的是将Cu2+全部转化为Cu,以便回收铜单质,发生反应的离子方程式为
(3)溶液1加入过量氯水后发生反应的离子方程式为
(4)“滤渣”的成分为
(5)A小组同学要鉴别“溶液2”中的金属阳离子,所需实验操作及实验现象是
(6)B小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。试剂:酸化的0.5 mol·L-1 溶液1,5% H2O2溶液
| 操作 | 现象 |
| 取2 mL酸化的溶液1于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
②产生气泡的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
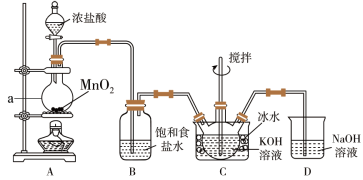
【推荐2】氯气是一种重要的化工原材料,常用于制备盐酸、漂白液、农药和药品等。某小组为了制备源白液(主要成分 ),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“
),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“ 与水的反应是放热反应。在加热条件下
与水的反应是放热反应。在加热条件下 与碱液发生:
与碱液发生: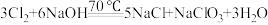
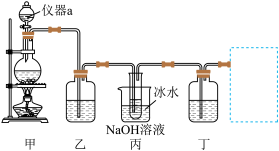
(1)仪器a的名称是___________ ,写出装置甲中发生的化学反应方程式___________ 。
(2)装置乙的作用是提纯 ,装有的试剂是
,装有的试剂是___________ ,装置乙不能省去,原因是___________ 。
(3)丙中冰水浴的作用是___________ 。
(4)欲验证 与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是
与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是___________ ,现象是___________ 。
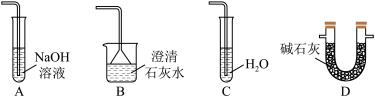
(5)在虚线框中可以使用下列的装置是___________
(6)常温下,在 溶液中滴加浓盐酸,也可以制备
溶液中滴加浓盐酸,也可以制备 ,该氧化还原反应中包含下列几种微粒:
,该氧化还原反应中包含下列几种微粒: ,写出上述的化学反应方程式并配平
,写出上述的化学反应方程式并配平___________ 。在该反应中,表现酸性和还原性的 质量比是
质量比是___________ 。
 ),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“
),并探究氯气的主要性质,设计了如下实验装置。并查阅到下列资料:“ 与水的反应是放热反应。在加热条件下
与水的反应是放热反应。在加热条件下 与碱液发生:
与碱液发生: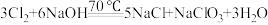

(1)仪器a的名称是
(2)装置乙的作用是提纯
 ,装有的试剂是
,装有的试剂是(3)丙中冰水浴的作用是
(4)欲验证
 与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是
与水反应所得的溶液既有酸性、又有漂白性,装置丁盛放的试剂是(5)在虚线框中可以使用下列的装置是

(6)常温下,在
 溶液中滴加浓盐酸,也可以制备
溶液中滴加浓盐酸,也可以制备 ,该氧化还原反应中包含下列几种微粒:
,该氧化还原反应中包含下列几种微粒: ,写出上述的化学反应方程式并配平
,写出上述的化学反应方程式并配平 质量比是
质量比是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。
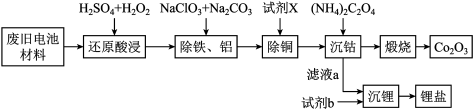
已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中钴酸锂反应的离子方程式________________________________________ ;温度通常控制在40℃以下的原因是_______________________________________________ 。
(2)“除铝铁”过程的两种试剂的作用分别是____________________ ,______________________ 。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式______________________________ 。
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因________________________________________________________________________ 。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是_________________________________________________________ 。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中钴酸锂反应的离子方程式
(2)“除铝铁”过程的两种试剂的作用分别是
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】某课题组成功制备出高质量硫化锌光子晶体。回答下列问题:
(1)基态锌原子的价电子排布式为___________ 。第一电离能介于 、P之间的第三周期元素为
、P之间的第三周期元素为___________ 。
(2)SO2中S的杂化类型为___________ ,SO3的立体构型为___________ 。
(3)硫酸锌溶于氨水可生成 溶液,
溶液,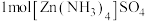 中含有
中含有 键的数目为
键的数目为___________ mol。
(4)硫化锌的晶胞结构如图所示,该晶胞中与硫原子距离最近且相等的硫原子有___________ 个,
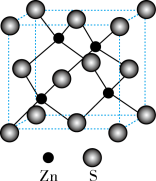
(1)基态锌原子的价电子排布式为
 、P之间的第三周期元素为
、P之间的第三周期元素为(2)SO2中S的杂化类型为
(3)硫酸锌溶于氨水可生成
 溶液,
溶液,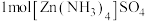 中含有
中含有 键的数目为
键的数目为(4)硫化锌的晶胞结构如图所示,该晶胞中与硫原子距离最近且相等的硫原子有

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】MnO2、PbSO4、ZnO、少量锰铅氧化物Pb2Mn8O16和Ag是冶锌过程中产生的废渣,利用废渣回收金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:

已知:在较高温度及酸性催化条件下,葡萄糖能发生如图所示的反应:

(1)滤液1的主要成分是_____ 。
(2)已知 Pb2Mn8O16中Pb为+2价,Mn为+4价和+2价,则氧化物中+4价和+2价Mn的个数比为________ 。
(3)“还原酸浸”过程中主要的化学方程式为_____ 。
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是_____ ,为提高葡萄糖的有效利用率,可采取的措施为_____ (写两点)。
(5)加入Na2CO3溶液的主要目的是_____ (用离子方程式表示),Na2CO3溶液的最小浓度为_____ mol/L(保留两位小数)。[已知:20℃时Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,1.262≈1.6]
(6)(CH3NH3)PbI3晶胞结构如图所示,其中A代表Pb2+。
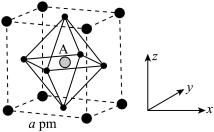
①已知(CH3NH3)PbI3的摩尔质量为Mg/mol,该晶胞的密度为bg•cm-3(设NA为阿伏加德罗常数的值),则晶胞参数a=_____ pm。
②该晶胞沿体对角线方向的投影图为_____ (填序号)。
A. B.
B. 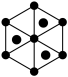 C.
C.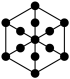 D.
D.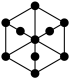

已知:在较高温度及酸性催化条件下,葡萄糖能发生如图所示的反应:

(1)滤液1的主要成分是
(2)已知 Pb2Mn8O16中Pb为+2价,Mn为+4价和+2价,则氧化物中+4价和+2价Mn的个数比为
(3)“还原酸浸”过程中主要的化学方程式为
(4)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是
(5)加入Na2CO3溶液的主要目的是
(6)(CH3NH3)PbI3晶胞结构如图所示,其中A代表Pb2+。

①已知(CH3NH3)PbI3的摩尔质量为Mg/mol,该晶胞的密度为bg•cm-3(设NA为阿伏加德罗常数的值),则晶胞参数a=
②该晶胞沿体对角线方向的投影图为
A.
 B.
B.  C.
C. D.
D.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】金属镍及其化合物在军工机械、生产生活中用途广泛。回答下列问题:
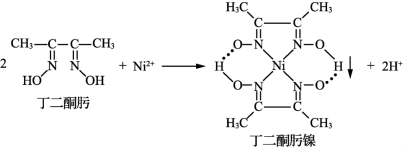
(1) 与丁二酮肟生成鲜红色丁二酮肟镍沉淀,可用于检验
与丁二酮肟生成鲜红色丁二酮肟镍沉淀,可用于检验 。
。
①基态 核外价电子排布式为
核外价电子排布式为___________ 。
②丁二酮肟镍分子中 为平面正方形构型,则
为平面正方形构型,则 的杂化方式为
的杂化方式为___________ (填代号)。
A. B.sp C.
B.sp C. D.
D.
(2)镍能形成多种配合物,如 、
、 等。
等。
①1mol 离子中含有的σ键数目为
离子中含有的σ键数目为___________ 。
② 中的配位原子为
中的配位原子为___________ ,其更容易进行配位的原因是___________ 。
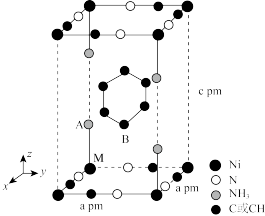
(3)苯与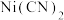 在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳σ键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知
在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳σ键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知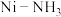 键长为
键长为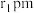 ,C-C键长为
,C-C键长为 pm,M点坐标为(0,0,0)。则该晶体的化学式为
pm,M点坐标为(0,0,0)。则该晶体的化学式为___________ ;B点的分数坐标为___________ ;晶胞中A、B间距离d=___________ pm。
(1)
 与丁二酮肟生成鲜红色丁二酮肟镍沉淀,可用于检验
与丁二酮肟生成鲜红色丁二酮肟镍沉淀,可用于检验 。
。
①基态
 核外价电子排布式为
核外价电子排布式为②丁二酮肟镍分子中
 为平面正方形构型,则
为平面正方形构型,则 的杂化方式为
的杂化方式为A.
 B.sp C.
B.sp C. D.
D.
(2)镍能形成多种配合物,如
 、
、 等。
等。①1mol
 离子中含有的σ键数目为
离子中含有的σ键数目为②
 中的配位原子为
中的配位原子为(3)苯与
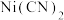 在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳σ键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知
在氨水中可生成一种淡紫色苯包合沉淀物,苯分子位于晶胞的体心且2个碳碳σ键平行于z轴。该晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。已知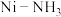 键长为
键长为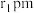 ,C-C键长为
,C-C键长为 pm,M点坐标为(0,0,0)。则该晶体的化学式为
pm,M点坐标为(0,0,0)。则该晶体的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】高铁酸钾(K2FeO4)可做饮用水消毒剂。以废铁屑(表面带油污)为原料制备K2FeO4的流程如下:
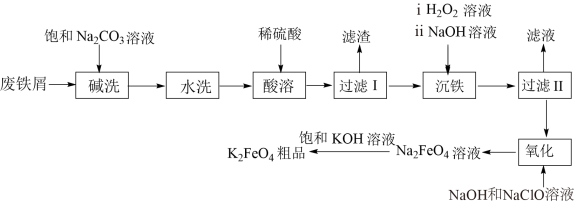
回答下列问题:
(1)高铁酸钾中Fe元素的化合价为___________ 。
(2)“沉铁”步骤加入H2O2溶液,其主要反应的离子方程式为_____________________ 。
(3)“过滤Ⅱ”步骤中滤渣的主要成分为___________ (填化学式)。
(4)该流程中可以循环利用的物质是_______________ (填化学式)。
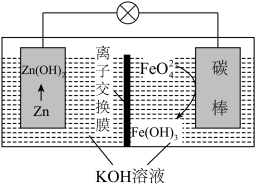
(5)Zn和K2FeO4可以组成高铁电池,电池工作原理如图所示,正极的电极反应式为_________________________ ;高铁电池和常用的高能碱性电池的放电曲线如图所示,高铁电池的优点为_______________________________________________ (任写一点)。


回答下列问题:
(1)高铁酸钾中Fe元素的化合价为
(2)“沉铁”步骤加入H2O2溶液,其主要反应的离子方程式为
(3)“过滤Ⅱ”步骤中滤渣的主要成分为
(4)该流程中可以循环利用的物质是
(5)Zn和K2FeO4可以组成高铁电池,电池工作原理如图所示,正极的电极反应式为


您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】以低品位铜钴矿(主要成分为 、
、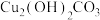 、
、 ,还有少量的FeO、
,还有少量的FeO、 、CaO、MgO等杂质)为原料制备硫酸铜晶体和
、CaO、MgO等杂质)为原料制备硫酸铜晶体和 的一种工艺流程如下:
的一种工艺流程如下:
②萃取时发生反应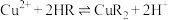
(1)铜钴矿浸出前要预先粉碎,其目的是______ 。
(2)浸出步骤铜钴矿中的 转化为
转化为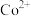 ,该反应的离子方程式为
,该反应的离子方程式为______ 。
(3)加入试剂a______ 可使萃取剂再生。
(4)对于过程I:
①加 溶液作用是
溶液作用是______ 。
②通过计算判断 是否沉淀完全并简述理由
是否沉淀完全并简述理由______ 。(一般认为溶液中离子浓度小于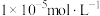 时沉淀完全)
时沉淀完全)
(5)滤渣1成分______ 。
(6) 在足量空气中煅烧生成
在足量空气中煅烧生成 ,写出煅烧过程中的化学反应方程式
,写出煅烧过程中的化学反应方程式______ 。
(7)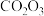 产品纯度测定方法如下:
产品纯度测定方法如下: 与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则
与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则 产品纯度为
产品纯度为______ 。( 的摩尔质量是
的摩尔质量是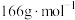 )
)
 、
、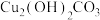 、
、 ,还有少量的FeO、
,还有少量的FeO、 、CaO、MgO等杂质)为原料制备硫酸铜晶体和
、CaO、MgO等杂质)为原料制备硫酸铜晶体和 的一种工艺流程如下:
的一种工艺流程如下: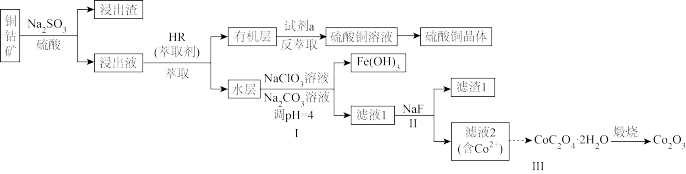
物质 |
|
|
|
|
|
|
|
|
|
|
|
|
|
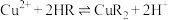
(1)铜钴矿浸出前要预先粉碎,其目的是
(2)浸出步骤铜钴矿中的
 转化为
转化为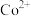 ,该反应的离子方程式为
,该反应的离子方程式为(3)加入试剂a
(4)对于过程I:
①加
 溶液作用是
溶液作用是②通过计算判断
 是否沉淀完全并简述理由
是否沉淀完全并简述理由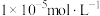 时沉淀完全)
时沉淀完全)(5)滤渣1成分
(6)
 在足量空气中煅烧生成
在足量空气中煅烧生成 ,写出煅烧过程中的化学反应方程式
,写出煅烧过程中的化学反应方程式(7)
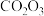 产品纯度测定方法如下:
产品纯度测定方法如下: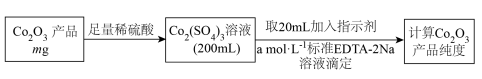
 与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则
与EDTA-2Na按物质的量1:1反应,若滴定至终点时消耗EDTA-2Na标准液体积为20.00mL,则 产品纯度为
产品纯度为 的摩尔质量是
的摩尔质量是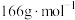 )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
【查阅资料】①Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成KClO3;②K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。
(1)仪器a的名称是________ ;装置A中反应的化学方程式为_______________________ 。
(2)装置C中三颈烧瓶置于冰水浴中的目的是______________________ 。
(3)装置B吸收的气体是________ ,装置D的作用是____________ 。
(4)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25 ℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为____________________________________ 。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0~5 ℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是__________________ .
【查阅资料】①Cl2与KOH溶液在20 ℃以下反应生成KClO,在较高温度下则生成KClO3;②K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。

(1)仪器a的名称是
(2)装置C中三颈烧瓶置于冰水浴中的目的是
(3)装置B吸收的气体是
(4)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25 ℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0~5 ℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某炉渣主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

已知:“焙烧”中, 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
回答下列问题:
(1)产生的“尾气”是___________ 。
(2)在“分步沉淀”时先加氨水调节pH=5,此时过滤所得滤渣主要成分是___________ ;再向滤液中加入氨水调pH=11.4,此时“母液①”中 的浓度为
的浓度为___________  。
。
(3)“水浸渣”的主要成分为 、
、 和
和___________ ;“酸溶”时, 转化为
转化为 进入溶液,则
进入溶液,则 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(4)“酸溶”后,将溶液适当稀释并加热,“水解”生成 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是___________ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
已知:“焙烧”中,
 、
、 几乎不发生反应,
几乎不发生反应, 、MgO、CaO、
、MgO、CaO、 转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.1 | 13.8 |
(1)产生的“尾气”是
(2)在“分步沉淀”时先加氨水调节pH=5,此时过滤所得滤渣主要成分是
 的浓度为
的浓度为 。
。(3)“水浸渣”的主要成分为
 、
、 和
和 转化为
转化为 进入溶液,则
进入溶液,则 发生反应的化学方程式为
发生反应的化学方程式为(4)“酸溶”后,将溶液适当稀释并加热,“水解”生成
 沉淀,该反应的离子方程式是
沉淀,该反应的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氯气与碱溶液反应,在低温、稀碱溶液中主要产物是ClO-和Cl-,在75℃以上、浓碱溶液中主要产物是ClO3-和Cl-。研究小组用如下实验装置制取氯酸钾(KClO3),并测定其纯度。(夹持装置已省略)

a为浓盐酸,b为MnO2,c为饱和食盐水, d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I中反应的化学方程式为_______________________________________ 。
②若取消装置II,对本实验的影响是__________________________________________ 。
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是__________________ 。
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和______________ 。
(2)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10, 滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去C1O-的离子方程式是__________________________________ 。
②样品中KClO3的貭量分数为____________ 。(保留三位有效数字,KClO3式量:122.5)

a为浓盐酸,b为MnO2,c为饱和食盐水, d为30%KOH溶液,e为NaOH溶液
回答下列问题:
(1)检查装置气密性后,添加药品,待装置III水温升至75℃开始反应。
①装置I中反应的化学方程式为
②若取消装置II,对本实验的影响是
③实验结束,拆解装置I前为了防止大量氯气逸出,可采取的措施是
④从装置III的试管中分离得到KClO3粗产品,其中混有的杂质是KClO和
(2)为测定产品KClO3的纯度,进行如下实验:
步骤1:取2.45g样品溶于水配成250mL溶液。
步骤2:取25.00mL溶液于锥形瓶中,调至pH=10, 滴加足量H2O2溶液充分振荡以除尽ClO-。然后煮沸溶液1~2分钟,冷却。
步骤3:加入过量KI溶液,再逐滴加入足量稀硫酸。(ClO3-+6I-+6H+=Cl-+3I2+3H2O)
步骤4:加入指示剂,用0.5000mol/LNa2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。 (2S2O32-+I2=S4O62-+2I-)
①步骤2中除去C1O-的离子方程式是
②样品中KClO3的貭量分数为
您最近一年使用:0次