a~h为元素周期表中前四周期相应元素。
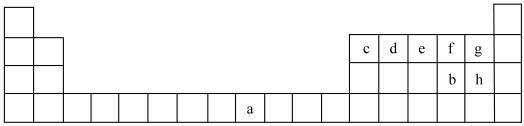
回答下列问题:
(1)元素a基态原子的价电子排布式为_______ 。
(2)元素d与b形成的稳定化合物属于_______ 分子(填“极性”或“非极性”)。
(3)df2、bf2与SiO2三个物质熔点由高到低的顺序为_______ (填化学式),理由为_______ 。
(4)化合物cg3分子的空间结构为_______ ,其中心原子的杂化方式为_______ ;键角cg3_______ eg3(填“>”“=”或“<”);a~h元素组成的含氧酸根离子中,空间结构与cg3相同的一种是_______ (填离子符号)。

回答下列问题:
(1)元素a基态原子的价电子排布式为
(2)元素d与b形成的稳定化合物属于
(3)df2、bf2与SiO2三个物质熔点由高到低的顺序为
(4)化合物cg3分子的空间结构为
更新时间:2024-04-09 12:39:42
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】实验研究表明,Cu2+本身是无色离子,其化合物或化合物溶液能显现出各种颜色的主要原因是Cu2+形成化合物时,形成了配位键,其配合物显现出各种不同的颜色。如无水硫酸铜中, 不易与Cu2+形成配位键,故无水硫酸铜为白色粉末,无水硫酸铜遇到水蒸气后,H2O与Cu2+形成蓝色的[Cu(H2O)4]2+,白色粉末逐渐变为蓝色。回答下列问题:
不易与Cu2+形成配位键,故无水硫酸铜为白色粉末,无水硫酸铜遇到水蒸气后,H2O与Cu2+形成蓝色的[Cu(H2O)4]2+,白色粉末逐渐变为蓝色。回答下列问题:
(1)基态 Cu2+核外电子排布式为___________ ;铜元素位于元素周期表的___________ 区。
(2)H2O分子中O原子的杂化方式为___________ 杂化;水分子的空间构型为___________ ;根据电负性分析水中氧元素为-2价而氢元素为+1价的原因是___________ 。
(3)1mol[Cu(H2O)4]2+含有___________  共价键,中心原子配位数为
共价键,中心原子配位数为___________ 。
(4)光学原理中,黄色与蓝色的光混合后呈现出绿色。仔细阅读题干信息,推测CuCl2∙2H2O晶体为绿色的原因可能是___________ 。
(5)金属铜的晶胞结构如图所示,已知金属铜的密度为 ,NA表示阿伏加德罗常数的值,则距离最近的两个铜原子之间的距离为
,NA表示阿伏加德罗常数的值,则距离最近的两个铜原子之间的距离为___________  (列出算式即可,不需要化简)。
(列出算式即可,不需要化简)。

 不易与Cu2+形成配位键,故无水硫酸铜为白色粉末,无水硫酸铜遇到水蒸气后,H2O与Cu2+形成蓝色的[Cu(H2O)4]2+,白色粉末逐渐变为蓝色。回答下列问题:
不易与Cu2+形成配位键,故无水硫酸铜为白色粉末,无水硫酸铜遇到水蒸气后,H2O与Cu2+形成蓝色的[Cu(H2O)4]2+,白色粉末逐渐变为蓝色。回答下列问题:(1)基态 Cu2+核外电子排布式为
(2)H2O分子中O原子的杂化方式为
(3)1mol[Cu(H2O)4]2+含有
 共价键,中心原子配位数为
共价键,中心原子配位数为(4)光学原理中,黄色与蓝色的光混合后呈现出绿色。仔细阅读题干信息,推测CuCl2∙2H2O晶体为绿色的原因可能是
(5)金属铜的晶胞结构如图所示,已知金属铜的密度为
 ,NA表示阿伏加德罗常数的值,则距离最近的两个铜原子之间的距离为
,NA表示阿伏加德罗常数的值,则距离最近的两个铜原子之间的距离为 (列出算式即可,不需要化简)。
(列出算式即可,不需要化简)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】过渡金属及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)过渡元素Co基态原子的核外电子排布式为_______ ;第四电离能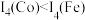 ,其原因是
,其原因是_______ 。
(2)Fe、Fe2+、Fe3+可以与CO、 、
、 、
、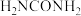 (尿素)等多种配体形成很多的配合物。
(尿素)等多种配体形成很多的配合物。
①配合物 的熔点为-20℃,沸点为103℃,可用于制备纯铁。
的熔点为-20℃,沸点为103℃,可用于制备纯铁。 的结构如图所示。下列关于
的结构如图所示。下列关于 说法不正确的是
说法不正确的是_______ (填序号)。
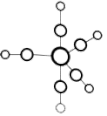
A. 是分子晶体
是分子晶体
B. 中Fe原子的配体与
中Fe原子的配体与 互为等电子体
互为等电子体
C. 中σ键与π键之比为1∶1
中σ键与π键之比为1∶1
D.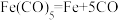 反应中没有新化学键生成
反应中没有新化学键生成
② 的电子式为
的电子式为_______ 。
③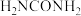 (尿素)中N原子的杂化方式为
(尿素)中N原子的杂化方式为_______ ,组成尿素的4种元素的第一电离能由大到小的顺序为_______ 。
(3)Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为( ,
, ,
, )。
)。
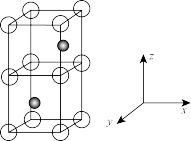
①Ni的配位数为_______ 。
②已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为_______  。
。
(1)过渡元素Co基态原子的核外电子排布式为
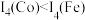 ,其原因是
,其原因是(2)Fe、Fe2+、Fe3+可以与CO、
 、
、 、
、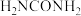 (尿素)等多种配体形成很多的配合物。
(尿素)等多种配体形成很多的配合物。①配合物
 的熔点为-20℃,沸点为103℃,可用于制备纯铁。
的熔点为-20℃,沸点为103℃,可用于制备纯铁。 的结构如图所示。下列关于
的结构如图所示。下列关于 说法不正确的是
说法不正确的是
A.
 是分子晶体
是分子晶体B.
 中Fe原子的配体与
中Fe原子的配体与 互为等电子体
互为等电子体C.
 中σ键与π键之比为1∶1
中σ键与π键之比为1∶1D.
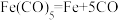 反应中没有新化学键生成
反应中没有新化学键生成②
 的电子式为
的电子式为③
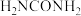 (尿素)中N原子的杂化方式为
(尿素)中N原子的杂化方式为(3)Ni和As形成某种晶体的晶胞图如图所示。其中,大球为Ni,小球为As,距离As最近的Ni构成正三支柱,其中晶胞下方As原子坐标为(
 ,
, ,
, )。
)。
①Ni的配位数为
②已知晶胞底面边长为apm,高为cpm,NA为阿伏加德罗常数。则晶胞密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】乙炔是有机合成工业的一种重要原料。工业上曾用焦炭制备电石 (CaC2),再与水反应制备乙炔。
(1)焦炭、金刚石和 都是碳的单质。已知金刚石中碳碳键的键长为
都是碳的单质。已知金刚石中碳碳键的键长为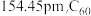 中碳碳键的键长为
中碳碳键的键长为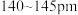 ,二者比较熔点高的是
,二者比较熔点高的是___________ ,理由是___________ 。
(2)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是___________ ,该分子中 键与
键与 键个数比为
键个数比为___________ 。
(3)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为
基态核外电子排布式为___________ 。 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:___________ 。
(4)CaC2中 与
与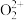 互为等电子体,
互为等电子体,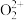 的电子式为
的电子式为___________ 。
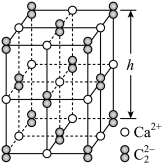
(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的 有
有___________ 个。已知CaC2晶体密度为 ,晶胞中两个
,晶胞中两个 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=___________ cm。
(1)焦炭、金刚石和
 都是碳的单质。已知金刚石中碳碳键的键长为
都是碳的单质。已知金刚石中碳碳键的键长为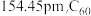 中碳碳键的键长为
中碳碳键的键长为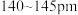 ,二者比较熔点高的是
,二者比较熔点高的是(2)乙炔与氢氰酸反应可得丙烯腈
 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是 键与
键与 键个数比为
键个数比为(3)将乙炔通入
 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为
基态核外电子排布式为 的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:
的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式:(4)CaC2中
 与
与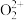 互为等电子体,
互为等电子体,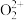 的电子式为
的电子式为(5)CaC2晶体的晶胞结构与NaCl晶体相似,但CaC2晶体中哑铃形
 的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的
的存在,使晶胞沿一个方向拉长,晶胞呈长方体(如图)。每个Ca2+周围距离相等且最近的 有
有 ,晶胞中两个
,晶胞中两个 的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
的最近距离为acm,阿伏加德罗常数值为NA,则CaC2晶胞中棱长h=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】根据报道,贵州发现的超大型锰矿区资源量已超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家紧缺战略矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、消费大国,请回答下列问题:
(1)基态锰原子的价层电子排布式为_______ 。
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化一氧化碳和甲醛(HCHO)。
①CO和N2互为等电于体。CO分子中σ键和π键数目之比为_______ 。
②HCHO分子的H—C—H键角_______ (填“大于”“小于”或“等于”)CO2的键角,理由是_______ 。
③向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。 的立体构型是
的立体构型是_______ 。
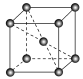
(3)锰晶胞如图所示。已知锰晶胞参数为anm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_______ 。锰晶胞中Mn的密度=_______ 。
(1)基态锰原子的价层电子排布式为
(2)铜锰氧化物(CuMn2O4)能在常温下催化氧化一氧化碳和甲醛(HCHO)。
①CO和N2互为等电于体。CO分子中σ键和π键数目之比为
②HCHO分子的H—C—H键角
③向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
 的立体构型是
的立体构型是(3)锰晶胞如图所示。已知锰晶胞参数为anm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铜及其化合物在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)氨水或过氧化氢单独与铜都不能反应,但氨水和过氧化氢的混合溶液可与铜反应生成深蓝色溶液,写出此反应的化学方程式______ 。产物中含氮物质的H-N-H键角比NH3中H-N-H的键角_____ (选填“大”、“小”、“相等”或“无法判断”),原因是______ 。
(2)甘氨酸铜有顺式和反式两种同分异构体,结构如图。

①甘氨酸铜中铜原子的杂化类型为______ (填序号)。
a.sp b.sp2 C.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水,原因可能是______ 。
(3)氧化亚铜的晶胞如图。已知氧化亚铜的密度为ρg•cm-3,阿伏伽德罗常数为NAmol-1。则两个铜原子的最短距离为______ pm(用含ρ、NA的代数式表示)。如图能够表示沿晶胞面对角线投影的是______ 。


(1)氨水或过氧化氢单独与铜都不能反应,但氨水和过氧化氢的混合溶液可与铜反应生成深蓝色溶液,写出此反应的化学方程式
(2)甘氨酸铜有顺式和反式两种同分异构体,结构如图。

①甘氨酸铜中铜原子的杂化类型为
a.sp b.sp2 C.sp3 d.dsp2
②已知顺式甘氨酸铜能溶于水,反式甘氨酸铜难溶于水,原因可能是
(3)氧化亚铜的晶胞如图。已知氧化亚铜的密度为ρg•cm-3,阿伏伽德罗常数为NAmol-1。则两个铜原子的最短距离为


您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】根据要求回答问题。
(1)基态锰原子的价电子排布式为___________ ,第四周期元素的基态原子核外单电子数与基态钴原子相同的是___________ (填元素符号)。
(2)Cu、Fe的第二电离能: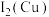
___________ 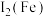 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(3)氧和硫同族,但是它们简单氢化物的键角不同,原因是___________ 。
(4)氧和同族元素能形成多种化合物,如 、
、 ,二者分子中S和Se的价层电子对数分别为
,二者分子中S和Se的价层电子对数分别为___________ 、___________ 。
(5)基态Mo原子的价电子排布为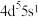 ,其位于元素周期表
,其位于元素周期表___________ 区,最高化合价为___________ 。
(1)基态锰原子的价电子排布式为
(2)Cu、Fe的第二电离能:
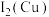
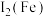 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(3)氧和硫同族,但是它们简单氢化物的键角不同,原因是
(4)氧和同族元素能形成多种化合物,如
 、
、 ,二者分子中S和Se的价层电子对数分别为
,二者分子中S和Se的价层电子对数分别为(5)基态Mo原子的价电子排布为
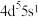 ,其位于元素周期表
,其位于元素周期表
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】中国早在周朝已能冶炼铸铁了。目前,铁及其化合物广泛地应用到各个领域。请回答下列问题:
(1)基态铁原子的电子排布式为_______ 。
(2)我国菱铁矿FeCO3储量较为丰富,其中CO 的空间结构为
的空间结构为_______ ,与CO 互为等电子体的一种分子的化学式为
互为等电子体的一种分子的化学式为_______ 。
(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如图,碳原子的杂化方式是_______ 。

(4)Fe(CO)5溶于汽油、苯、丙酮等有机溶剂,熔点、沸点分别在-20℃、103.6℃左右。因此可知Fe(CO)5属于_______ 晶体;从电子对给予情况来看,CO与Fe之间形成_______ 键。
(5)铁与氨气反应生成一种如图所示晶胞结构的产物,N周围最近的Fe数目是_______ 。若该晶体的密度是dg•cm-3,则两个最近的Fe间的距离为_______ pm(设NA为阿伏加德罗常数的值)。

(1)基态铁原子的电子排布式为
(2)我国菱铁矿FeCO3储量较为丰富,其中CO
 的空间结构为
的空间结构为 互为等电子体的一种分子的化学式为
互为等电子体的一种分子的化学式为(3)草酸亚铁可作为电池正极材料磷酸铁锂的原料,其结构简式如图,碳原子的杂化方式是

(4)Fe(CO)5溶于汽油、苯、丙酮等有机溶剂,熔点、沸点分别在-20℃、103.6℃左右。因此可知Fe(CO)5属于
(5)铁与氨气反应生成一种如图所示晶胞结构的产物,N周围最近的Fe数目是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为_______ 。
②NO 的空间构型是
的空间构型是_______ (用文字描述)。
(2)Cu+在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu。但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成 Cu2O:_______ 。
(3)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①HCHO的中心原子的杂化方式为_______ 。
②1 mol CO2中含有的σ键数目为_______ 。
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_______ 。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为
②NO
 的空间构型是
的空间构型是(2)Cu+在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu。但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成 Cu2O:
(3)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①HCHO的中心原子的杂化方式为
②1 mol CO2中含有的σ键数目为
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
元素M化合态常见化合价是____ 价,其基态原子电子排布式为______________ 。
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为__________________ 。
(3)PO43-的中心原子的杂化方式为____ ,该离子的空间构型为____ ,键角为____ ,其等电子体有____ (请写出两种)。
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为____ ;已知Ca2+和F-半径分别为a cm、b cm,阿伏加 德罗常数为NA,M为摩尔质量,则晶体密度为____ g·cm-3(不必化简)。
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为____ ,原因为______ 。

(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I5表示)如表所示:
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ/mol | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
(2)Ca3(PO4)3F中非金属元素电负性由大到小的顺序为
(3)PO43-的中心原子的杂化方式为
(4)CaF2晶胞结构如图所示,则CaF2晶体中与Ca2+最近且等距离的Ca2+数目为
(5)已知MgO与CaO的晶体结构相似,其摩氏硬度的大小关系为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】碳酸二甲酯 是一种环保性能优异、用途广泛的化工原料,可以通过下列流程制备:
是一种环保性能优异、用途广泛的化工原料,可以通过下列流程制备:

(1)写出NH3的电子式
(2)写出步骤Ⅲ的化学反应方程式
(3)下列说法正确的是_______。
| A.液氯和氯水工业上均可用铁槽车运送 |
| B.CO(NH2)2属于铵盐,含氮量高,可作氮肥 |
| C.碳酸二甲酯在酸性条件下水解产生的气体是非极性分子 |
| D.CO与Fe可形成配合物Fe(CO)5,其中配位原子是O |
(4)碳酸二甲酯比碳酸一甲酯的沸点
(5)设计实验方案检验COCl2中的氯元素
您最近一年使用:0次
【推荐2】N、O、S、Cl、Cu五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)与 互为等电子体的微粒有
互为等电子体的微粒有_______ (任写1种)。
(2)H2O的沸点比H2S高的原因是______ ;SO2属于_____ (填“极性”或“非极性”)分子,1molCOCl2含有的π键为_____ mol。
(3)Cu与Cl形成化合物的晶胞如图所示。
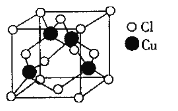
该晶体的化学式为_____ 。已知该晶体中Cu原子和Cl原子之间的最短距离为a nm,且恰好为体对角线的 ,阿伏加德罗常数为NA,则该晶体的密度为
,阿伏加德罗常数为NA,则该晶体的密度为_____ (只写计算式)g/cm3。
(1)与
 互为等电子体的微粒有
互为等电子体的微粒有(2)H2O的沸点比H2S高的原因是
(3)Cu与Cl形成化合物的晶胞如图所示。

该晶体的化学式为
 ,阿伏加德罗常数为NA,则该晶体的密度为
,阿伏加德罗常数为NA,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】水是地球上最常见的物质之一,是所有生命生存的重要资源。
(1)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质。
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如图:

使水结成“热冰”采用弱电场的条件,说明水分子是______ 分子(填“极性”或“非极性”)。
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性试与写该阳离子与SO2的水溶液反应的离子方程式:____________________ ;
(2)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水沸点高于同主族其他氢化物的原因:____________ 。
(3)2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下, 和
和 都能与
都能与 形成如图所示的笼状结构(表面的小球是水分子,内部的大球是
形成如图所示的笼状结构(表面的小球是水分子,内部的大球是 分子或
分子或 分子;“可燃冰”是
分子;“可燃冰”是 与
与 形成的水合物),其相关参数见表。
形成的水合物),其相关参数见表。

① 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为______ ;
碳原子的最高能级的符号是______ ,其电子云形状是______ 形。
② 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为______ , 与
与 相同条件下在水中的溶解度较大的是
相同条件下在水中的溶解度较大的是 ,理由是
,理由是_____________ 。
③“可燃冰”中分子间存在的作用力是______ 和_____ ,图中最小的环中连接的原子总数是______ 。
(4)氨气溶于水时,大部分 与
与 用氢键(用“…”表示)结合形成
用氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为______(填标号)。
的结构式为______(填标号)。
(1)科学家发现在特殊条件下,水能表现出许多种有趣的结构和性质。
①一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如图:

使水结成“热冰”采用弱电场的条件,说明水分子是
②用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。产生的阳离子具有较强的氧化性试与写该阳离子与SO2的水溶液反应的离子方程式:
(2)水的性质中的一些特殊现象对于生命的存在意义非凡,请解释水沸点高于同主族其他氢化物的原因:
(3)2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,
 和
和 都能与
都能与 形成如图所示的笼状结构(表面的小球是水分子,内部的大球是
形成如图所示的笼状结构(表面的小球是水分子,内部的大球是 分子或
分子或 分子;“可燃冰”是
分子;“可燃冰”是 与
与 形成的水合物),其相关参数见表。
形成的水合物),其相关参数见表。
①
 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为碳原子的最高能级的符号是
②
 分子中碳原子的杂化轨道类型为
分子中碳原子的杂化轨道类型为 与
与 相同条件下在水中的溶解度较大的是
相同条件下在水中的溶解度较大的是 ,理由是
,理由是③“可燃冰”中分子间存在的作用力是
(4)氨气溶于水时,大部分
 与
与 用氢键(用“…”表示)结合形成
用氢键(用“…”表示)结合形成 分子。根据氨水的性质可推知
分子。根据氨水的性质可推知 的结构式为______(填标号)。
的结构式为______(填标号)。A. | B. | C. | D. |
您最近一年使用:0次



