I.回答下列问题
(1)其他条件相同、催化剂不同时发生反应2CO(g)+SO2(g) S(l)+2CO2(g)。SO2的转化率随反应温度的变化如图1所示,由图分析,选择
S(l)+2CO2(g)。SO2的转化率随反应温度的变化如图1所示,由图分析,选择___________ 做催化剂最好。某种铁镍合金的立方晶胞如图2所示,镍原子的配位数为___________ ;该合金的化学式为___________ 。___________ ;A点对应条件下
___________ [对于反应mA(g)+nB(g) pC(g)+qD(g),
pC(g)+qD(g),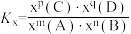 ,x为物质的量分数]。
,x为物质的量分数]。
Ⅱ.CO2催化加氢制取甲醇 ,反应如下:
,反应如下:
主反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H=-49.01kJ/mol
CH3OH(g)+H2O(g) ∆H=-49.01kJ/mol
副反应:CO2(g)+H2(g) CO(g)+H2O(g) ∆H=+41.17kJ/mol
CO(g)+H2O(g) ∆H=+41.17kJ/mol
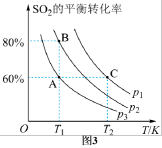
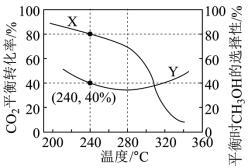
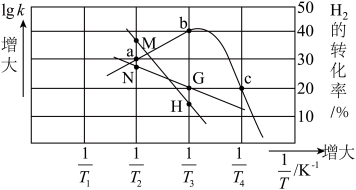
在一定条件下,向某1L恒容密闭容器中充入1mol CO2和a molH2发生反应。实验测得CO2的平衡转化率和平衡时的选择性随温度变化如图所示。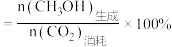 。
。
(3)图中表示平衡时 的选择性的曲线为
的选择性的曲线为___________ (填“X”或“Y”);温度低于280℃时,曲线Y随温度升高而下降的原因是___________ 。
(4)240℃时,容器内达到平衡状态时副反应的K=1,则初始充入H2的物质的量a=___________ mol(保留三位有效数字)。
(1)其他条件相同、催化剂不同时发生反应2CO(g)+SO2(g)
 S(l)+2CO2(g)。SO2的转化率随反应温度的变化如图1所示,由图分析,选择
S(l)+2CO2(g)。SO2的转化率随反应温度的变化如图1所示,由图分析,选择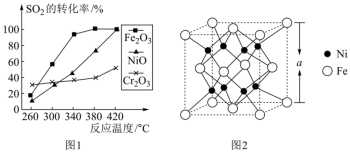

 pC(g)+qD(g),
pC(g)+qD(g),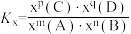 ,x为物质的量分数]。
,x为物质的量分数]。Ⅱ.CO2催化加氢制取甲醇
 ,反应如下:
,反应如下:主反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H=-49.01kJ/mol
CH3OH(g)+H2O(g) ∆H=-49.01kJ/mol副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H=+41.17kJ/mol
CO(g)+H2O(g) ∆H=+41.17kJ/mol在一定条件下,向某1L恒容密闭容器中充入1mol CO2和a molH2发生反应。实验测得CO2的平衡转化率和平衡时的选择性随温度变化如图所示。
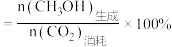 。
。(3)图中表示平衡时
 的选择性的曲线为
的选择性的曲线为(4)240℃时,容器内达到平衡状态时副反应的K=1,则初始充入H2的物质的量a=
更新时间:2024-04-15 19:20:23
|
相似题推荐
【推荐1】我国力争2030年前实现碳达峰,2060年前实现碳中和。 的综合利用是实现碳中和的措施之一。
的综合利用是实现碳中和的措施之一。
Ⅰ. 和
和 在金属催化剂表面可以合成
在金属催化剂表面可以合成 ,普遍反应路径有三种,其中一种反应路径经历
,普遍反应路径有三种,其中一种反应路径经历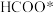 中间体。某小组研究了金属钴的不同晶面【
中间体。某小组研究了金属钴的不同晶面【 、
、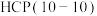 、
、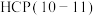 】对
】对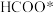 这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):
这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):
(1)写出在 晶面反应的控速步基元反应:
晶面反应的控速步基元反应:______ 。
(2)仅比较表格数据可知, 和
和 在该条件下合成
在该条件下合成 ,
,______ 晶面的催化效果最好。
Ⅱ. 和
和 一定条件下也可以合成甲醇,该过程存在副反应II。
一定条件下也可以合成甲醇,该过程存在副反应II。
反应Ⅰ:
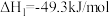
反应Ⅱ:

(3)上述反应中相关物质能量如图1所示。计算
______  。
。
(4)向VL密闭容器中通入
 、
、
 ,在催化剂作用下发生反应。相同时间内温度对
,在催化剂作用下发生反应。相同时间内温度对 转化率及
转化率及 和
和 产率的影响如图2所示。
产率的影响如图2所示。 的转化率随温度升高而增大的原因可能是
的转化率随温度升高而增大的原因可能是______ 。表示 产率随温度变化的曲线是
产率随温度变化的曲线是______ (填“a”或“b”)。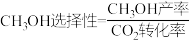 ),则0~tmin内
),则0~tmin内 的反应速率为
的反应速率为______ mol/(L·min),反应Ⅱ的平衡常数为______ (结果保留2位有效数字)。
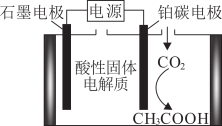
Ⅲ.2021年我国科学家首先实现了从 到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将
到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将 转化为
转化为 。
。______ 。
 的综合利用是实现碳中和的措施之一。
的综合利用是实现碳中和的措施之一。Ⅰ.
 和
和 在金属催化剂表面可以合成
在金属催化剂表面可以合成 ,普遍反应路径有三种,其中一种反应路径经历
,普遍反应路径有三种,其中一种反应路径经历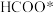 中间体。某小组研究了金属钴的不同晶面【
中间体。某小组研究了金属钴的不同晶面【 、
、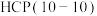 、
、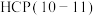 】对
】对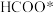 这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):
这种反应路径的催化效果,相关基元反应能量变化如下表(*指微粒吸附在催化剂表面):| 基元反应步骤 |  | 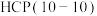 | 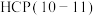 | |||
| 活化能(eV) | 反应热(eV) | 活化能(eV) | 反应热(eV) | 活化能(eV) | 反应热(eV) | |
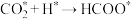 | 0.46 | -0.52 | 0.66 | -0.12 | 0.20 | -0.69 |
 | 1.27 | 0.73 | 0.23 | -0.16 | 1.36 | 0.78 |
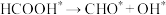 | 0.76 | -0.11 | 0.44 | -0.18 | 0.96 | -0.47 |
 | 0.53 | 0.15 | 0.42 | 0.14 | 0.54 | 0.15 |
 | 0.90 | 0.27 | 0.80 | 0.08 | 1.37 | 0.69 |
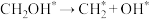 | 0.70 | -0.63 | 0.33 | -0.47 | 0.60 | -1.02 |
 晶面反应的控速步基元反应:
晶面反应的控速步基元反应:(2)仅比较表格数据可知,
 和
和 在该条件下合成
在该条件下合成 ,
,Ⅱ.
 和
和 一定条件下也可以合成甲醇,该过程存在副反应II。
一定条件下也可以合成甲醇,该过程存在副反应II。反应Ⅰ:

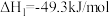
反应Ⅱ:


(3)上述反应中相关物质能量如图1所示。计算

 。
。(4)向VL密闭容器中通入

 、
、
 ,在催化剂作用下发生反应。相同时间内温度对
,在催化剂作用下发生反应。相同时间内温度对 转化率及
转化率及 和
和 产率的影响如图2所示。
产率的影响如图2所示。 的转化率随温度升高而增大的原因可能是
的转化率随温度升高而增大的原因可能是 产率随温度变化的曲线是
产率随温度变化的曲线是
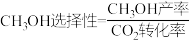 ),则0~tmin内
),则0~tmin内 的反应速率为
的反应速率为Ⅲ.2021年我国科学家首先实现了从
 到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将
到淀粉的全人工合成。其中的一个步骤是利用新型电化学催化装置(如图所示)将 转化为
转化为 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2 (g) CH3OH(g) ΔH1=-90.7kJ·mol-1K1
CH3OH(g) ΔH1=-90.7kJ·mol-1K1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
③CO(g)+H2O(g) CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
回答下列问题:
(1)反应3H2 (g)+3CO(g) CH3OCH3 (g)+CO2(g)的ΔH=
CH3OCH3 (g)+CO2(g)的ΔH=_____ kJ·mol-1;该反应的平衡常数K=_____ (用K1、K2、K3表示)。随温度的升高,该反应的平衡常数K的变化趋势是_____ (填增大、减小、或不变)
(2)下列措施中,能提高(1)中CH3OCH3产率的有_____ (填字母)。
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2molCO和0.1molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5min内v(H2O)=_____ ,CO的转化率为_____ ,向上述平衡体系中再充入0.2molCO和0.1molH2O(g),再次达到平衡时,H2的体积分数_____ 0.1(填大于、小于、或等于)
(4)将合成气以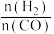 =2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g) CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是_____ (填字母)。
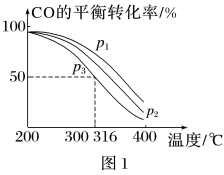
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时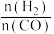 =3,则平衡时,α(CO)小于50%
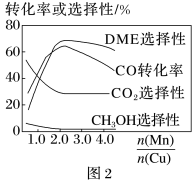
=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当 约为
约为_____ 时最有利于二甲醚的合成。
①CO(g)+2H2 (g)
 CH3OH(g) ΔH1=-90.7kJ·mol-1K1
CH3OH(g) ΔH1=-90.7kJ·mol-1K1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1K2③CO(g)+H2O(g)
 CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3
CO2(g)+H2 (g) ΔH3=-41.2kJ·mol-1K3回答下列问题:
(1)反应3H2 (g)+3CO(g)
 CH3OCH3 (g)+CO2(g)的ΔH=
CH3OCH3 (g)+CO2(g)的ΔH=(2)下列措施中,能提高(1)中CH3OCH3产率的有
A.使用过量的CO B.升高温度 C.增大压强
(3)一定温度下,将0.2molCO和0.1molH2O(g)通入2L恒容密闭容器中,发生反应③,5min后达到化学平衡,平衡后测得H2的体积分数为0.1.则0~5min内v(H2O)=
(4)将合成气以
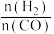 =2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g)
=2通入1L的反应器中,一定条件下发生反应:4H2 (g)+2CO(g) CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
CH3OCH3 (g)+H2O(g)ΔH,其中CO的平衡转化率随温度、压强的变化关系如图1所示,下列说法正确的是
A.ΔH<0
B.p1>p2>p3
C.若在p3和316℃时,起始时
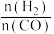 =3,则平衡时,α(CO)小于50%
=3,则平衡时,α(CO)小于50%(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察图2,当
 约为
约为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】 甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
主反应:

副反应:
 ,
,
回答下列问题:
(1)向 密闭容器中充入
密闭容器中充入 反应合成
反应合成 ,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
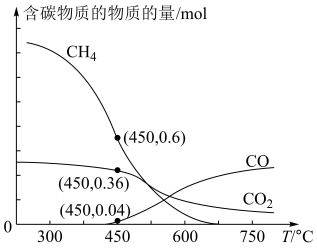
①工业上,常选用 作为合成温度,原因是
作为合成温度,原因是__________ 。
② 时,经过t分钟反应达平衡,t分钟内用
时,经过t分钟反应达平衡,t分钟内用 表示的反应速率为
表示的反应速率为______  ;该温度下
;该温度下 对甲烷的选择性=
对甲烷的选择性=________ 。(已知:选择性 )
)
(2)在体积相等的多个恒容密闭容器中,分别充入 和
和 发生上述主反应(忽略副反应),已知该反应的速率方程为
发生上述主反应(忽略副反应),已知该反应的速率方程为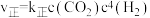 ,
, ,其中
,其中 为速率常数,只受温度影响。在不同温度下反应相同时间,测得
为速率常数,只受温度影响。在不同温度下反应相同时间,测得 转化率与温度关系如图所示。
转化率与温度关系如图所示。
①c点______ (填“达平衡”或“未平衡”)。
②主反应活化能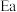 (正)
(正)___ 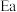 (逆)(填“>”或“<”),代表
(逆)(填“>”或“<”),代表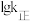 的曲线是
的曲线是______ (填“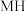 ”或“
”或“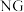 ”)。
”)。
③ 温度下达平衡时总压为p,该反应的
温度下达平衡时总压为p,该反应的
________ (列出计算式)。
(3)生物电化学系统可实现 合成甲烷。阴极功能微生物
合成甲烷。阴极功能微生物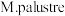 可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式________ 。
 甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:主反应:


副反应:

 ,
,回答下列问题:
(1)向
 密闭容器中充入
密闭容器中充入 反应合成
反应合成 ,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
①工业上,常选用
 作为合成温度,原因是
作为合成温度,原因是②
 时,经过t分钟反应达平衡,t分钟内用
时,经过t分钟反应达平衡,t分钟内用 表示的反应速率为
表示的反应速率为 ;该温度下
;该温度下 对甲烷的选择性=
对甲烷的选择性= )
)(2)在体积相等的多个恒容密闭容器中,分别充入
 和
和 发生上述主反应(忽略副反应),已知该反应的速率方程为
发生上述主反应(忽略副反应),已知该反应的速率方程为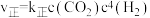 ,
, ,其中
,其中 为速率常数,只受温度影响。在不同温度下反应相同时间,测得
为速率常数,只受温度影响。在不同温度下反应相同时间,测得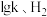 转化率与温度关系如图所示。
转化率与温度关系如图所示。
①c点
②主反应活化能
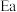 (正)
(正)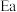 (逆)(填“>”或“<”),代表
(逆)(填“>”或“<”),代表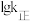 的曲线是
的曲线是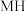 ”或“
”或“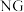 ”)。
”)。③
 温度下达平衡时总压为p,该反应的
温度下达平衡时总压为p,该反应的
(3)生物电化学系统可实现
 合成甲烷。阴极功能微生物
合成甲烷。阴极功能微生物 可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
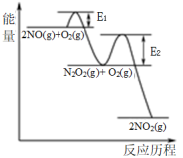
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________ 。
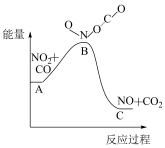
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1mol CO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1mol NO(g) 和1mol CO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g) 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
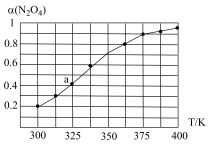
①由图推测该反应的△H___ 0(填“>”或“<”),理由为________________ 。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
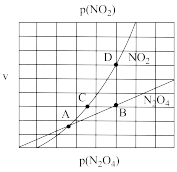
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________ ,在下左图上标出的点中,能表示反应达到平衡状态的点为__________ (填字母代号)。
(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
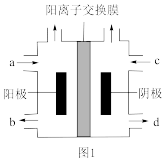
①收集到(CH3)4NOH的区域是______ (填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________ 。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是

A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1mol CO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1mol NO(g) 和1mol CO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)
 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
①由图推测该反应的△H
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=

(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。

①收集到(CH3)4NOH的区域是
②写出电解池总反应(化学方程式)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
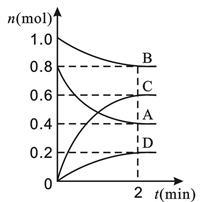
(1)容器中反应的化学方程式为________________ 。
(2)前2 min,v(A)=______________ mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________ 。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________ (保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________ (填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)_______ v(逆)(填“>”“<”或“=”)。

(1)容器中反应的化学方程式为
(2)前2 min,v(A)=
(3)能说明该反应已达到平衡状态的是
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】科学家对航天员在空间站中产生的 循环利用的探索取得诸多成果。按要求回答下列有关问题:
循环利用的探索取得诸多成果。按要求回答下列有关问题:
(1)将航天员呼出的 进行
进行 化反应,完成空间站中
化反应,完成空间站中 和
和 的循环利用。
的循环利用。 分子的空间结构相同的一种阳离子:
分子的空间结构相同的一种阳离子:_______ 。
②标准生成焓(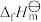 )是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的
)是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的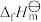 。
。
完善反应器中进行的如下反应即Sabatier反应的热化学方程式:_______ 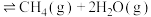

_____ 。
③图中 来自于电解水装置的
来自于电解水装置的_____ (填“阳极产物”或“阴极产物”)
④在恒温密闭刚性反应器中增大Sabatier反应中 的反应速率可行的措施有
的反应速率可行的措施有_______ 。写出一项说明该反应已达到化学平衡的标志:________ 。
⑤写出碱性燃料电池中负极反应式:_______ 。
(2)将航天员呼出的 回收,可利用Bosch反应即
回收,可利用Bosch反应即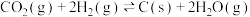 替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol
替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol 和1mol
和1mol 发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。
发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。______ 。
②已知 为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中
为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中 的转化率=
的转化率=______ ;
_______ (写算式,不化简 )。
③加入催化剂(其他条件相同)此反应达平衡时 分压为
分压为_______ 。
 循环利用的探索取得诸多成果。按要求回答下列有关问题:
循环利用的探索取得诸多成果。按要求回答下列有关问题:(1)将航天员呼出的
 进行
进行 化反应,完成空间站中
化反应,完成空间站中 和
和 的循环利用。
的循环利用。
 分子的空间结构相同的一种阳离子:
分子的空间结构相同的一种阳离子:②标准生成焓(
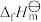 )是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的
)是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的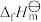 。
。| 物质 |  |  |  |  |
 | a | b | c | 0 |
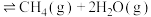

③图中
 来自于电解水装置的
来自于电解水装置的④在恒温密闭刚性反应器中增大Sabatier反应中
 的反应速率可行的措施有
的反应速率可行的措施有⑤写出碱性燃料电池中负极反应式:
(2)将航天员呼出的
 回收,可利用Bosch反应即
回收,可利用Bosch反应即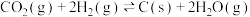 替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol
替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol 和1mol
和1mol 发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。
发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。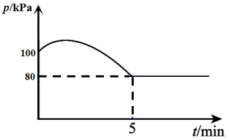
②已知
 为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中
为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中 的转化率=
的转化率=
③加入催化剂(其他条件相同)此反应达平衡时
 分压为
分压为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】2020年世界环境日的宣传主题为“关爱自然,刻不容缓”。防治大气污染、水体污染等是世界各国保护环境的最重要课题。
(1)将 、
、 催化重整为可用的化学品,对改善环境意义重大。
催化重整为可用的化学品,对改善环境意义重大。
①某科研团队利用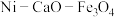 三元催化剂在850℃下“超干重整”
三元催化剂在850℃下“超干重整” 和
和 。
。
已知:反应Ⅰ.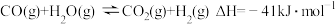
反应Ⅱ.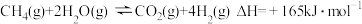
则反应Ⅲ.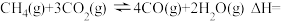
___________ 。
②在体积为1L的刚性容器中进行“合成气催化重整”,反应的化学方程式为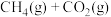

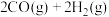 。当投料比
。当投料比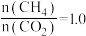 时,
时,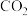 的平衡转化率(
的平衡转化率( )与温度(T),初始压强(p)的关系如图所示。
)与温度(T),初始压强(p)的关系如图所示。
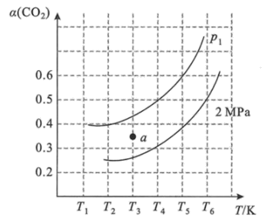
压强p1___________ (填“>”“<”或“=”,下同)2MPa;当温度为T3、压强为p1时,a点时的υ(逆)___________ υ(正);起始时向容器中加入1mol 和1mol
和1mol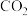 ,在温度为
,在温度为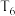 、初始压强为2MPa时反应,该反应的K=
、初始压强为2MPa时反应,该反应的K=___________ 。
(2)氮的氧化物是造成大气污染的主要物质,研究氮氧化物的反应机理更有助于消除大气污染。
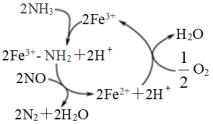
①NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如下图。写出脱硝过程的总反应的化学方程式:___________ 。
②催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为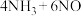
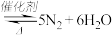 。不同温度条件下,
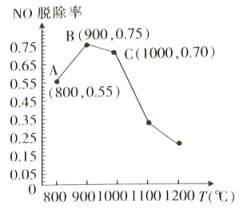
。不同温度条件下,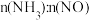 为2:1时,得到NO脱除率曲线如下图所示。脱除NO的最佳温度是
为2:1时,得到NO脱除率曲线如下图所示。脱除NO的最佳温度是___________ 。在温度超过1000℃时NO脱除率骤然下降的原因可能是___________ 。
③NO氧化反应: 分两步进行,反应Ⅰ.
分两步进行,反应Ⅰ. ,反应Ⅱ.
,反应Ⅱ.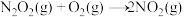 ,其反应过程能量变化示意图如下图。其中决定NO氧化反应速率的步骤是反应
,其反应过程能量变化示意图如下图。其中决定NO氧化反应速率的步骤是反应___________ (填“Ⅰ”或“Ⅱ”)。
(1)将
 、
、 催化重整为可用的化学品,对改善环境意义重大。
催化重整为可用的化学品,对改善环境意义重大。①某科研团队利用
 三元催化剂在850℃下“超干重整”
三元催化剂在850℃下“超干重整” 和
和 。
。已知:反应Ⅰ.
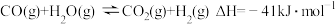
反应Ⅱ.
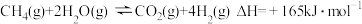
则反应Ⅲ.
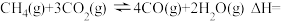
②在体积为1L的刚性容器中进行“合成气催化重整”,反应的化学方程式为
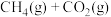

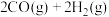 。当投料比
。当投料比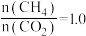 时,
时,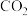 的平衡转化率(
的平衡转化率( )与温度(T),初始压强(p)的关系如图所示。
)与温度(T),初始压强(p)的关系如图所示。
压强p1
 和1mol
和1mol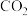 ,在温度为
,在温度为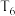 、初始压强为2MPa时反应,该反应的K=
、初始压强为2MPa时反应,该反应的K=(2)氮的氧化物是造成大气污染的主要物质,研究氮氧化物的反应机理更有助于消除大气污染。
①NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如下图。写出脱硝过程的总反应的化学方程式:

②催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为
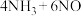
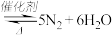 。不同温度条件下,
。不同温度条件下,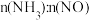 为2:1时,得到NO脱除率曲线如下图所示。脱除NO的最佳温度是
为2:1时,得到NO脱除率曲线如下图所示。脱除NO的最佳温度是
③NO氧化反应:
 分两步进行,反应Ⅰ.
分两步进行,反应Ⅰ. ,反应Ⅱ.
,反应Ⅱ.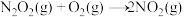 ,其反应过程能量变化示意图如下图。其中决定NO氧化反应速率的步骤是反应
,其反应过程能量变化示意图如下图。其中决定NO氧化反应速率的步骤是反应
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、D、E四种元素均为短周期元素,原子序数逐渐增大。A元素原子的核外电子数、电子层数和最外层电子数均相等。B、D、E三种元素在周期表中的相对位置如图①所示,只有E元素的单质能与水反应生成两种酸,甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素:W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质:X分子含有10个电子。它们之间的转化关系如图②所示。

请回答下列问题:
(1)Z的化学式为_______ ;X分子的空间构型为_______ 。
(2)E的单质与水反应的离子方程式为_______ 。E元素可分别与钙(Ca)、钛(Ti)元素形成化合物,其中CaE2的熔点为782℃,沸点1600℃,TiE4的熔点为-24.1℃,沸点为136.4℃,两者熔沸点差别很大的原因是_______ 。
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为_______ 。
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为_______ ,该温度下的平衡常数为_______ 。

请回答下列问题:
(1)Z的化学式为
(2)E的单质与水反应的离子方程式为
(3)W-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。W-空气燃料电池放电时负极反应式为
(4)将一定量的A2、B2的混合气体放入1L恒容密闭容器中,在200℃下达到平衡。测得平衡气体的总物质的量为0.4mol,其中A2为0.1mol,B2为0.1mol。则该条件下A2的平衡转化率为
您最近一年使用:0次
【推荐3】北京冬奥会上采用二氧化碳跨临界制冰,使人们再次看到了二氧化碳综合化利用的巨大前景,转化 的方法主要有电催化、热还原等。
的方法主要有电催化、热还原等。
(1) 电催化制
电催化制 。在电解过程中向电解质中加入离子导体M(
。在电解过程中向电解质中加入离子导体M(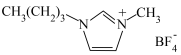 )可以提高
)可以提高 的选择性(
的选择性( 的选择性是指
的选择性是指 转化生成
转化生成 的百分比,下同)。
的百分比,下同)。
①离子导体M中采取 杂化类型的原子有
杂化类型的原子有___________ 。
②电催化还原 制
制 的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图___________ 。

(2) 热还原制
热还原制 和
和 。在
。在 、
、 催化下,
催化下, 和
和 混和气体(体积比1:4)进行反应,测得
混和气体(体积比1:4)进行反应,测得 转化率、
转化率、 和
和 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。
反应Ⅰ: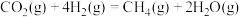

反应Ⅱ:

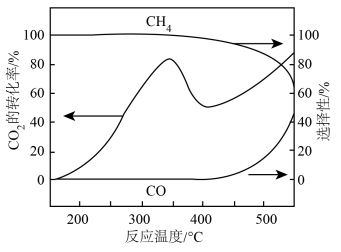
①400℃后,随温度升高 转化率不断上升的原因是
转化率不断上升的原因是___________ 。
②525℃下,向恒容密闭容器中充入上述混合气体进行反应,体系达到平衡时 的体积分数为
的体积分数为___________ ,反应Ⅱ平衡常数K为___________ 。
③反应Ⅱ中 和
和 在
在 (存O空位)催化剂的作用下,可以提高
(存O空位)催化剂的作用下,可以提高 的选择性,反应过程如图所示。从电负性的角度分析,过程①和②能发生的反应机理
的选择性,反应过程如图所示。从电负性的角度分析,过程①和②能发生的反应机理___________ 。

 的方法主要有电催化、热还原等。
的方法主要有电催化、热还原等。(1)
 电催化制
电催化制 。在电解过程中向电解质中加入离子导体M(
。在电解过程中向电解质中加入离子导体M( )可以提高
)可以提高 的选择性(
的选择性( 的选择性是指
的选择性是指 转化生成
转化生成 的百分比,下同)。
的百分比,下同)。①离子导体M中采取
 杂化类型的原子有
杂化类型的原子有②电催化还原
 制
制 的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
的示意图如下图所示。请在虚线框中画出还有可能得到的中间体的结构示意图
(2)
 热还原制
热还原制 和
和 。在
。在 、
、 催化下,
催化下, 和
和 混和气体(体积比1:4)进行反应,测得
混和气体(体积比1:4)进行反应,测得 转化率、
转化率、 和
和 的选择性随温度变化如图所示。
的选择性随温度变化如图所示。
反应Ⅰ:
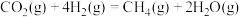

反应Ⅱ:


①400℃后,随温度升高
 转化率不断上升的原因是
转化率不断上升的原因是②525℃下,向恒容密闭容器中充入上述混合气体进行反应,体系达到平衡时
 的体积分数为
的体积分数为③反应Ⅱ中
 和
和 在
在 (存O空位)催化剂的作用下,可以提高
(存O空位)催化剂的作用下,可以提高 的选择性,反应过程如图所示。从电负性的角度分析,过程①和②能发生的反应机理
的选择性,反应过程如图所示。从电负性的角度分析,过程①和②能发生的反应机理
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为___ 未成对电子数为___ 个。
(2)丙酮(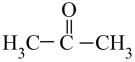 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是___ ,丙酮分子中含有σ键的数目为____ 个。
(3)C、H、O三种元素的电负性由小到大的顺序为___ 。
(4)乙醇的沸点高于丙酮,这是因为___ 。
(5)利用价层电子对互斥理论判断PCl3的立体构型是___ 。
(6)某FexNy的晶胞如图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图-2 所示,其中更活泼的Cu替代型产物的化学式为___ 。
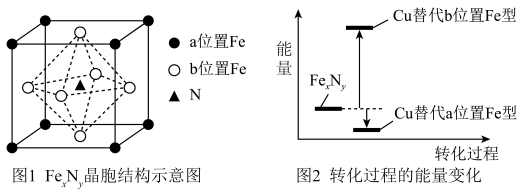
(1)Fe3+基态核外电子排布式为
(2)丙酮(
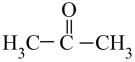 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是(3)C、H、O三种元素的电负性由小到大的顺序为
(4)乙醇的沸点高于丙酮,这是因为
(5)利用价层电子对互斥理论判断PCl3的立体构型是
(6)某FexNy的晶胞如图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图-2 所示,其中更活泼的Cu替代型产物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】环境和资源是时代的主题。回答下列问题。
(1)某环保型可降解泡沫添加剂结构简式如下。
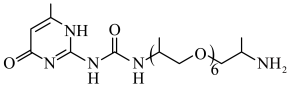
①分子组成中电负性最大的元素是___________ ;依据洪特规则简答:基态时N原子的电子排布应满足___________ 。
②分子中N原子的杂化方式有___________ ,共有___________ 个手性碳原子(即连有四个不同的原子或基团的碳原子);该添加剂具有___________ 性(选填“酸”,“碱”或“中”),从化学键变化的角度阐释具有该性质的原因:___________ 。
(2)稀土矿是制备稀土金属的一种重要资源。下图是某稀土元素A的氧化物晶体的立方晶胞,棱长为apm,An+离子占据立方体半数的四面体空隙。
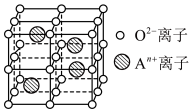
③氧离子的配位数为___________ ,A的氧化物的化学式为___________ 。
④当晶胞中有一半的An+离子被Bn+离子取代时,晶体的密度
___________  (A、B的摩尔质量分别为
(A、B的摩尔质量分别为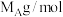 、
、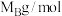 ,
, 代表阿伏伽德罗常数的值)。
代表阿伏伽德罗常数的值)。
(1)某环保型可降解泡沫添加剂结构简式如下。

①分子组成中电负性最大的元素是
②分子中N原子的杂化方式有
(2)稀土矿是制备稀土金属的一种重要资源。下图是某稀土元素A的氧化物晶体的立方晶胞,棱长为apm,An+离子占据立方体半数的四面体空隙。

③氧离子的配位数为
④当晶胞中有一半的An+离子被Bn+离子取代时,晶体的密度

 (A、B的摩尔质量分别为
(A、B的摩尔质量分别为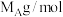 、
、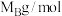 ,
, 代表阿伏伽德罗常数的值)。
代表阿伏伽德罗常数的值)。
您最近一年使用:0次
【推荐3】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_______ 。
(2)硫酸镍溶于氨水形成 [Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是_______ 。
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是_______ 。
③氨的沸点_______ (填“高于”或“低于”)膦(PH3),原因是_______ ;氨是分子_______ (填“极性”或“非极性”),中心原子的轨道杂化类型为_______ 。
(3)单质铜及镍都是由_______ 键形成的晶体;元素铜与镍的第二电离能分别为: ICu=1958 kJ·mol–1、INi=1 753 kJ·mol–1, ICu> INi的原因是_______ 。
(4)某镍白铜合金的立方晶胞结构如图所示。
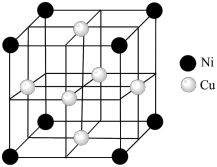
①晶胞中铜原子与镍原子的数量比为_______ 。
②若合金的密度为d g·cm–3,晶胞参数a=_______ nm。
(1)镍元素基态原子的电子排布式为
(2)硫酸镍溶于氨水形成 [Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为配位键,提供孤电子对的成键原子是
③氨的沸点
(3)单质铜及镍都是由
(4)某镍白铜合金的立方晶胞结构如图所示。

①晶胞中铜原子与镍原子的数量比为
②若合金的密度为d g·cm–3,晶胞参数a=
您最近一年使用:0次



