秦始皇帝陵博物院首次在兵马俑的彩绘中发现了古人人工合成的“中国蓝”“中国紫”颜料。通过对这些颜料的研究发现,其成分主要是钡和铜的硅酸盐(BaCuSixOy) 。
回答下列问题:
(1)“中国蓝”的发色与硫酸铜溶液呈天蓝色类似,都是由于形成了[Cu(H2O)4]2+,该配离子中Cu2+提供_______ ,配位原子是_______ ,1 mol [Cu(H2O)4]2+中σ键的数目为_________ 。
(2)写出向硫酸铜溶液里逐滴加入氨水过程中沉淀溶解的离子方程式_______________ ,再向溶液中加入乙醇,会析出深蓝色晶体____________ (写出化学式)。
(3)“中国蓝”“中国紫”中存在 四面体结构,其中Si原子采取的杂化方式为
四面体结构,其中Si原子采取的杂化方式为_______ 。
(4)BaO的熔沸点_____ MgO(填“>”“<”“=”),原因是______________ 。
(5)立方CuO晶胞结构如图所示。其中Cu2+的配位数为_______ 。NA代表阿伏加德罗常数的值,晶胞参数为a pm,则其晶体密度为___________ g·cm-3。
回答下列问题:
(1)“中国蓝”的发色与硫酸铜溶液呈天蓝色类似,都是由于形成了[Cu(H2O)4]2+,该配离子中Cu2+提供
(2)写出向硫酸铜溶液里逐滴加入氨水过程中沉淀溶解的离子方程式
(3)“中国蓝”“中国紫”中存在
 四面体结构,其中Si原子采取的杂化方式为
四面体结构,其中Si原子采取的杂化方式为(4)BaO的熔沸点
(5)立方CuO晶胞结构如图所示。其中Cu2+的配位数为

更新时间:2024/04/26 22:59:10
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】中国政府承诺:力争CO2的排放在2030年前实现“碳达峰”,2060年前实现“碳中和”,CO2的捕集与利用成为当前研究的热点。回答下面问题:
(1)写出CO2的电子式______ ,CO2分子属于______ (填“极性”或“非极性”)分子,其晶体俗名干冰,属于______ 晶体,其晶体内存在的微粒间相互作用有______ 。
(2)研究发现,在CO2合成甲醇(CH3OH)反应中,Co、Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Mn基态原子核外电子排布式为______ 。Co在周期表中属于______ 区元素。甲醇(CH3OH)能够与水任意比互溶,解释其原因是______ 。
(3)金属Zn属于金属晶体,其导电的原因是是______ 。已知金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为______ 。
(4)CaF2的晶胞结构如图所示,X代表的离子是______ ;若该立方晶胞参数为apm,CaF2的摩尔质量用Mg/mol,阿伏伽德罗常数用NA来表示,则CaF2晶体的密度=______ g/cm3(写出表达式),阴阳离子的核间距最小为______ pm。

(1)写出CO2的电子式
(2)研究发现,在CO2合成甲醇(CH3OH)反应中,Co、Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。Mn基态原子核外电子排布式为
(3)金属Zn属于金属晶体,其导电的原因是是
(4)CaF2的晶胞结构如图所示,X代表的离子是

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______ 。基态碳原子的核外电子占有______ 个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、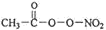 (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______ 。1mol PAN 中含有的σ键数目为______ 。组成PAN 的元素的电负性大小顺序为______ 。
②相同压强下,HCOOH 的沸点比 CH3OCH3______ (填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+、H9O4+ 等微粒的形式。请画出 H5O2的结构式:______ 。
(4)硅和碳在同一主族。下图为 SiO2晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______ nm。
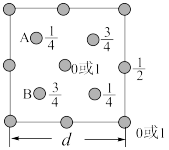 (d 的单位为 nm)
(d 的单位为 nm)
(1)宇宙中含量最多的元素是氢和
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、
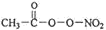 (PAN)等二次污染物。
(PAN)等二次污染物。①PAN 中 C 的杂化方式有
②相同压强下,HCOOH 的沸点比 CH3OCH3
(3)水溶液中有 H3O+、H5O2+、H9O4+ 等微粒的形式。请画出 H5O2的结构式:
(4)硅和碳在同一主族。下图为 SiO2晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是
 (d 的单位为 nm)
(d 的单位为 nm)
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
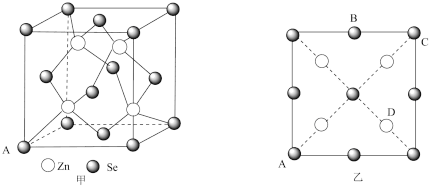
【推荐3】锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等三十多种对人体有益的微量元素。
(1)基态Ge原子的价电子排布图为_______ 。
(2)Ni(CO)4常温下为无色液体,沸点42.1°C,熔点−19.3°C,难溶于水,易溶于有机溶剂。推测Ni(CO)4是_______ 分子(“极性”或“非性极”)。
(3)Co2+可与 形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为
形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为_______ (用元素符号表示), 中N的杂化方式为
中N的杂化方式为_______ 。
(4)氨气中H−N−H键的键角为107.3°,[Zn(NH3)6]2+离子中H−N−H键的键角_______ 107.3°(填“大于”“小于”或“等于”),原因是:_______ 。
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为( ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为_______ ;已知晶胞边长为apm,阿伏加德罗常数的值为NA,该晶胞密度ρ为_______ g·cm-3(只列出计算式)。
(1)基态Ge原子的价电子排布图为
(2)Ni(CO)4常温下为无色液体,沸点42.1°C,熔点−19.3°C,难溶于水,易溶于有机溶剂。推测Ni(CO)4是
(3)Co2+可与
 形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为
形成配离子[Co(NO3)4]2−,该配离子中各元素的第一电离能由小到大的顺序为 中N的杂化方式为
中N的杂化方式为(4)氨气中H−N−H键的键角为107.3°,[Zn(NH3)6]2+离子中H−N−H键的键角
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,乙图为甲图的俯视图,A点原子的坐标为(0,0,0),B点原子的坐标为(
 ,1,
,1, ),则C点原子的坐标为
),则C点原子的坐标为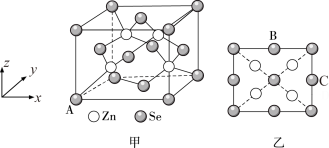
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】我国将力争在2030年前实现碳达峰,2060年前实现碳中和的目标,因此二氧化碳的固定以及转化将成为重要的研究课题。
I.在 催化下CO2和H2反应生成甲醇:
催化下CO2和H2反应生成甲醇: 。
。
II.新型 水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。
水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。
请回答下列问题:
(1)I中涉及的CO2、H2、CH3OH、H2O,属于非极性分子的是___________ ,基态O原子核外有___________ 种不同空间运动状态的电子。
(2)HCOOH分子中σ键和π键数目之比为___________ 。
(3)反应 中,碳原子的杂化方式由
中,碳原子的杂化方式由___________ 转变为___________ 。CH3OH的沸点高于CH3SH,原因是___________ 。
(4)一种铜的配合物为 ,其配体为
,其配体为___________ 。
I.在
 催化下CO2和H2反应生成甲醇:
催化下CO2和H2反应生成甲醇: 。
。II.新型
 水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。
水介质电池放电时,温室气体CO2被转化为储氢物质HCOOH。请回答下列问题:
(1)I中涉及的CO2、H2、CH3OH、H2O,属于非极性分子的是
(2)HCOOH分子中σ键和π键数目之比为
(3)反应
 中,碳原子的杂化方式由
中,碳原子的杂化方式由(4)一种铜的配合物为
 ,其配体为
,其配体为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】铁在史前就为人们所用。在人类文明发展过程中,铁所起的作用是其他任何元素都不能比拟的。请回答下列问题:
(1)基态铁原子中,价电子电子云的伸展方向有_______ 种。
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有_________ ( 填序号);
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是___________________ 。
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、 的相互作用分别为
的相互作用分别为_______________ 、_____________ 。
②比较 中的键角∠O−S−O
中的键角∠O−S−O________ H2O中的键角∠H−O−H。 (填“<” “>”或“=”)
(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是___________ 。
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为_____________________ 。

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=____________ cm3·mol−1 (已知阿伏加德罗常数为NA,晶体的摩尔体积是指单位物质的量晶体所占的体积)。
(1)基态铁原子中,价电子电子云的伸展方向有
(2)五羰基合铁[Fe(CO)5]分解制铁晶体,反应过程中断裂和形成的化学键有
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键 F.范德华力
Fe(CO)5中各元素电负性的大小顺序是
(3)绿矾(FeSO4·7H2O)结构如图。

①H2O分别与Fe2+、
 的相互作用分别为
的相互作用分别为②比较
 中的键角∠O−S−O
中的键角∠O−S−O(4)铁的化合物种类众多,其中FeF3的熔点高于1000°C,而FeBr3的熔点只有200°C,原因是
(5)铁的一种配位化合物(普鲁士蓝)中铁氰骨架结构如图(a)所所示,骨架为正六面体,K+位于骨架的正六面体的空穴中,以平衡铁氰骨架的负电荷,则该钾盐的化学式为

(6)一种锂电池的正极材料磷酸铁锂(LiFePO4) 的晶胞结构如上图(b)所示。其中Li+分别位于顶角、棱心、面心,O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。磷酸铁锂晶体的晶胞参数分别为anm、bnm,则磷酸铁锂晶体的摩尔体积Vm=
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】金属钛被誉为“二十一世纪金属”,有“生物金属,海洋金属,太空金属”的美称,具有广泛的应用前景。回答下列问题:
(1)钛原子核外电子有_____ 种空间运动状态;Ti2+电子占据的最高能层的电子排布式为______ 。
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO 的空间构型是
的空间构型是_____ ,第一电离能介于Al、P之间的第三周期元素为______ (填元素符号)。
(3)Ti(BH4)2是一种储氢材料,其中电负性最小的元素为______ ,B原子的杂化方式是_____ ,其中的 可由BH3和H-结合而成。
可由BH3和H-结合而成。 含有
含有______ 。(填序号)
①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(4)TiO2在自然界中有三种同素异形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种变体中最稳定的一种,其晶胞如图所示,该晶体的密度为_____ g•cm-3(设阿伏伽德罗常数的值为NA,用含a、b、NA的代数式表示)。
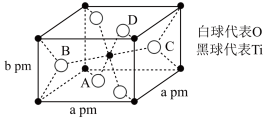
(1)钛原子核外电子有
(2)磷酸钛铝锂可用作锂离子电池的正极材料,PO
 的空间构型是
的空间构型是(3)Ti(BH4)2是一种储氢材料,其中电负性最小的元素为
 可由BH3和H-结合而成。
可由BH3和H-结合而成。 含有
含有①σ键 ②π键 ③氢键 ④配位键 ⑤离子键
(4)TiO2在自然界中有三种同素异形态,即金红石型、锐钛型和斜钛型三种,其中金红石型是三种变体中最稳定的一种,其晶胞如图所示,该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)科学家常利用________ ,区分晶体硅和无定形硅。
(2)已知Ge、Cl两元素电负性分别为1.8和3.0,试判断 中的化学键为
中的化学键为________ (填“共价键”或“离子键”)。
(3)硒常用作光敏材料,根据元素周期律,原子半径:Ga________ As(填“>”或“<”,下同)。第一电离能:Ga________ As。与硒同周期的p区元素中第一电离能大于硒的元素有________ 种; 的空间结构是
的空间结构是________ 。
(4) 、
、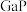 、
、 都是很好的半导体材料,熔点如表所示,分析其变化原因
都是很好的半导体材料,熔点如表所示,分析其变化原因________ :
(5)硒化锌( )也是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
)也是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是________ ;已知晶胞边长为 ,乙图为甲图的俯视图,A点坐标为
,乙图为甲图的俯视图,A点坐标为 ,B点坐标为
,B点坐标为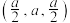 ,则D点坐标为
,则D点坐标为________ ;若该晶体密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
________ (只列出计算式)。
(1)科学家常利用
(2)已知Ge、Cl两元素电负性分别为1.8和3.0,试判断
 中的化学键为
中的化学键为(3)硒常用作光敏材料,根据元素周期律,原子半径:Ga
 的空间结构是
的空间结构是(4)
 、
、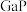 、
、 都是很好的半导体材料,熔点如表所示,分析其变化原因
都是很好的半导体材料,熔点如表所示,分析其变化原因| 物质 |  | 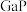 |  |
| 熔点℃ | 1700 | 1480 | 1238 |
 )也是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
)也是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是 ,乙图为甲图的俯视图,A点坐标为
,乙图为甲图的俯视图,A点坐标为 ,B点坐标为
,B点坐标为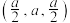 ,则D点坐标为
,则D点坐标为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)基态F原子的核外电子排布式是_____ ,C原子的最高能级的电子云轮廓图是_____ 形。
(2)B、C、D元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是_______ ;B、C元素的这些氢化物的熔、沸点相差较大的主要原因是_______ 。
(4)A、B、D可形成分子式为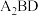 的某化合物,则该化合物分子中B原子的杂化类型是
的某化合物,则该化合物分子中B原子的杂化类型是_______ ;1mol该分子中含有π键的数目是_______ 。
(5)由A、D、E三种元素组成的两种常见化合物的酸性由强到弱的顺序为____ (用化学式表示)。
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是_______ ,若该立方晶胞的棱长为a,阿伏加德罗常数用NA表示,该晶体的密度表示为_______ ,

(1)基态F原子的核外电子排布式是
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是
(4)A、B、D可形成分子式为
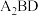 的某化合物,则该化合物分子中B原子的杂化类型是
的某化合物,则该化合物分子中B原子的杂化类型是(5)由A、D、E三种元素组成的两种常见化合物的酸性由强到弱的顺序为
(6)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为_____ ;1mol O22+中含有的 键数目为
键数目为____ 。
(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为______ 。
(3)乙炔与氢氰酸反应可得丙烯腈 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是____ ;分子中处于同一直线上的原子数目最多为_____ 。
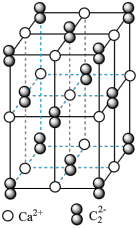
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_____ 。
①甲醇的沸点比甲醛高,其主要原因是____________ ;甲醛分子中碳原子的轨道杂化类型为____________ 。
②甲醛分子的空间构型是________________ ;1mol甲醛分子中σ键的数目为__________ 。_______ 。
(1)CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为
 键数目为
键数目为(2)将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2,红棕色沉淀。Cu+基态核外电子排布式为
(3)乙炔与氢氰酸反应可得丙烯腈
 。丙烯腈分子中碳原子轨道杂化类型是
。丙烯腈分子中碳原子轨道杂化类型是(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为
①甲醇的沸点比甲醛高,其主要原因是
②甲醛分子的空间构型是
您最近一年使用:0次



