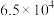工业废气中H₂S的回收利用有重要意义。
I.利用H2S 制CS2。
(1)热解H2S和CH4的混合气体制H2和CS2。
①2H2S(g) =2H2(g)+S2(g) ΔH1=+170kJmol-1
②CH4(g)+S2(g)=CS2(g)+2H2(g) ΔH2=+64kJmol-1
总反应:2H2S(g)+CH4(g) =CS2 (g)+4H2(g),ΔH=___________ 。
(2)CH4的电子式为___________ ,CS2分子的立体构型为___________ 。
(3)工业上还可以利用硫(S8) 与CH4为原料制备 CS2,S8受热分解成气态 S2, 发生反应 2S2(g)+CH4(g) =CS2(g)+2H2S(g), 某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与 CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________
②当以下数值不变时,能说明该反应达到平衡的是___________ (填序号)。
a.气体密度 b. 气体总压 c.CH4 与S2体积比 d.CS2的体积分数
③一定条件下,CH4与 S2反应中 CH2的平衡转化率、S8分解产生 S2的体积分数随温度的变化由线如下图所示,据图分析,生成 CS2的反应为___________ (填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________ 。
(4)回收单质硫。将三分之一的H2S燃烧。产生的SO2与其余H2S混合反应:2H2S(g)+SO2(g)
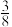 S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=
S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=_________ ;
(5)回收H2S。用一定浓度Na2S溶液吸一定量的H2S,当溶液中c(H2S)=c(S2-)时,溶液pH=_________ (用含m、n的式子)。(已知H2S的两步电离常数Ka1=m,Ka2=n)
I.利用H2S 制CS2。
(1)热解H2S和CH4的混合气体制H2和CS2。
①2H2S(g) =2H2(g)+S2(g) ΔH1=+170kJmol-1
②CH4(g)+S2(g)=CS2(g)+2H2(g) ΔH2=+64kJmol-1
总反应:2H2S(g)+CH4(g) =CS2 (g)+4H2(g),ΔH=
(2)CH4的电子式为
(3)工业上还可以利用硫(S8) 与CH4为原料制备 CS2,S8受热分解成气态 S2, 发生反应 2S2(g)+CH4(g) =CS2(g)+2H2S(g), 某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与 CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度 b. 气体总压 c.CH4 与S2体积比 d.CS2的体积分数
③一定条件下,CH4与 S2反应中 CH2的平衡转化率、S8分解产生 S2的体积分数随温度的变化由线如下图所示,据图分析,生成 CS2的反应为
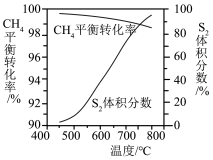
(4)回收单质硫。将三分之一的H2S燃烧。产生的SO2与其余H2S混合反应:2H2S(g)+SO2(g)

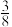 S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=
S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5mol/L,c(SO2)=5.0×10-5mol/L,c(H2O)=4.0×10-3mol/L,计算该温度下的平衡常数K=(5)回收H2S。用一定浓度Na2S溶液吸一定量的H2S,当溶液中c(H2S)=c(S2-)时,溶液pH=
2024·天津和平·二模 查看更多[2]
更新时间:2024-05-21 19:38:10
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】乙二醇是一种重要的化工原料,可用于生产聚酯纤维、防冻剂、增塑剂等。由合成气直接法制乙二醇的主要反应如下:
反应Ⅰ
反应Ⅱ
(1)已知298K、101kPa下, ,
, ,则
,则
_______  。
。
(2)在恒压密闭容器中充入合成气 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
则
____________ (填“>”或“<”)0,随着温度升高所需压强增大的原因是_____________________ 。
(3)在2L刚性容器中充入合成气 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。
①测得 和
和 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为_____________  。
。
②平衡时,若 和
和 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为_______ ,反应Ⅰ的平衡常数
___________ (用含x的式子表示)。(已知: 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)
(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。
 图2
图2
结合图1,图2,从速率角度解释CO分压增大 选择性升高的原因
选择性升高的原因_________________ 。
反应Ⅰ

反应Ⅱ

(1)已知298K、101kPa下,
 ,
, ,则
,则
 。
。(2)在恒压密闭容器中充入合成气
 ,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:
,仅考虑发生反应Ⅰ,维持10%转化率,所需反应条件(温度、压强)如表:温度T/K | 298.15 | 300 | 354.7 | 400 |
压强P/kPa | 5.73 | 6.38 | 49.27 | 260.99 |
反应Ⅰ平衡常数K |
|
| 1 |
|

(3)在2L刚性容器中充入合成气
 ,总压
,总压 ,温度473K,催化剂
,温度473K,催化剂 (含
(含 )下进行反应。
)下进行反应。①测得
 和
和 的时空收率分别为
的时空收率分别为 和
和 (时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用
(时空收率是指催化剂中单位质量Rh在单位时间内所获得的产物量),则用 表示的反应速率为
表示的反应速率为 。
。②平衡时,若
 和
和 体积分数相等,
体积分数相等, 的分压为
的分压为 ,则
,则 的选择性为
的选择性为
 的选择性
的选择性 ;分压=总压×物质的量分数。)
;分压=总压×物质的量分数。)(4)合成气直接法制乙二醇的反应Ⅰ、反应Ⅱ的反应历程(部分)如图1,一定条件下CO分压对选择性影响如图2所示。

 图2
图2结合图1,图2,从速率角度解释CO分压增大
 选择性升高的原因
选择性升高的原因
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】工业合成氨与制备硝酸一般可连续生产,流程如下:
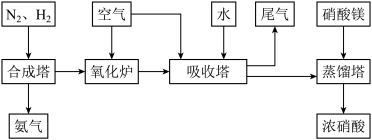
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g) CO2(g)+H2(g)。
CO2(g)+H2(g)。
①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=___ 。
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=___ 。
(2)合成塔中发生反应为:N2(g)+3H2(g) 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1___ 573K(填“>”、“<”或“=”)。
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2 4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因
4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因___ 。

(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___ 。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:___ 。

(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)
 CO2(g)+H2(g)。
CO2(g)+H2(g)。①t℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=
(2)合成塔中发生反应为:N2(g)+3H2(g)
 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2
 4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因
4NO+6H2O △H=-905kJ·mol-1,不同温度下NO产率如图所示。温度高于900℃时,NO产率下降的可能原因
(4)吸收塔中反应为:3NO2+H2O
 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
您最近一年使用:0次
【推荐3】为了实现“碳达峰、碳中和”的目标,可以用 为碳源制取多种化学物质。
为碳源制取多种化学物质。
(1) 与
与 在固载金属催化剂上发生反应:
在固载金属催化剂上发生反应: ,下列叙述正确的是___________(填字母)。
,下列叙述正确的是___________(填字母)。
(2) 与
与 合成尿素的反应为
合成尿素的反应为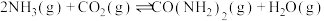 ,下图是合成尿素的历程及能量变化,TS表示过渡态。
,下图是合成尿素的历程及能量变化,TS表示过渡态。___________ 个基元反应,其中决速步骤的方程式是___________ 。
(3)以 、
、 为原料合成
为原料合成 的主要反应如下:
的主要反应如下:
Ⅰ.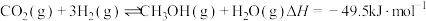
Ⅱ.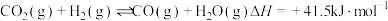
①不同条件下,按照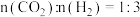 投料,同时发生反应Ⅰ和反应Ⅱ,
投料,同时发生反应Ⅰ和反应Ⅱ, 的平衡转化率如图甲所示。
的平衡转化率如图甲所示。___________ (填“正向”、“逆向”或“不”)移动;压强为 时,温度高于300℃后,
时,温度高于300℃后, 的平衡转化率随温度升高而增大的主要原因是
的平衡转化率随温度升高而增大的主要原因是___________ 。
②在温度为T℃下,将amol 和bmol
和bmol 充入容积为VL的恒容密闭容器中,同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图乙所示。图中缺少一种组分(CO)的分压变化,T℃时,反应Ⅰ的平衡常数
充入容积为VL的恒容密闭容器中,同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图乙所示。图中缺少一种组分(CO)的分压变化,T℃时,反应Ⅰ的平衡常数
___________ 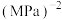 (用分压代替浓度,计算结果保留两位有效数字)。
(用分压代替浓度,计算结果保留两位有效数字)。 电催化还原为乙烯,如下图所示,写出阴极的电极反应式:
电催化还原为乙烯,如下图所示,写出阴极的电极反应式:___________ ;若电解前两极区溶液的质量相等,电解一段时间后,阴阳两极共收集气体(标准状况下)8.96L(假设气体全部逸出),两极区溶液的质量差为___________ g。
 为碳源制取多种化学物质。
为碳源制取多种化学物质。(1)
 与
与 在固载金属催化剂上发生反应:
在固载金属催化剂上发生反应: ,下列叙述正确的是___________(填字母)。
,下列叙述正确的是___________(填字母)。| A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快 |
| B.恒温、恒容条件下,加入氢气,活化分子百分数增大,反应速率加快 |
| C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快 |
| D.加入合适的催化剂,能实现单位时间内转化率增大 |
(2)
 与
与 合成尿素的反应为
合成尿素的反应为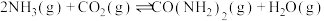 ,下图是合成尿素的历程及能量变化,TS表示过渡态。
,下图是合成尿素的历程及能量变化,TS表示过渡态。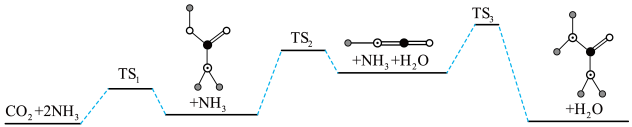
(3)以
 、
、 为原料合成
为原料合成 的主要反应如下:
的主要反应如下:Ⅰ.
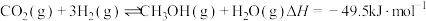
Ⅱ.
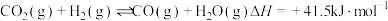
①不同条件下,按照
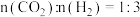 投料,同时发生反应Ⅰ和反应Ⅱ,
投料,同时发生反应Ⅰ和反应Ⅱ, 的平衡转化率如图甲所示。
的平衡转化率如图甲所示。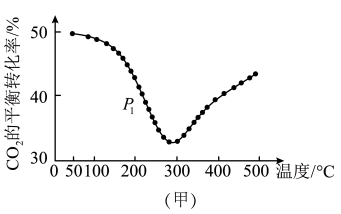
 时,温度高于300℃后,
时,温度高于300℃后, 的平衡转化率随温度升高而增大的主要原因是
的平衡转化率随温度升高而增大的主要原因是②在温度为T℃下,将amol
 和bmol
和bmol 充入容积为VL的恒容密闭容器中,同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图乙所示。图中缺少一种组分(CO)的分压变化,T℃时,反应Ⅰ的平衡常数
充入容积为VL的恒容密闭容器中,同时发生反应Ⅰ和反应Ⅱ,体系中各组分分压(各组分分压=总压×各组分物质的量分数)随时间的变化情况如图乙所示。图中缺少一种组分(CO)的分压变化,T℃时,反应Ⅰ的平衡常数
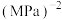 (用分压代替浓度,计算结果保留两位有效数字)。
(用分压代替浓度,计算结果保留两位有效数字)。
 电催化还原为乙烯,如下图所示,写出阴极的电极反应式:
电催化还原为乙烯,如下图所示,写出阴极的电极反应式: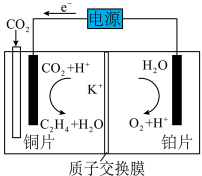
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】清洁能源的综合利用可有效降低碳排放,是实现“碳中和、碳达峰”的重要途径。
(1)一种借助光将 转化为
转化为 的催化机理如图所示。
的催化机理如图所示。
 转化为
转化为 过程总反应的热化学方程式是
过程总反应的热化学方程式是________ ;该反应在________ (填“高温”、“低温”或“任意温度”)下能自发进行。
(2)采用真空封管法制备磷化硼纳米颗粒,成功实现了高选择性电催化还原 制备甲醇(
制备甲醇( ),该反应历程如图所示。
),该反应历程如图所示。________ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式________ 。
(3)工业中, 和
和 在催化剂作用下可发生两个平行反应,分别生成CO和
在催化剂作用下可发生两个平行反应,分别生成CO和 。
。
反应a:

反应b:
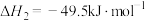
在传统的催化固定反应床(CFBR)中, 转化率和甲醇选择性通常都比较低,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器(CMR),极大地改善了该问题,原理如图所示
转化率和甲醇选择性通常都比较低,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器(CMR),极大地改善了该问题,原理如图所示 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。已知:
的平衡转化率和甲醇选择性的相关实验数据如下表所示。已知: 选择性
选择性
①在CMR模式下,上述条件下发生反应,下列不能说明反应b达到平衡状态的标志是________ (填标号)。
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C.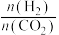 不再变化 D.混合气体的密度不再变化
不再变化 D.混合气体的密度不再变化
②由表中数据可知CMR模式下, 的转化率明显提高,结合具体反应分析可能的原因
的转化率明显提高,结合具体反应分析可能的原因________ 。
③压力平衡常数 是指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
是指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压 的物质的量分数。根据表中数据计算CFBR模式下,温度为230℃时,反应b的
的物质的量分数。根据表中数据计算CFBR模式下,温度为230℃时,反应b的 值为
值为________ (写数值表达式,无需计算结果)。
(1)一种借助光将
 转化为
转化为 的催化机理如图所示。
的催化机理如图所示。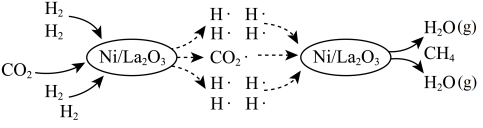
 转化为
转化为 过程总反应的热化学方程式是
过程总反应的热化学方程式是(2)采用真空封管法制备磷化硼纳米颗粒,成功实现了高选择性电催化还原
 制备甲醇(
制备甲醇( ),该反应历程如图所示。
),该反应历程如图所示。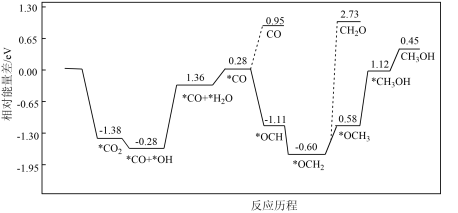
②上述合成甲醇的反应速率较慢,要使反应速率加快,需要降低某步骤的能量变化,写出该基元反应的化学方程式
(3)工业中,
 和
和 在催化剂作用下可发生两个平行反应,分别生成CO和
在催化剂作用下可发生两个平行反应,分别生成CO和 。
。反应a:


反应b:

在传统的催化固定反应床(CFBR)中,
 转化率和甲醇选择性通常都比较低,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器(CMR),极大地改善了该问题,原理如图所示
转化率和甲醇选择性通常都比较低,科学团队研制了一种具有反应和分离双功能的分子筛膜催化反应器(CMR),极大地改善了该问题,原理如图所示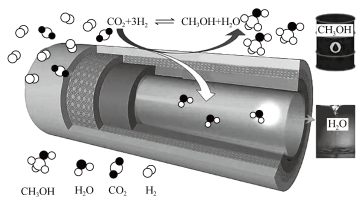
 投入一定量
投入一定量 和
和 ,不同反应模式下
,不同反应模式下 的平衡转化率和甲醇选择性的相关实验数据如下表所示。已知:
的平衡转化率和甲醇选择性的相关实验数据如下表所示。已知: 选择性
选择性
实验组 | 反应模式 |
| 压强/MPa | 温度/℃ |
|
|
① | CFBR | 3 | 5 | 250 | 25.6 | 61.3 |
② | CFBR | 3 | 5 | 230 | 20.0 | 70.0 |
③ | CMR | 3 | 5 | 260 | 36.1 | 100 |
A.气体压强不再变化 B.气体平均相对分子质量不再变化
C.
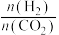 不再变化 D.混合气体的密度不再变化
不再变化 D.混合气体的密度不再变化②由表中数据可知CMR模式下,
 的转化率明显提高,结合具体反应分析可能的原因
的转化率明显提高,结合具体反应分析可能的原因③压力平衡常数
 是指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压
是指用平衡分压代替平衡浓度进行计算的平衡常数,A的平衡分压 的物质的量分数。根据表中数据计算CFBR模式下,温度为230℃时,反应b的
的物质的量分数。根据表中数据计算CFBR模式下,温度为230℃时,反应b的 值为
值为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】甲醇是重要的化工原料,甲醇的制备与应用也是国际研究的热点。
I.某温度下,利用 生产甲醇主要涉及以下反应。
生产甲醇主要涉及以下反应。
反应1.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)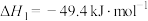 ;
;
反应2.CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ;
;
(1)反应1自发进行的条件是___________ (填“高温”、“低温”或“任意温度”)。
(2)升高温度,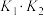 的值将
的值将___________ (填“增大”、“减小”或“不变”)。
(3)向绝热恒容密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是___________(填编号)。
(4)在恒温密闭容器中,发生反应1和反应2,CO2的平衡转化率[α(CO2)%]和甲醇选择性[CH3OH%= ]随着温度变化关系如图所示。
]随着温度变化关系如图所示。___________ 。
②分析温度高于236°C后CO2转化率下降的原因___________ 。
③在244°C,向容积为V的容器内投入1molCO2(g)和3molH2(g)充分反应,计算平衡时生成CH3OH的物质的量为___________ mol(计算结果保留两位有效数字)。
II.工业上也可用电化学法制备甲醇。
(5)采用如图原电池制备甲醇。通入CO的一端发生的电极反应为___________ 。
I.某温度下,利用
 生产甲醇主要涉及以下反应。
生产甲醇主要涉及以下反应。反应1.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
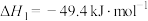 ;
;
反应2.CO2(g)+H2(g) ⇌ CO(g)+H2O(g)
 ;
;
(1)反应1自发进行的条件是
(2)升高温度,
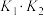 的值将
的值将(3)向绝热恒容密闭容器中充入等物质的量的CO2(g)和H2(g)发生上述反应,下列可说明反应已达平衡状态的是___________(填编号)。
| A.容器内温度不变 | B.混合气体平均密度保持不变 |
| C.CH3OH的体积分数保持不变 | D.v正(CO2)=v逆(CO) |
 ]随着温度变化关系如图所示。
]随着温度变化关系如图所示。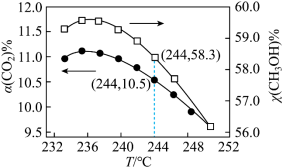
②分析温度高于236°C后CO2转化率下降的原因
③在244°C,向容积为V的容器内投入1molCO2(g)和3molH2(g)充分反应,计算平衡时生成CH3OH的物质的量为
II.工业上也可用电化学法制备甲醇。
(5)采用如图原电池制备甲醇。通入CO的一端发生的电极反应为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
①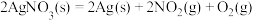
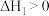
②
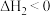
(1)温度 时,在
时,在 的恒容密闭容器中投入
的恒容密闭容器中投入 并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:
并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:

①下列情况能说明体系达到平衡状态的是___________ (填字母)。
a.混合气体的平均相对分子质量不再改变 b. 的浓度不再改变
的浓度不再改变
c. 的体积分数不再改变 d.混合气体的密度不再改变
的体积分数不再改变 d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强 ,反应开始到
,反应开始到 内
内 的平均反应速率为
的平均反应速率为___________  ,在该温度下
,在该温度下 的平衡常数
的平衡常数
___________  (结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
(结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
③实验测得 ,
, ,
, 为速率常数且只受温度影响。则化学平衡常数K与速率常数
为速率常数且只受温度影响。则化学平衡常数K与速率常数 的数学关系是
的数学关系是
___________ 。若将容器的温度改变为 时,其
时,其 ,则
,则
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为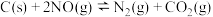 ,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入
,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入 和
和 ,使二者的浓度均增加至原来的两倍,此时反应
,使二者的浓度均增加至原来的两倍,此时反应
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种 电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为
电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为 和
和 ,并实现其定向通过),在该电池工作过程中,
,并实现其定向通过),在该电池工作过程中, 电极上发生的电极反应式为
电极上发生的电极反应式为___________ ,若有 (标准状况下)参加反应,
(标准状况下)参加反应, 电极质量增加
电极质量增加___________ g。

①
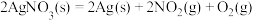
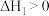
②

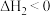
(1)温度
 时,在
时,在 的恒容密闭容器中投入
的恒容密闭容器中投入 并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:
并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:
①下列情况能说明体系达到平衡状态的是
a.混合气体的平均相对分子质量不再改变 b.
 的浓度不再改变
的浓度不再改变c.
 的体积分数不再改变 d.混合气体的密度不再改变
的体积分数不再改变 d.混合气体的密度不再改变②若达到平衡时,混合气体的总压强
 ,反应开始到
,反应开始到 内
内 的平均反应速率为
的平均反应速率为 ,在该温度下
,在该温度下 的平衡常数
的平衡常数
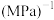 (结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
(结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。③实验测得
 ,
, ,
, 为速率常数且只受温度影响。则化学平衡常数K与速率常数
为速率常数且只受温度影响。则化学平衡常数K与速率常数 的数学关系是
的数学关系是
 时,其
时,其 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为
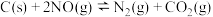 ,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入
,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入 和
和 ,使二者的浓度均增加至原来的两倍,此时反应
,使二者的浓度均增加至原来的两倍,此时反应
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种
 电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为
电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为 和
和 ,并实现其定向通过),在该电池工作过程中,
,并实现其定向通过),在该电池工作过程中, 电极上发生的电极反应式为
电极上发生的电极反应式为 (标准状况下)参加反应,
(标准状况下)参加反应,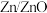 电极质量增加
电极质量增加
您最近一年使用:0次
【推荐1】甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1451.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-556.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___ 。
(2)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1___ 0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为___ ,此时的温度为___ (从上表中选择)。
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:用该电池电解(惰性电极)500ml某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8gCu(OH)2固体。则原CuSO4溶液的物质的量浓度为___ mol·L-1(假设电解前后溶液体积不变)。
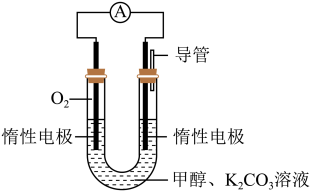
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1451.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-556.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2①下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:用该电池电解(惰性电极)500ml某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8gCu(OH)2固体。则原CuSO4溶液的物质的量浓度为

您最近一年使用:0次
【推荐2】苯硫酚(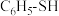 )是一种用途广泛的有机合成中间体。工业上常用氯苯(
)是一种用途广泛的有机合成中间体。工业上常用氯苯(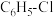 )和硫化氢(
)和硫化氢( )反应制备苯硫酚,该反应常伴有副产物苯(
)反应制备苯硫酚,该反应常伴有副产物苯(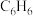 )生成,发生如下反应:
)生成,发生如下反应:
①主反应: ;
;
②副反应: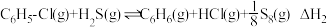 。
。
查阅相关资料可知,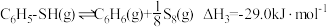 。
。
回答下列问题:
(1)在副反应中,反应物的键能总和_______ (填“>”、“<”或“=”)生成物的键能总和。
(2)为了提高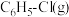 的转化率,可采取的措施有
的转化率,可采取的措施有_______ (填一种即可)。
(3)在一定温度下,往容积为 的恒容密闭容器中,充入
的恒容密闭容器中,充入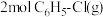 和
和 ,发生上述反应,
,发生上述反应, 时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为
时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为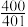 ,
,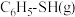 的物质的量分数为25%。
的物质的量分数为25%。
①副反应中生成苯的物质的量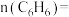
_______  。
。
② 时,
时,
_______  ,
,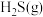 的转化率为
的转化率为_______ %。
③该温度下,主反应的平衡常数
_______ (写出计算式即可)。
④下列叙述能用来判断上述反应已达到平衡状态的是_______ (填标号)。
A.混合气体的总质量不再随时间改变
B.混合气体的总压强不再随时间改变
C.混合气体的密度不再随时间改变
D.混合气体的相对分子质量不再随时间改变
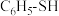 )是一种用途广泛的有机合成中间体。工业上常用氯苯(
)是一种用途广泛的有机合成中间体。工业上常用氯苯(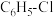 )和硫化氢(
)和硫化氢( )反应制备苯硫酚,该反应常伴有副产物苯(
)反应制备苯硫酚,该反应常伴有副产物苯(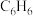 )生成,发生如下反应:
)生成,发生如下反应:①主反应:
 ;
;②副反应:
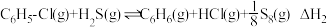 。
。查阅相关资料可知,
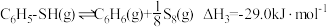 。
。回答下列问题:
(1)在副反应中,反应物的键能总和
(2)为了提高
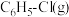 的转化率,可采取的措施有
的转化率,可采取的措施有(3)在一定温度下,往容积为
 的恒容密闭容器中,充入
的恒容密闭容器中,充入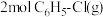 和
和 ,发生上述反应,
,发生上述反应, 时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为
时,反应达到平衡,此时测得容器中反应前后混合气体的总压强之比为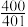 ,
,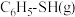 的物质的量分数为25%。
的物质的量分数为25%。①副反应中生成苯的物质的量
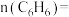
 。
。②
 时,
时,
 ,
,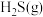 的转化率为
的转化率为③该温度下,主反应的平衡常数

④下列叙述能用来判断上述反应已达到平衡状态的是
A.混合气体的总质量不再随时间改变
B.混合气体的总压强不再随时间改变
C.混合气体的密度不再随时间改变
D.混合气体的相对分子质量不再随时间改变
您最近一年使用:0次
【推荐3】2022年冬奥会的国家速滑馆“冰丝带”采用二氧化碳跨临界制冰, 的资源化可以
的资源化可以 推动经济高质量发展和生态环境质量的持续改善。
推动经济高质量发展和生态环境质量的持续改善。
Ⅰ.二氧化碳催化加氢可合成低碳烯烃,合成乙烯( )的反应为:
)的反应为:

 ,该过程分两步进行:
,该过程分两步进行:
第一步:
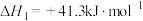
第二步: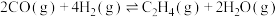
(1)
_______  ,该反应在
,该反应在_______ (填“高温”“低温”或“任何温度”)下能自发进行。
(2)在恒容密闭容器中,起始压强相同,反应温度、投料比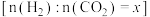 对
对 平衡转化率的影响如图所示。据图判断:
平衡转化率的影响如图所示。据图判断:
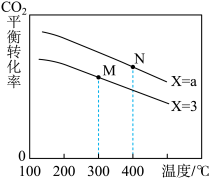
①a_______ 3(填“>”、“<”或“=”)
②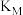
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
Ⅱ.以与为原料可以合成尿素 。主要反应可表示为
。主要反应可表示为
 。
。
(3)T℃时,若向容积为2L的密闭容器中加入3mol 和1mol
和1mol ,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
_______ 。若保持其他条件不变,向该容器中再加入1mol 和1mol
和1mol ,
, 的转化率将
的转化率将_______ (填“增大”、“减小”或“不变”)。
(4)在恒温恒容条件下,能说明反应已达平衡状态的是_______ (填序号)。
①混合气体的压强不变
②单位时间内生成1mol 同时消耗了1mol
同时消耗了1mol
③混合气体的密度保持不变
④
⑤平衡时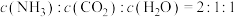
⑥断裂6mol 键同时断裂2mol
键同时断裂2mol 键
键
 的资源化可以
的资源化可以 推动经济高质量发展和生态环境质量的持续改善。
推动经济高质量发展和生态环境质量的持续改善。Ⅰ.二氧化碳催化加氢可合成低碳烯烃,合成乙烯(
 )的反应为:
)的反应为:
 ,该过程分两步进行:
,该过程分两步进行:第一步:

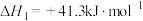
第二步:
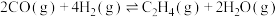
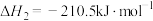
(1)

 ,该反应在
,该反应在(2)在恒容密闭容器中,起始压强相同,反应温度、投料比
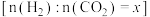 对
对 平衡转化率的影响如图所示。据图判断:
平衡转化率的影响如图所示。据图判断:
①a
②
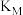
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)Ⅱ.以与为原料可以合成尿素
 。主要反应可表示为
。主要反应可表示为
 。
。(3)T℃时,若向容积为2L的密闭容器中加入3mol
 和1mol
和1mol ,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
,达到平衡时,容器内压强为开始时的0.75倍。则该反应平衡常数
 和1mol
和1mol ,
, 的转化率将
的转化率将(4)在恒温恒容条件下,能说明反应已达平衡状态的是
①混合气体的压强不变
②单位时间内生成1mol
 同时消耗了1mol
同时消耗了1mol
③混合气体的密度保持不变
④

⑤平衡时
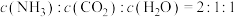
⑥断裂6mol
 键同时断裂2mol
键同时断裂2mol 键
键
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】二氧化碳加氢可转化为二甲醚( ),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
(1) 加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:
加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:


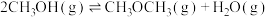
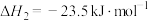
则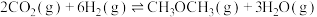 的
的
___________  。
。
(2)向一容积为2L的恒容密闭容器中通入2 moL 和6 mol
和6 mol  ,一定温度下发生反应
,一定温度下发生反应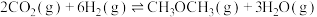 。起始总压为p Pa,20 min时达到化学平衡状态,测得
。起始总压为p Pa,20 min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。
①平衡时总压为___________ Pa。
②达到化学平衡状态时,下列有关叙述正确的是___________ (填标号)。
A.
B.容器内气体压强不再发生改变
C.向容器内通入少量氦气,则平衡向正反应方向移动
D.向容器内再通入1 mol 和3 mol
和3 mol  ,重新达到平衡后,
,重新达到平衡后, 的体积分数增大
的体积分数增大
③0~20 min内,用 表示的平均反应速率
表示的平均反应速率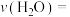
___________ , 的平衡浓度
的平衡浓度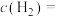
___________ 。该温度下,反应的平衡常数
___________ 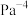 (用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)工业上,以一定比例混合的 与
与 的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应
的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应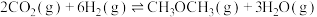 。
。 转化率与温度的关系如图所示。在催化剂II作用下,温度高于
转化率与温度的关系如图所示。在催化剂II作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是___________ 。

 ),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:
),既可以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。回答下列问题:(1)
 加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:
加氢合成甲醇以及甲醇脱水生成二甲醚的热化学方程式如下:

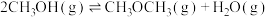
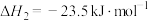
则
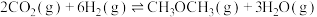 的
的
 。
。(2)向一容积为2L的恒容密闭容器中通入2 moL
 和6 mol
和6 mol  ,一定温度下发生反应
,一定温度下发生反应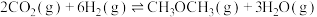 。起始总压为p Pa,20 min时达到化学平衡状态,测得
。起始总压为p Pa,20 min时达到化学平衡状态,测得 的物质的量分数为12.5%。
的物质的量分数为12.5%。①平衡时总压为
②达到化学平衡状态时,下列有关叙述正确的是
A.

B.容器内气体压强不再发生改变
C.向容器内通入少量氦气,则平衡向正反应方向移动
D.向容器内再通入1 mol
 和3 mol
和3 mol  ,重新达到平衡后,
,重新达到平衡后, 的体积分数增大
的体积分数增大③0~20 min内,用
 表示的平均反应速率
表示的平均反应速率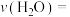
 的平衡浓度
的平衡浓度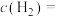

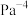 (用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用含p的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(3)工业上,以一定比例混合的
 与
与 的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应
的混合气体以一定流速分别通过填充有催化剂I、催化剂II的反应器,发生反应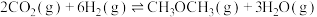 。
。 转化率与温度的关系如图所示。在催化剂II作用下,温度高于
转化率与温度的关系如图所示。在催化剂II作用下,温度高于 时,
时, 转化率下降的原因可能是
转化率下降的原因可能是
您最近一年使用:0次
【推荐2】随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g) NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g) (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
则ΔH3=___________ (用含ΔH1、ΔH2的代数式表示)。
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g) CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS___________ 0(填“>”“<”或“=”),该反应的ΔH___________ 0(填“>”或“<”)。
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是___________ (填字母代号)。
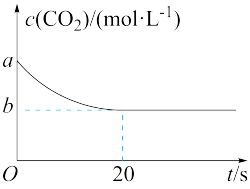
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)T ℃下,反应前20 s的平均反应速率v(H2)=___________ (用含a、b的代数式表示)。
(4)T ℃下,该反应的平衡常数K=___________ (用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)___________ ;CO2转化率___________ (填“增大”“减小”或“不变”)。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g)
 NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH12NH3(l)+H2O(l)+CO2(g)
 (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2(NH4)2CO3(aq)+H2O(l)+CO2(g)
 2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3则ΔH3=
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g)
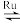 CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。(1)该反应的ΔS
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是

A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)T ℃下,反应前20 s的平均反应速率v(H2)=
(4)T ℃下,该反应的平衡常数K=
(5)若降低温度,反应重新达到平衡,则v(正)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】“碳达峰·碳中和”是我国社会发展重大战略之一, 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:
Ⅰ.
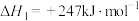 ,
,
Ⅱ.
 ,
,
(1)有利于提高 平衡转化率的条件是_______。
平衡转化率的条件是_______。
(2)反应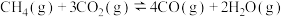 的
的
_______  。
。
(3)恒压,750℃时, 和
和 按物质的量之比
按物质的量之比 投料,反应经如下流程(主要产物已标出)可实现
投料,反应经如下流程(主要产物已标出)可实现 高效转化为
高效转化为 。
。

①假设各步均转化完全,下列说法正确的是_______ 。(填序号)
A.过程ⅰ和过程ⅱ中均发生了氧化还原反应
B.过程ⅱ中使用的催化剂为 和
和
C.过程ⅱ, 吸收
吸收 可促使
可促使 氧化
氧化 的平衡正移
的平衡正移
D.相比于反应Ⅰ,该流程的总反应还原 需要吸收的能量更多
需要吸收的能量更多
②过程ⅱ平衡后通入惰性气体 ,测得一段时间内
,测得一段时间内 物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升,根据过程ⅲ,结合平衡移动原理,解释 物质的量上升的原因
物质的量上升的原因_______ 。
(4) 还原能力(R)可衡量
还原能力(R)可衡量 转化效率,
转化效率,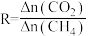 (同一时段内
(同一时段内 与
与 的物质的量变化量之比)。
的物质的量变化量之比)。
①常压下 和
和 按物质的量之比
按物质的量之比 投料,某一时段内
投料,某一时段内 和
和 的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。
的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。______

②催化剂X可改变R值,另一时段内 转化率、R值随温度变化如下表,下列说法不正确的是
转化率、R值随温度变化如下表,下列说法不正确的是_______ 。
A.催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中 占比越高
占比越高
C.温度升高, 转化率增加,
转化率增加, 转化率降低,R值减小
转化率降低,R值减小
D.改变催化剂提高 转化率,R值不一定增大
转化率,R值不一定增大
 还原
还原 是实现“双碳”经济的有效途径之一,相关的主要反应有:
是实现“双碳”经济的有效途径之一,相关的主要反应有:Ⅰ.

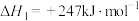 ,
,
Ⅱ.

 ,
,
(1)有利于提高
 平衡转化率的条件是_______。
平衡转化率的条件是_______。| A.低温低压 | B.低温高压 | C.高温低压 | D.高温高压 |
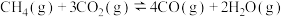 的
的
 。
。(3)恒压,750℃时,
 和
和 按物质的量之比
按物质的量之比 投料,反应经如下流程(主要产物已标出)可实现
投料,反应经如下流程(主要产物已标出)可实现 高效转化为
高效转化为 。
。
①假设各步均转化完全,下列说法正确的是
A.过程ⅰ和过程ⅱ中均发生了氧化还原反应
B.过程ⅱ中使用的催化剂为
 和
和
C.过程ⅱ,
 吸收
吸收 可促使
可促使 氧化
氧化 的平衡正移
的平衡正移D.相比于反应Ⅰ,该流程的总反应还原
 需要吸收的能量更多
需要吸收的能量更多②过程ⅱ平衡后通入惰性气体
 ,测得一段时间内
,测得一段时间内 物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升,根据过程ⅲ,结合平衡移动原理,解释 物质的量上升的原因
物质的量上升的原因(4)
 还原能力(R)可衡量
还原能力(R)可衡量 转化效率,
转化效率,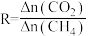 (同一时段内
(同一时段内 与
与 的物质的量变化量之比)。
的物质的量变化量之比)。①常压下
 和
和 按物质的量之比
按物质的量之比 投料,某一时段内
投料,某一时段内 和
和 的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。
的转化率随温度变化如图1,请在图2中画出400~1000℃之间R的变化趋势,并标明1000℃时R值。
②催化剂X可改变R值,另一时段内
 转化率、R值随温度变化如下表,下列说法不正确的是
转化率、R值随温度变化如下表,下列说法不正确的是| 温度/℃ | 480 | 500 | 520 | 550 |
 转化率/% 转化率/% | 11.5 | 20.2 | 34.8 | 46.9 |
| R | 2.6 | 2.4 | 2.1 | 1.8 |
B.温度越低,含氢产物中
 占比越高
占比越高C.温度升高,
 转化率增加,
转化率增加, 转化率降低,R值减小
转化率降低,R值减小D.改变催化剂提高
 转化率,R值不一定增大
转化率,R值不一定增大
您最近一年使用:0次