Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=_________ kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:
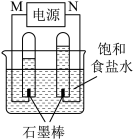
①燃料电池即电源的N极的电极反应式为________________________ 。
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为_______________ 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为: 2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的 。
。
①该反应的平衡常数K=______________ (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____ (填序号)。
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是________ ,0~15minCO2的平均反应速率v(CO2)=____ (保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是____ (填序号)。
A.增加CO的量 B.加入催化剂 C.减小CO2的量 D.扩大容器体积
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有:

①燃料电池即电源的N极的电极反应式为
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为: 2NO(g)+2CO(g)
 N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的
 。
。①该反应的平衡常数K=
②判断该反应达到平衡的标志是
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是
A.增加CO的量 B.加入催化剂 C.减小CO2的量 D.扩大容器体积
更新时间:2016-12-09 08:02:37
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】 Ⅰ.氢气在工业合成中应用广泛。
二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①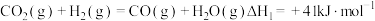
②
(1)总反应的
___________  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号)。
A. B.
B.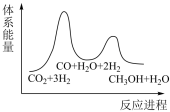
C.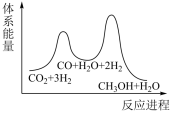 D.
D.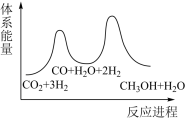
(2)根据以上信息判断 与
与 制取甲醇的反应在
制取甲醇的反应在___________ (填高温或低温)条件下可自发进行。
(3)当温度为 ,反应①的化学平衡常数
,反应①的化学平衡常数 ,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时上述的反应①中正、逆反应速率的关系式是___________(填代号)。
Ⅱ. 可以消除氮氧化物的污染,主要反应原理为
可以消除氮氧化物的污染,主要反应原理为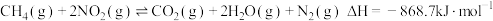 ,在
,在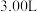 密闭容器中通入
密闭容器中通入 和
和 ,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P)的数据见下表(提示:恒温恒容条件下压强与气体的物质的量成正比):
,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P)的数据见下表(提示:恒温恒容条件下压强与气体的物质的量成正比):
(4)由表中数据计算,达到平衡时 的转化率为
的转化率为___________ ,该温度下的平衡常数
___________ 。
Ⅲ.氮的化合物在生产、生活中广泛存在。键能是将理想气体分子AB拆开为中性气态原子A和B所需的能量。已知化学键的键能如下表:
(5)写出 气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式:
气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式:___________ 。
二氧化碳加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①
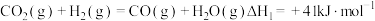
②

(1)总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A.
 B.
B.
C.
 D.
D.
(2)根据以上信息判断
 与
与 制取甲醇的反应在
制取甲醇的反应在(3)当温度为
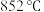 ,反应①的化学平衡常数
,反应①的化学平衡常数 ,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
,某时刻测得该温度下的密闭容器中各物质的物质的量见下表: |  |  |  |
 | 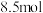 | 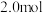 | 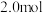 |
A.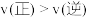 | B.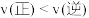 | C. | D.无法判断 |
Ⅱ.
 可以消除氮氧化物的污染,主要反应原理为
可以消除氮氧化物的污染,主要反应原理为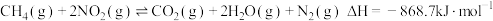 ,在
,在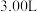 密闭容器中通入
密闭容器中通入 和
和 ,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P)的数据见下表(提示:恒温恒容条件下压强与气体的物质的量成正比):
,在一定温度下进行上述反应,反应时间(t)与容器内气体总压强(P)的数据见下表(提示:恒温恒容条件下压强与气体的物质的量成正比):反应时间 | 0 | 2 | 4 | 6 | 8 | 10 |
总压强 | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 的转化率为
的转化率为
Ⅲ.氮的化合物在生产、生活中广泛存在。键能是将理想气体分子AB拆开为中性气态原子A和B所需的能量。已知化学键的键能如下表:
| 化学键 |  |  |  |  |  |
键能/ | 946 | 497 | 193 | 391 | 463 |
 气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式:
气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】I.化学反应过程既是物质的转化过程,也是能量的转化过程。
(1)t℃时,关于 、
、 的两个反应的信息如下表所示:
的两个反应的信息如下表所示:
请写出t℃时, 被NO氧化生成无毒气体的热化学方程式
被NO氧化生成无毒气体的热化学方程式___________ (反应热用a、b、c、d代数式表示)。
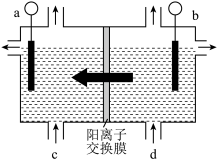
(2)二氧化氯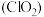 为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出如图所示用电解法制取
为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出如图所示用电解法制取 的新工艺。用石墨作电极,在一定条件下电解饱和食盐水制取
的新工艺。用石墨作电极,在一定条件下电解饱和食盐水制取 。产生
。产生 的电极反应式为
的电极反应式为___________ 。
II.亚硝酰氯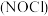 是有机合成中的重要试剂。实验室可用如下反应合成亚硝酰氯:
是有机合成中的重要试剂。实验室可用如下反应合成亚硝酰氯:

(3)T℃下,向某真空恒容密闭容器中加入足量的 并充入一定量的
并充入一定量的 ,发生反应II:
,发生反应II: 和反应I,测得起始压强为
和反应I,测得起始压强为 ,达到平衡时NOCl(g)的压强为
,达到平衡时NOCl(g)的压强为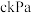 。若此温度下,反应II的平衡常数
。若此温度下,反应II的平衡常数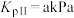 ,则平衡时NO的转化率为
,则平衡时NO的转化率为___________ ;该温度下,反应I的平衡常数
___________ 。(用气体物质的平衡分压代替平衡浓度,分压=总压×物质的量分数,用含a、b、c的代数式表示)
(4)反应 的速率方程式可表示为
的速率方程式可表示为 ,
,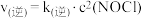 其中
其中 、
、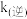 代表正、逆反应的速率常数,与温度、催化剂等有关,与浓度无关。已知:
代表正、逆反应的速率常数,与温度、催化剂等有关,与浓度无关。已知: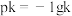 。下图中所示有2条直线分别代表
。下图中所示有2条直线分别代表 、
、 与
与 的关系,其中代表
的关系,其中代表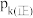 与
与 关系的直线是
关系的直线是___________ (填字母)。理由是___________ 。

(5)一定条件下向恒容密闭容器中按一定比例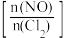 充入
充入 和
和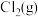 发生反应I,平衡时体系中
发生反应I,平衡时体系中 体积分数
体积分数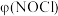 随
随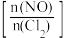 的变化如图所示,则NO转化率最大的是
的变化如图所示,则NO转化率最大的是___________ (填“A” “B”或“C”)点,当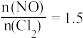 时,表示平衡状态时的
时,表示平衡状态时的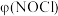 可能是
可能是___________ (填“D”“E”或“F”)点。
(1)t℃时,关于
 、
、 的两个反应的信息如下表所示:
的两个反应的信息如下表所示:| 化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平移常数 |
 | 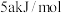 | 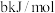 |  |
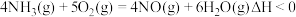 | 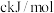 | 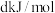 |  |
 被NO氧化生成无毒气体的热化学方程式
被NO氧化生成无毒气体的热化学方程式(2)二氧化氯
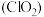 为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出如图所示用电解法制取
为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出如图所示用电解法制取 的新工艺。用石墨作电极,在一定条件下电解饱和食盐水制取
的新工艺。用石墨作电极,在一定条件下电解饱和食盐水制取 。产生
。产生 的电极反应式为
的电极反应式为
II.亚硝酰氯
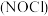 是有机合成中的重要试剂。实验室可用如下反应合成亚硝酰氯:
是有机合成中的重要试剂。实验室可用如下反应合成亚硝酰氯:

(3)T℃下,向某真空恒容密闭容器中加入足量的
 并充入一定量的
并充入一定量的 ,发生反应II:
,发生反应II: 和反应I,测得起始压强为
和反应I,测得起始压强为 ,达到平衡时NOCl(g)的压强为
,达到平衡时NOCl(g)的压强为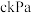 。若此温度下,反应II的平衡常数
。若此温度下,反应II的平衡常数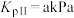 ,则平衡时NO的转化率为
,则平衡时NO的转化率为
(4)反应
 的速率方程式可表示为
的速率方程式可表示为 ,
,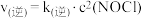 其中
其中 、
、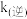 代表正、逆反应的速率常数,与温度、催化剂等有关,与浓度无关。已知:
代表正、逆反应的速率常数,与温度、催化剂等有关,与浓度无关。已知: 。下图中所示有2条直线分别代表
。下图中所示有2条直线分别代表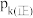 、
、 与
与 的关系,其中代表
的关系,其中代表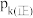 与
与 关系的直线是
关系的直线是
(5)一定条件下向恒容密闭容器中按一定比例
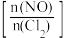 充入
充入 和
和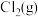 发生反应I,平衡时体系中
发生反应I,平衡时体系中 体积分数
体积分数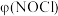 随
随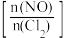 的变化如图所示,则NO转化率最大的是
的变化如图所示,则NO转化率最大的是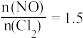 时,表示平衡状态时的
时,表示平衡状态时的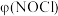 可能是
可能是
您最近一年使用:0次
【推荐3】甲醇是重要的化工原料之一,也可用作燃料,利用合成气(主要成分为CO、CO2和H2)可以合成甲醇,涉及的反应如下:
反应ⅰ: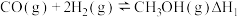
反应ⅱ:
反应ⅲ:
请回答下列问题:
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):___________ (填“较低”或“较高”)温度下才能自发进行。
②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式:___________ 。
③
___________ (计算结果保留两位有效数字,已知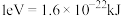 )。
)。
(2)反应ⅰ的Arrhenius经验公式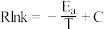 (
( 为活化能,
为活化能, 为速率常数,
为速率常数, 和
和 均为常数,
均为常数, 为温度),实验数据如图中曲线
为温度),实验数据如图中曲线 所示。当改变外界条件时,实验数据如图中曲线
所示。当改变外界条件时,实验数据如图中曲线 所示,则实验可能改变的外界条件是
所示,则实验可能改变的外界条件是___________ 。 和
和 充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得
充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得 的平衡转化率、
的平衡转化率、 的选择性[
的选择性[ ]和
]和 的选择性[
的选择性[ ]随压强的变化曲线如图所示。
]随压强的变化曲线如图所示。___________ (填“m”“n”或“p”),简述判断方法:___________ 。
(4)有研究认为,在某催化剂作用下反应ⅱ先后通过反应ⅲ、ⅰ来实现。保持温度 不变,向一恒容密闭容器中充入4molCO2和8molH2,在该催化剂作用下发生反应,经5min达到平衡,测得H2O(g)的物质的量为3mol,起始及达平衡时容器的总压强分别为
不变,向一恒容密闭容器中充入4molCO2和8molH2,在该催化剂作用下发生反应,经5min达到平衡,测得H2O(g)的物质的量为3mol,起始及达平衡时容器的总压强分别为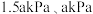 ,则从开始到平衡用H2分压表示的平均反应速率为
,则从开始到平衡用H2分压表示的平均反应速率为___________ kPa•min-1(用含 的式子表示,下同,分压
的式子表示,下同,分压 总压
总压 物质的量分数);反应ⅱ的压强平衡常数
物质的量分数);反应ⅱ的压强平衡常数
___________ 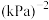 (
( 为用分压代替浓度计算的平衡常数)。
为用分压代替浓度计算的平衡常数)。
(5)光催化CO2制甲醇技术也是研究热点。铜基纳米光催化材料还原CO2的机理如图所示,光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。在低能价带上,H2O直接转化为O2的电极反应式为
,具有强氧化性)。在低能价带上,H2O直接转化为O2的电极反应式为___________ 。
反应ⅰ:
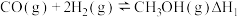
反应ⅱ:

反应ⅲ:

请回答下列问题:
(1)在某催化剂作用下,反应ⅰ的反应历程如图所示(图中数据表示微粒数目以及微粒的相对总能量,*表示吸附在催化剂上):

②结合反应历程,写出反应ⅰ中生成甲醇的决速步骤的反应方程式:
③

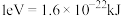 )。
)。(2)反应ⅰ的Arrhenius经验公式
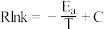 (
( 为活化能,
为活化能, 为速率常数,
为速率常数, 和
和 均为常数,
均为常数, 为温度),实验数据如图中曲线
为温度),实验数据如图中曲线 所示。当改变外界条件时,实验数据如图中曲线
所示。当改变外界条件时,实验数据如图中曲线 所示,则实验可能改变的外界条件是
所示,则实验可能改变的外界条件是
 和
和 充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得
充入密闭容器中并加入合适的催化剂,只发生反应ⅱ和ⅲ。相同温度下,在不同压强下测得 的平衡转化率、
的平衡转化率、 的选择性[
的选择性[ ]和
]和 的选择性[
的选择性[ ]随压强的变化曲线如图所示。
]随压强的变化曲线如图所示。
(4)有研究认为,在某催化剂作用下反应ⅱ先后通过反应ⅲ、ⅰ来实现。保持温度
 不变,向一恒容密闭容器中充入4molCO2和8molH2,在该催化剂作用下发生反应,经5min达到平衡,测得H2O(g)的物质的量为3mol,起始及达平衡时容器的总压强分别为
不变,向一恒容密闭容器中充入4molCO2和8molH2,在该催化剂作用下发生反应,经5min达到平衡,测得H2O(g)的物质的量为3mol,起始及达平衡时容器的总压强分别为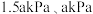 ,则从开始到平衡用H2分压表示的平均反应速率为
,则从开始到平衡用H2分压表示的平均反应速率为 的式子表示,下同,分压
的式子表示,下同,分压 总压
总压 物质的量分数);反应ⅱ的压强平衡常数
物质的量分数);反应ⅱ的压强平衡常数
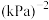 (
( 为用分压代替浓度计算的平衡常数)。
为用分压代替浓度计算的平衡常数)。(5)光催化CO2制甲醇技术也是研究热点。铜基纳米光催化材料还原CO2的机理如图所示,光照时,低能价带失去电子并产生空穴(
 ,具有强氧化性)。在低能价带上,H2O直接转化为O2的电极反应式为
,具有强氧化性)。在低能价带上,H2O直接转化为O2的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】研究氮、碳及其化合物的资源化利用具有重要的意义。回答下列问题:

(1)已知氢气还原氮气合成氨在低温下自发进行。若将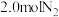 和
和 通入体积为
通入体积为 的密闭容器中,分别在
的密闭容器中,分别在 和
和 温度下进行反应。曲线
温度下进行反应。曲线 表示
表示 温度下
温度下 的变化,曲线
的变化,曲线 表示
表示 温度下
温度下 的变化,
的变化, 温度下反应到
温度下反应到 点恰好达到平衡。
点恰好达到平衡。
①温度
_________ (填“>”、“<”或“=”,下同) .
. 温度下恰好平衡时,曲线
温度下恰好平衡时,曲线 上的点为
上的点为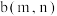 ,则m
,则m______________ 12,n_________ 2;
② 温度下,若某时刻容器内气体的压强为起始时的
温度下,若某时刻容器内气体的压强为起始时的 ,则此时v(正)
,则此时v(正)______ (填“>”、“<”或“=”)v(逆)。
(2) 在
在 催化下,同时发生以下反应。
催化下,同时发生以下反应。
Ⅰ.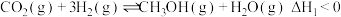
Ⅱ.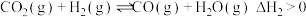
在容积不变的密闭容器中,保持温度不变,充入一定量的 和
和 ,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示:
,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示:
若容器内反应Ⅰ、Ⅱ均达到平衡时,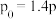 ,反应Ⅰ的平衡常数
,反应Ⅰ的平衡常数
______________ 。(用含 的式子表示,分压=总压×气体物质的量分数)
的式子表示,分压=总压×气体物质的量分数)

(1)已知氢气还原氮气合成氨在低温下自发进行。若将
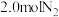 和
和 通入体积为
通入体积为 的密闭容器中,分别在
的密闭容器中,分别在 和
和 温度下进行反应。曲线
温度下进行反应。曲线 表示
表示 温度下
温度下 的变化,曲线
的变化,曲线 表示
表示 温度下
温度下 的变化,
的变化, 温度下反应到
温度下反应到 点恰好达到平衡。
点恰好达到平衡。①温度

 .
. 温度下恰好平衡时,曲线
温度下恰好平衡时,曲线 上的点为
上的点为 ,则m
,则m②
 温度下,若某时刻容器内气体的压强为起始时的
温度下,若某时刻容器内气体的压强为起始时的 ,则此时v(正)
,则此时v(正)(2)
 在
在 催化下,同时发生以下反应。
催化下,同时发生以下反应。Ⅰ.
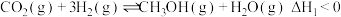
Ⅱ.
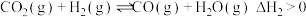
在容积不变的密闭容器中,保持温度不变,充入一定量的
 和
和 ,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示:
,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示: |  |  |  |  | 总压强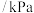 | |
起始 | 0.5 | 0.9 | 0 | 0 | 0 |  |
平衡 | 0.3 |  |
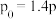 ,反应Ⅰ的平衡常数
,反应Ⅰ的平衡常数
 的式子表示,分压=总压×气体物质的量分数)
的式子表示,分压=总压×气体物质的量分数)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】已知:反应aA(g)+bB(g)⇌cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________ (用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
(3)哪一时间段反应速率最大______ (填0~1、1~2、2~3、3~4、4~5、5~6 min)
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________ (填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液

(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)⇌1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol−1
反应b:2C(s)+N2O4(g)⇌N2(g)+2CO2(g) ΔH=-28.2kJ·mol−1
则NO2生成N2O4的热化学方程式为____ 。
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH=-34.0 kJ·mol−1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是___ (填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=___ 。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:
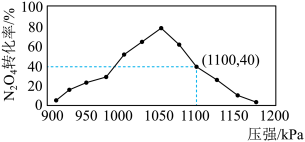
在1.1×106 Pa时该反应的化学平衡常数Kp=___ (结果保留两位有效数字。已知:气体分压(p分)=气体总压(p总)×体积分数)。
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)⇌5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是____ (填字母)。
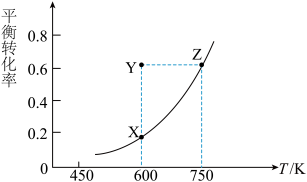
A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为___ 。(精确到0.1%)
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)⇌1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol−1
反应b:2C(s)+N2O4(g)⇌N2(g)+2CO2(g) ΔH=-28.2kJ·mol−1
则NO2生成N2O4的热化学方程式为
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH=-34.0 kJ·mol−1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
| 时间/min 浓度/mol·L−1 物质 | 0 | 5 | 10 | 15 | 20 | 25 |
| NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
| N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:

在1.1×106 Pa时该反应的化学平衡常数Kp=
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)⇌5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是

A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.0 kJ• mol-1
CH3OH(g) △H1=-90.0 kJ• mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2
回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=________ kJ • mol-1。(已知:H2O(1)=H2O(g) △H=+44.0 kJ/mol)
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是_______ mol·L-1·min-1,可逆反应②的平衡常数K2=_________ 。
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正_______ v逆(填“>”、“< ”或“=”)。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是_______ 。
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =_________ (填数值)。
(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为____________ 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做__________ 。
①CO(g)+2H2(g)
 CH3OH(g) △H1=-90.0 kJ• mol-1
CH3OH(g) △H1=-90.0 kJ• mol-1②2CH3OH(g)
 CH3OCH3(g)+ H2O(g) △H2
CH3OCH3(g)+ H2O(g) △H2 回答下列问题:
(1)若由合成气(CO、H2)制备lmolCH3OCH3(g),且生成H2O(1),整个过程中放出的热量为244kJ,则△H2=
(2)有人模拟该制备原理,500K时,在2L的密闭容器中充入2molCO和6mol H2,5min达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2mol·L-1,用H2表示反应①的速率是
若在500K时,测得容器中n(CH3OCH3)=2n(CH3OH),此时反应②的v正
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,下列说法正确的是
A.在平衡移动过程中逆反应速率先增大后减小
B.容器中CH3OCH3的体积分数增大
C.容器中混合气体的平均相对分子质量减小
D.达到新平衡后体系的压强增大
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a =

(5)绿色电源“二甲醚燃料电池”的结构图所示,电解质为熔融态的碳酸盐(如熔融 K2CO3),其中CO2会参与电极反应。工作时负极的电极反应为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】“氯碱工业”以电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。
请回答:
(1)电解饱和食盐水制取氯气的化学方程式是___________ 。
(2)下列说法不正确 的是___________。
(3)工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4,相应的化学方程式为:
Ⅰ TiO2(s)+2Cl2(g) TiCl4(g)+O2(g) ΔHⅠ=181 kJ・mol-1, KⅠ=3.4×10-29
TiCl4(g)+O2(g) ΔHⅠ=181 kJ・mol-1, KⅠ=3.4×10-29
Ⅱ 2C(s)+O2(g) 2CO(g) ΔHⅡ= -221 kJ・mol-1,KⅡ=1.1×1048
2CO(g) ΔHⅡ= -221 kJ・mol-1,KⅡ=1.1×1048
Ⅲ TiO2(s)+2Cl2(g)+2C(s) TiCl4(g)+2CO(g) ΔHⅢ ,KⅢ
TiCl4(g)+2CO(g) ΔHⅢ ,KⅢ
反应Ⅲ的KⅢ为___________ 。(保留3位有效数字)
结合数据说明反应Ⅲ___________ 自发进行。
A.高温下能够自发进行 B.低温下能够自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(4)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2 (g) Cl2(aq) K1=c(Cl2)/p
Cl2(aq) K1=c(Cl2)/p
Cl 2(aq)+H2O(l) H+(aq)+Cl-(aq)+HClO(aq) K2
H+(aq)+Cl-(aq)+HClO(aq) K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g) Cl2(aq)的焓变△H1
Cl2(aq)的焓变△H1___________ 0。(填“>”、“=”或“<”)
②平衡常数K2的表达式为K2___________ 。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c___________ 。(用平衡压强和上述平衡常数表示,忽略HClO的电离)
请回答:
(1)电解饱和食盐水制取氯气的化学方程式是
(2)下列说法
| A.可采用碱石灰干燥氯气 |
| B.可通过排饱和食盐水法收集氯气 |
| C.常温下,可通过加压使氯气液化而储存于钢瓶中 |
| D.工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸 |
Ⅰ TiO2(s)+2Cl2(g)
 TiCl4(g)+O2(g) ΔHⅠ=181 kJ・mol-1, KⅠ=3.4×10-29
TiCl4(g)+O2(g) ΔHⅠ=181 kJ・mol-1, KⅠ=3.4×10-29Ⅱ 2C(s)+O2(g)
 2CO(g) ΔHⅡ= -221 kJ・mol-1,KⅡ=1.1×1048
2CO(g) ΔHⅡ= -221 kJ・mol-1,KⅡ=1.1×1048Ⅲ TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(g)+2CO(g) ΔHⅢ ,KⅢ
TiCl4(g)+2CO(g) ΔHⅢ ,KⅢ反应Ⅲ的KⅢ为
结合数据说明反应Ⅲ
A.高温下能够自发进行 B.低温下能够自发进行
C.任何温度都能自发进行 D.任何温度都不能自发进行
(4)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2 (g)
 Cl2(aq) K1=c(Cl2)/p
Cl2(aq) K1=c(Cl2)/pCl 2(aq)+H2O(l)
 H+(aq)+Cl-(aq)+HClO(aq) K2
H+(aq)+Cl-(aq)+HClO(aq) K2其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)
 Cl2(aq)的焓变△H1
Cl2(aq)的焓变△H1②平衡常数K2的表达式为K2
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
 .回答下列问题。
.回答下列问题。
(1)汽车在行驶过程中有如下反应发生:

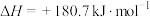

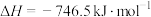
写出表示CO燃烧热的热化学方程式为___________ 。
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(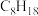 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为___________ (保留三位有效数字)。若实际空燃比大于此值,则该汽车尾气的主要污染物为___________ 。
(3)在汽车上安装三元催化转化器可实现反应:
 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
该反应在1~4s内的平均反应速率为
___________ 。反应达平衡时压强为100kPa,求压强平衡常数
___________  。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)
 .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出): 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
(4)研究表明,合成氨的速率与相关物质的浓度关系为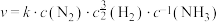 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。
(5)实际工业生产中,原料气中 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)___________ 。
(6)在氨气催化氧化制硝酸过程中,发现 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
① (快)
(快) 
② (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是___________ 。
 .回答下列问题。
.回答下列问题。(1)汽车在行驶过程中有如下反应发生:

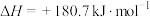

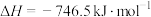
写出表示CO燃烧热的热化学方程式为
(2)空燃比是机动车内燃机气缸通入空气与燃料质量的比值。[设汽油的成分为辛烷(
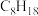 ),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为
),空气的平均相对分子质量为29,氧气在空气中的体积分数为21%]计算汽油的最佳空燃比为(3)在汽车上安装三元催化转化器可实现反应:

 <0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:
<0,减少汽车尾气污染。T℃时,在恒容的密闭容器中通入一定量的CO和NO,能进行上述反应,测得不同时间的CO和NO的浓度如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
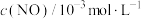 | 1.50 | 1.15 | 0.75 | 0.62 | 0.55 | 0.50 | 0.50 |
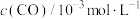 | 3.00 | 2.65 | 2.25 | 2.12 | 2.05 | 2.00 | 2.00 |


 。(
。( 用平衡分压代替平衡浓度,分压=总压×物质的量分数)
用平衡分压代替平衡浓度,分压=总压×物质的量分数)  .工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):
.工业合成氨以铁触媒作催化的反应机理如图(*表示吸附态,中间部分表面反应过程未标出):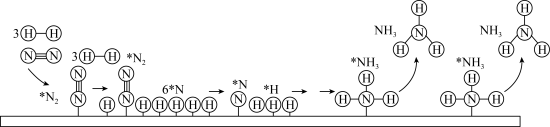
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。(4)研究表明,合成氨的速率与相关物质的浓度关系为
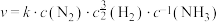 ,k为速率常数。以下说法正确的是___________。
,k为速率常数。以下说法正确的是___________。| A.合成氨的反应在任意温度下都能自发进行 |
B.增大 、 、 或 或 的浓度都能提高合成氨速率 的浓度都能提高合成氨速率 |
| C.若反应气中混有水蒸气,Fe催化剂可能中毒 |
| D.使用催化剂可提高单位时间内原料气的转化率 |
 和
和 物质的量之比按1∶2.8加入。请说明原料气中
物质的量之比按1∶2.8加入。请说明原料气中 过量的理由:(从两种不同的角度分析)
过量的理由:(从两种不同的角度分析)(6)在氨气催化氧化制硝酸过程中,发现
 (
( <0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
<0)反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:①
 (快)
(快) 
②
 (慢)
(慢) 
根据化学反应原理解释升高温度该反应速率减小的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】乙醇是一种绿色能源,也是一种化工原料。
(1)已知几种热化学方程式如下:
①
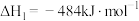
②
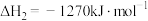
③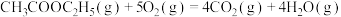

(ⅰ)上述反应中,在任意温度下都能自发进行的是___________ (填序号)。
(ⅱ)我国科学家开发新型催化剂利用乙醇直接制备乙酸乙酯: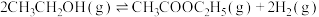

___________  。
。
(2)乙醇是一种储氢材料。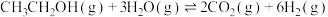
 ,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
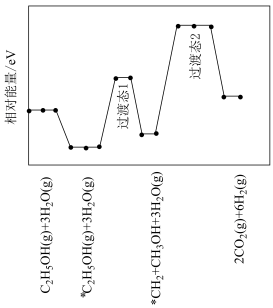
①
___________ 0(填“>”“<”或“=”),总反应分___________ 步反应进行。
②速控反应的方程式为___________ 。
(3)一定温度下,向恒容密闭容器中充入适量乙醇蒸气,发生反应: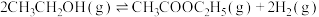 ,下列叙述正确的是___________(填标号)。
,下列叙述正确的是___________(填标号)。
(4)保持总压为 ,向反应器中充入乙醇
,向反应器中充入乙醇 和氮气(不参与反应),发生反应:
和氮气(不参与反应),发生反应: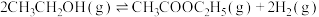 ,测得乙醇的平衡转化率与投料比
,测得乙醇的平衡转化率与投料比 、温度
、温度 的关系如图所示:
的关系如图所示:
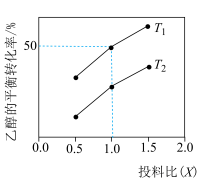
①其他条件不变时,随着 增大,乙醇的平衡转化率增大的原因是
增大,乙醇的平衡转化率增大的原因是_______ ,
_____  (填“>”或“<”)。
(填“>”或“<”)。
② 温度下,投料比为1.0时,平衡常数
温度下,投料比为1.0时,平衡常数 为
为________  (提示:用分压计算的平衡常数为
(提示:用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的显分数)。
物质的显分数)。
(5)我国科学家开发复合催化剂,实现了在酸性条件下电还原 制备乙醇,阴极反应式为
制备乙醇,阴极反应式为___________ 。
(1)已知几种热化学方程式如下:
①

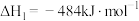
②

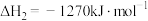
③
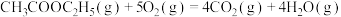

(ⅰ)上述反应中,在任意温度下都能自发进行的是
(ⅱ)我国科学家开发新型催化剂利用乙醇直接制备乙酸乙酯:
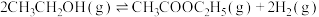

 。
。(2)乙醇是一种储氢材料。
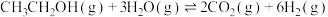
 ,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
,Akande对其动力学机理的研究(*代表物种吸附在催化剂表面上)如图所示:
①

②速控反应的方程式为
(3)一定温度下,向恒容密闭容器中充入适量乙醇蒸气,发生反应:
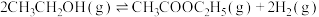 ,下列叙述正确的是___________(填标号)。
,下列叙述正确的是___________(填标号)。| A.当气体总压强不变时,达到平衡状态 |
| B.平衡时升温,正反应速率大于逆反应速率 |
| C.平衡时,充入氩气,平衡向左移动 |
D.平衡时,充入少量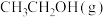 ,其平衡转化率减小 ,其平衡转化率减小 |
(4)保持总压为
 ,向反应器中充入乙醇
,向反应器中充入乙醇 和氮气(不参与反应),发生反应:
和氮气(不参与反应),发生反应: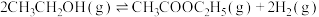 ,测得乙醇的平衡转化率与投料比
,测得乙醇的平衡转化率与投料比 、温度
、温度 的关系如图所示:
的关系如图所示:
①其他条件不变时,随着
 增大,乙醇的平衡转化率增大的原因是
增大,乙醇的平衡转化率增大的原因是
 (填“>”或“<”)。
(填“>”或“<”)。②
 温度下,投料比为1.0时,平衡常数
温度下,投料比为1.0时,平衡常数 为
为 (提示:用分压计算的平衡常数为
(提示:用分压计算的平衡常数为 ,分压
,分压 总压
总压 物质的显分数)。
物质的显分数)。(5)我国科学家开发复合催化剂,实现了在酸性条件下电还原
 制备乙醇,阴极反应式为
制备乙醇,阴极反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】氮及其化合物的研究对于生态环境保护和工农业生产发展非常重要。请回答下列问题:
(1) 氧化反应:
氧化反应: 分两步进行,
分两步进行,
反应Ⅰ.
反应Ⅱ.
其反应过程能量变化示意图如图a所示。其中决定 氧化反应速率的步骤是反应
氧化反应速率的步骤是反应___________ (填“Ⅰ”或“Ⅱ”)。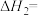
___________  (用a、b表示)。
(用a、b表示)。

(2)一定条件下将 和
和 按物质的量之比2:1充入某密闭反应容器,发生反应:
按物质的量之比2:1充入某密闭反应容器,发生反应: 。其他条件相同时,分别测得
。其他条件相同时,分别测得 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线如图b所示。
)下随温度变化的曲线如图b所示。
①
___________ (填“>”“<”或“=”) 。
。
②400℃、 条件下,
条件下, 的体积分数为
的体积分数为___________ %(保留小数点后一位小数)。
③700℃、 条件下,该反应的平衡常数
条件下,该反应的平衡常数
___________ (以分压表示,分压=总压×物质的量分数)。
(3)恒容条件下,为提高 转化为
转化为 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为___________ (任写一种)。
(4)还可用间接电解法除 。其原理如图所示:
。其原理如图所示:

①从A口中出来的气体是___________ 。
②写出电解池阴极的电极反应式___________ 。
③用离子方程式表示吸收柱中除去 的原理
的原理___________ 。
(1)
 氧化反应:
氧化反应: 分两步进行,
分两步进行,反应Ⅰ.

反应Ⅱ.

其反应过程能量变化示意图如图a所示。其中决定
 氧化反应速率的步骤是反应
氧化反应速率的步骤是反应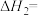
 (用a、b表示)。
(用a、b表示)。
(2)一定条件下将
 和
和 按物质的量之比2:1充入某密闭反应容器,发生反应:
按物质的量之比2:1充入某密闭反应容器,发生反应: 。其他条件相同时,分别测得
。其他条件相同时,分别测得 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线如图b所示。
)下随温度变化的曲线如图b所示。①

 。
。②400℃、
 条件下,
条件下, 的体积分数为
的体积分数为③700℃、
 条件下,该反应的平衡常数
条件下,该反应的平衡常数
(3)恒容条件下,为提高
 转化为
转化为 的平衡转化率,可采取的措施为
的平衡转化率,可采取的措施为(4)还可用间接电解法除
 。其原理如图所示:
。其原理如图所示:
①从A口中出来的气体是
②写出电解池阴极的电极反应式
③用离子方程式表示吸收柱中除去
 的原理
的原理
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】炼油、石化等工业会产生含硫(-2价)废水,处理的方法有沉淀法、氧化法。
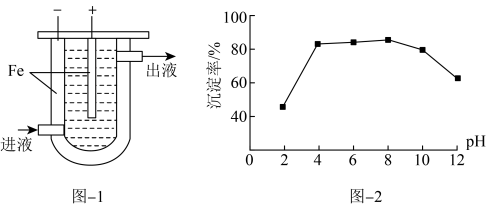
Ⅰ.沉淀法。用如下图-1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如题图-2所示。
(2)该装置沉淀废水中的硫(-2价)的原理可描述为_______ 。
(3)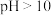 时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。
时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。
Ⅱ.氧化法。 氧化法、
氧化法、 氧化法、催化氧化法等可以将含硫废水中硫元素氧化。
氧化法、催化氧化法等可以将含硫废水中硫元素氧化。
i. 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。
溶液,控制溶液的pH为5,可以生成S沉淀。
(4)写出该反应的离子方程式:_______ 。
ii. 氧化法:向含
氧化法:向含 的废水中,加入
的废水中,加入 溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加
溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加 溶液体积的关系如题图-3所示。
溶液体积的关系如题图-3所示。
(6)当所加 溶液体积大于9mL时,所加
溶液体积大于9mL时,所加 溶液越多,S生成率越低,原因是
溶液越多,S生成率越低,原因是____ 。
iii.催化氧化法: 苯胺(
苯胺( 为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。
为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。_______ 。
(8)催化剂使用一段时间后催化效率会下降,结合图中相关信息,分析可能原因为_______ ,要使催化剂恢复催化效率,处理的方法是用氯仿( )浸取催化剂,再干燥即可。
)浸取催化剂,再干燥即可。
Ⅰ.沉淀法。用如下图-1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如题图-2所示。
A.负极: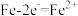 | B.阳极: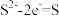 |
C.正极: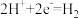 | D.阴极: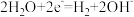 |
(2)该装置沉淀废水中的硫(-2价)的原理可描述为
(3)
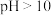 时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。
时,pH越大,硫转化为FeS的沉淀率越低,可能的原因是_______。A.pH越大, 越高, 越高, 与 与 结合转化为 结合转化为 逸出 逸出 |
B.pH越大, 越低,废水中 越低,废水中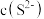 低,则FeS的沉淀率越低 低,则FeS的沉淀率越低 |
C.pH越大,废水中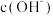 越高, 越高, 与 与 生成 生成 ,导致 ,导致 浓度越小,废水中 浓度越小,废水中 与 与 结合FeS沉淀的硫的量越少 结合FeS沉淀的硫的量越少 |
D.pH越大,废水中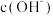 越低,废水中 越低,废水中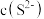 低, 低, 与 与 结合FeS沉淀量越少 结合FeS沉淀量越少 |
Ⅱ.氧化法。
 氧化法、
氧化法、 氧化法、催化氧化法等可以将含硫废水中硫元素氧化。
氧化法、催化氧化法等可以将含硫废水中硫元素氧化。i.
 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。
溶液,控制溶液的pH为5,可以生成S沉淀。(4)写出该反应的离子方程式:
ii.
 氧化法:向含
氧化法:向含 的废水中,加入
的废水中,加入 溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加
溶液,其他条件一定,测得硫(-2价)的去除率、S(单质)的生成率与所加 溶液体积的关系如题图-3所示。
溶液体积的关系如题图-3所示。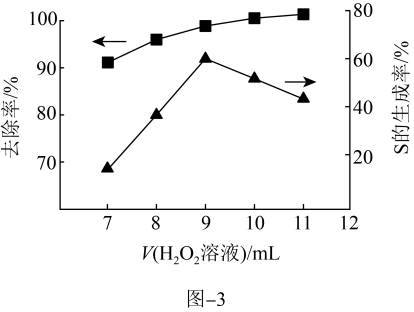
A.加 溶液就是将 溶液就是将 氧化为单质S 氧化为单质S |
B.随着 溶液的不断加入,废水中硫元素的去除率一直在升高 溶液的不断加入,废水中硫元素的去除率一直在升高 |
C. 溶液加入量越多,废水中含硫量越低 溶液加入量越多,废水中含硫量越低 |
D. 在处理一定量的废水中,其加入量不同氧化产物可能有差异 在处理一定量的废水中,其加入量不同氧化产物可能有差异 |
(6)当所加
 溶液体积大于9mL时,所加
溶液体积大于9mL时,所加 溶液越多,S生成率越低,原因是
溶液越多,S生成率越低,原因是iii.催化氧化法:
 苯胺(
苯胺( 为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。
为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如题图-4所示。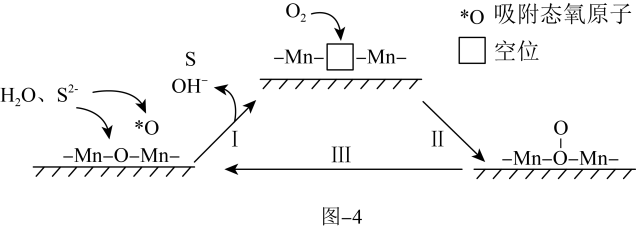
(8)催化剂使用一段时间后催化效率会下降,结合图中相关信息,分析可能原因为
 )浸取催化剂,再干燥即可。
)浸取催化剂,再干燥即可。
您最近一年使用:0次



