A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C,B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_________ ,基态D原子价电子的轨道表达式为_______
(2)DA2分子的VSEPR模型是________ 。H2A比H2D熔沸点高得多的原因是_________ 。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]
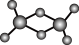
①C2Cl6属于_________ 晶体(填晶体类型),其中C原子的杂化轨道类型为______ 杂化。
②[C(OH)4]-中存在的化学键有__________ 。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_________ 。
(5)B、C的氯化物晶格能分别是2957kJ/mol、5492kJ/mol,二者相差很大的原因是________ 。
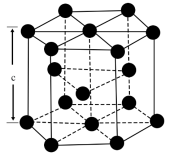
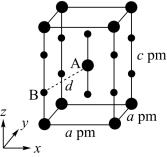
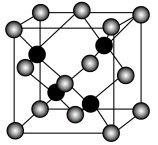
(6)D与E所形成化合物晶体的晶胞如右图所示。
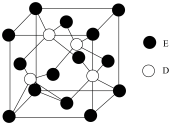
①在该晶胞中,E的配位数为__________ 。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为__________ 。
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为____ pm(列出计算式即可)。
(1)B、C中第一电离能较大的是
(2)DA2分子的VSEPR模型是
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]

①C2Cl6属于
②[C(OH)4]-中存在的化学键有
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是
(5)B、C的氯化物晶格能分别是2957kJ/mol、5492kJ/mol,二者相差很大的原因是
(6)D与E所形成化合物晶体的晶胞如右图所示。

①在该晶胞中,E的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为
③已知该晶胞的密度为ρg/cm3,则其中两个D原子之间的距离为
17-18高三上·四川绵阳·阶段练习 查看更多[3]
更新时间:2017-02-17 15:02:36
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
【推荐1】现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____ ,在周期表中的位置是_____ 。
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式_______ 。
(3)写出元素X、T形成的化合物XT2的电子式_______________ 。
(4)元素Z与元素T相比,非金属性较强的是________ (用元素符号表示),下列表述中能证明这一事实的是______________ (填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___________ 。
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程:__________________ 。
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数比内层电子总数少4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 与氢形成的气态化合物在标准状况下的密度为0.76g·L-1 |
| Z | 元素最高正价与负价的绝对值之差是6 |
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式
(3)写出元素X、T形成的化合物XT2的电子式
(4)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】A、D、E、W是中学常见的四种元素,原子序数依次增大,A的原子最外层电子数是次外层的2倍,D的氧化物属于两性氧化物,D、E位于同周期,A、D、E的原子最外层电子数之和为14,W是人体必需的微量元素,缺乏W会导致贫血症状。
(1)E在元素周期表中的位置是____________ 。A与E组成的化合物是常用的溶剂,写出其电子式__________________
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)____________ 。
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为______ 。
(4)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为______________ 。上述W的氧化物X能与D的单质反应,写出该反应的化学方程式为____________________ 。
(1)E在元素周期表中的位置是
(2)下列事实能用元素周期表相应规律解释的是(填字母序号)
a.D的最高价氧化物对应水化物的碱性弱于Mg(OH)2
b.E的气态氢化物的稳定性小于HF
c.A的单质能与二氧化硅高温下制得粗品硅单质
(3)WE3的溶液可用于刻蚀铜制的印刷电路板,反应的离子方程式为
(4)W的单质可用于处理酸性废水中的NO3-,使其转换为NH4+,同时生成有磁性的W的氧化物X,再进行后续处理,上述反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】 、
、 、
、 、
、 、
、 、
、 、
、 是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
(1)仅由表中信息还不能确定的元素是_______ (填字母序号),若要确定其是何种元素,还需要的条件是____ (填序号)。
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
c.单质在常温下为固体
d.简单氢化物的稳定性比 的简单氢化物强
的简单氢化物强
(2)基本信息②中,第一种元素的氧化物与 溶液反应的离子方程式为
溶液反应的离子方程式为________ 。
(3)上述某两种元素间可形成原子个数比为 及
及 的两种能与水反应的常见化合物,写出前者与
的两种能与水反应的常见化合物,写出前者与 反应的离子方程式:
反应的离子方程式:________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:| 编号 | 基本信息 | 解决的问题 |
| ① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 、 、 | 这两种元素是 |
| ② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素是短周期主族非金属元素,其最外层电子数是次外层电子数的一半 | 这两种元素分别是 |
| ③ |  能与 能与 、 、 分别形成原子个数比均为 分别形成原子个数比均为 的分子 的分子 、 、 |  的分子式为 的分子式为 在周期表中的位置是 在周期表中的位置是 |
(1)仅由表中信息还不能确定的元素是
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
c.单质在常温下为固体
d.简单氢化物的稳定性比
 的简单氢化物强
的简单氢化物强(2)基本信息②中,第一种元素的氧化物与
 溶液反应的离子方程式为
溶液反应的离子方程式为(3)上述某两种元素间可形成原子个数比为
 及
及 的两种能与水反应的常见化合物,写出前者与
的两种能与水反应的常见化合物,写出前者与 反应的离子方程式:
反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知X、Y、Z、W、V是元素周期表1~36号元素中的五种元素,这些元素的相关信息如下表:
(1)W元素位于元素周期表________ (填写周期、族),Y、Z的第一电离能较大的是________ (填元素符号)。
(2)X、Z两种元素能够形成很多化合物,其中Z2X2含有________ 个σ键,________ 个极性键。
(3)WX3中W原子的杂化方式是________ ,WX3分子空间构型是________ 。
(4)W、V的沸点如下表:
W的氢化物的相对分子质量比V的氢化物的相对分子质量大,前者的分子间作用力大于后者的分子间作用力,由此可见,前者的沸点应该高于后者的沸点,但实际情况却相反(见上表),其原因是________________ 。
| X | X的基态原子核外只有一种运动状态的电子 |
| Y | Y元素原子有两个能层,能量较高的能层上的电子比较低的能层的电子多1个 |
| Z | Z、Y同周期,且Z原子核外比Y原子核外多1个电子 |
| W | W的单质有白色、红色两种同素异形体,其中白色单质需要保存在水中 |
| V | V与W同主族,且V比W的原子序数小 |
(2)X、Z两种元素能够形成很多化合物,其中Z2X2含有
(3)WX3中W原子的杂化方式是
(4)W、V的沸点如下表:
| 氢化物 | W的氢化物 | V的氢化物 |
| 沸点 | -87.4 ℃ | -33.4℃ |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】已知 A、B、C、D、E 是原子序数依次增大前四周期元素,其元素性质或原子结构如表:
(1)A的最高价氧化物是___________ 分子。(填“极性”或“非极性”)该分子的杂化类型是___________
(2)B与其同周期相邻元素第一电离能由大到小的顺序为___________ (填元素符号)。B2O分子的空间构型是___________
(3)C气态氢化物稳定性是同族元素氢化物中最高的,其原因是___________ 。
(4)D 属于___________ 区的元素,该元素原子核外电子占据的最高能层符号是___________ 其基态原子的价层电子轨道表示式为___________ 。
(5)E 的基态原子的电子排布式为___________ 。E-e-=E+的过程中,失去的电子是基态E 中___________ 轨道上的电子。
| A | 原子核外电子分占 3 个不同能级, 且每个能级上排布的电子数相同 |
| B | 原子最高能级的不同轨道都有电子, 且自旋方向相同 |
| C | 在周期表所有元素中电负性最大 |
| D | 位于周期表中第 4 纵列 |
| E | 基态原子 M 层全充满, N 层只有一个电子 |
(2)B与其同周期相邻元素第一电离能由大到小的顺序为
(3)C气态氢化物稳定性是同族元素氢化物中最高的,其原因是
(4)D 属于
(5)E 的基态原子的电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】钴及其配合物在生活、生产中用途广泛。请回答下列问题:
(1)基态Co原子的电子排布式为_______ 。
(2) 是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为
是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为_______ 价,中心原子的配体为_______ 。 中含有的配位键数目为
中含有的配位键数目为_______ ,当向其中加入足量硝酸银溶液时,生成的AgCl质量为_______ g。
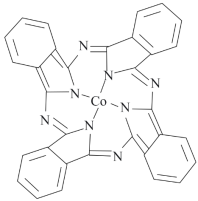
(3)酞菁钴(结构简式如图)主要应用于工业涂料印墨及塑料着色。C原子的杂化方式为_______ ,该配合物涉及的非金属元素的第一电离能由大到小的顺序是_______ (填元素符号)。
(4)金属钴单质的晶体结构有三种,其中一种六方晶胞结构如图所示,该晶胞中的钴原子数目为_______ ,设阿伏加德罗常数的值为 ,晶胞的底面积为
,晶胞的底面积为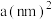 ,晶胞的密度为
,晶胞的密度为 ,则该晶胞的高c为
,则该晶胞的高c为_______ nm。
(1)基态Co原子的电子排布式为
(2)
 是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为
是一种不溶于水的紫红色固体,由于其热稳定性较好,可用作聚氯乙烯的染色剂和稳定剂。在该配合物中,Co的化合价为 中含有的配位键数目为
中含有的配位键数目为(3)酞菁钴(结构简式如图)主要应用于工业涂料印墨及塑料着色。C原子的杂化方式为

(4)金属钴单质的晶体结构有三种,其中一种六方晶胞结构如图所示,该晶胞中的钴原子数目为
 ,晶胞的底面积为
,晶胞的底面积为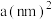 ,晶胞的密度为
,晶胞的密度为 ,则该晶胞的高c为
,则该晶胞的高c为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】2019年1月,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆:也首次实现了我国地外天体采样返回;所搭载的“玉兔二号”月球车,通过砷化镓( )太阳能电池提供能量进行工作。带回的月壤中包含了
)太阳能电池提供能量进行工作。带回的月壤中包含了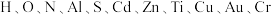 等多种元素。回答下列问题:
等多种元素。回答下列问题:
(1)基态 最高能层中成对电子与未成对电子的数目之比为
最高能层中成对电子与未成对电子的数目之比为_______ 。
(2) 的熔点为1238℃且熔融状态不导电,据此判断它是
的熔点为1238℃且熔融状态不导电,据此判断它是_______ (填“共价”或“离子”)化合物。
(3)H和O可以形成 和
和 。
。 是
是_______ (填“极性”或“非极性”)分子。
(4)砷化镓可由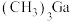 和
和 在
在 制得,
制得,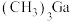 中碳原子的杂化方式为
中碳原子的杂化方式为_______ 。
(5)S与O可形成多种酸根离子及化合物,如 、
、 、
、 、
、 等,其中
等,其中 的
的 模型是
模型是_______ ; 的空间构型为
的空间构型为_______ 。
(6) 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
_______  (填“>”或“<”)。
(填“>”或“<”)。
 )太阳能电池提供能量进行工作。带回的月壤中包含了
)太阳能电池提供能量进行工作。带回的月壤中包含了 等多种元素。回答下列问题:
等多种元素。回答下列问题:(1)基态
 最高能层中成对电子与未成对电子的数目之比为
最高能层中成对电子与未成对电子的数目之比为(2)
 的熔点为1238℃且熔融状态不导电,据此判断它是
的熔点为1238℃且熔融状态不导电,据此判断它是(3)H和O可以形成
 和
和 。
。 是
是(4)砷化镓可由
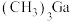 和
和 在
在 制得,
制得,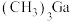 中碳原子的杂化方式为
中碳原子的杂化方式为(5)S与O可形成多种酸根离子及化合物,如
 、
、 、
、 、
、 等,其中
等,其中 的
的 模型是
模型是 的空间构型为
的空间构型为(6)
 催化烯烃硝化反应过程中会产生
催化烯烃硝化反应过程中会产生 。键角:
。键角:
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】磷酸亚铁锂(LiFePO4)和锰酸锂(LiMn2O4)均可用作锂离子电池正极材料。回答下列问题:
(1)在周期表中,与Li化学性质最相似的邻族元素是___________ ,基态P原子电子占据最高能级的电子云轮廓图为___________ 形。
(2)原子核外电子有两种相反的自旋状态,分别用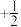 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为___________ 。
(3) 的空间结构为
的空间结构为___________ 形,其中心原子的杂化轨道类型为___________ 。
(4)已知; ,
,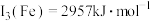 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是___________ 。
(1)在周期表中,与Li化学性质最相似的邻族元素是
(2)原子核外电子有两种相反的自旋状态,分别用
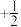 和
和 表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。基态Mn原子的价电子自旋磁量子数的代数和为(3)
 的空间结构为
的空间结构为(4)已知;
 ,
,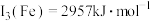 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】氟化物在生产、生活和科研中应用广泛。
(1)基态F原子的价电子排布式为___________ 。
(2)HF、CH4、HCl的沸点由高到低的顺序为___________ 。
(3)OF2分子的空间构型为___________ 。
(4)CF2=CF2分子中C的杂化轨道类型为___________ ,聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因___________ 。
(5)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有___________ 个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为( ,
, ,
, )。已知Xe—F键长为r pm,则B点原子的分数坐标为
)。已知Xe—F键长为r pm,则B点原子的分数坐标为___________ ;晶胞中A、B间距离d=___________ pm。
(1)基态F原子的价电子排布式为
(2)HF、CH4、HCl的沸点由高到低的顺序为
(3)OF2分子的空间构型为
(4)CF2=CF2分子中C的杂化轨道类型为
(5)XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有
 ,
, ,
, )。已知Xe—F键长为r pm,则B点原子的分数坐标为
)。已知Xe—F键长为r pm,则B点原子的分数坐标为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________ ,占据最高能级的电子的电子云轮廓图形状为___________ ,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________ 。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________ 。
(3)AlF3具有较高的熔点(1040℃),属于___________ 晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________ 。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________ ,该阴离子中存在的化学键有___________ (填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
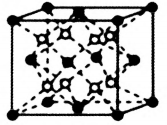
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________ 。立方体边长为acm,阿伏伽德罗常数的值为NA,则CaF2晶体的密度为___________ g·cm-3(列出计算式)
(1)基态铝原子的核外电子排布式为
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式
(3)AlF3具有较高的熔点(1040℃),属于
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为MnO2+Zn+(1+ )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
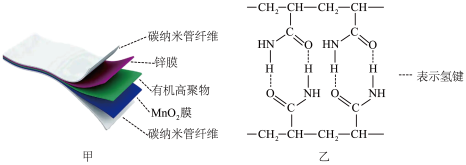
(1)Mn2+的核外电子排布式为__ ;有机高聚物中C的杂化方式为__ 。
(2)已知CN-与N2互为等电子体,推算拟卤素(CN)2分子中σ键与π键数目之比为__ 。
(3)NO2-的空间构型为__ 。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。
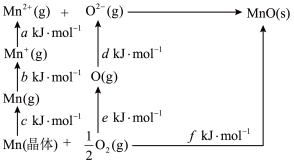
Mn的第一电离能是__ ,O2的键能是__ ,MnO的晶格能是__ 。
(5)R(晶胞结构如图)由Zn、S组成,其化学式为__ (用元素符号表示)。已知其晶胞边长为a cm,则该晶胞的密度为__ g·cm-3(阿伏加 德罗常数用NA表示)。
 )H2O+
)H2O+ ZnSO4
ZnSO4 MnOOH+
MnOOH+ ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
(1)Mn2+的核外电子排布式为
(2)已知CN-与N2互为等电子体,推算拟卤素(CN)2分子中σ键与π键数目之比为
(3)NO2-的空间构型为
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

Mn的第一电离能是
(5)R(晶胞结构如图)由Zn、S组成,其化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】自然界中存在一种天然硅铝酸盐,它们具有筛选分子、吸附、离子交换和催化作用。这种天然物质称为沸石,人工合成的沸石也被称为分子筛。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.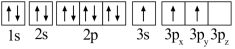 B.
B.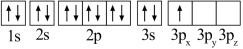
C.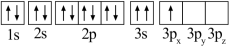 D.
D.
其中能量最低的是_____ (填字母),状态A中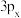 的电子云轮廓图为
的电子云轮廓图为_____ ,状态C电子排布图有错误,主要不符合_____ 。
(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为_____ (填字母),该化合物阴离子的空间构型是___________ 。
A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为___________ ,0.5mol丙烯中含___________ mol 键。
键。
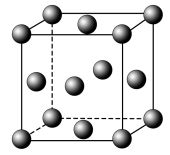
(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为___________ ,铝原子的半径为___________ nm(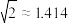 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为___________  (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
(1)某同学写出了铝原子的4种不同状态的电子排布图:
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
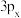 的电子云轮廓图为
的电子云轮廓图为(2)沸石分子筛“SAPO-34”是一种高性能催化剂,该催化剂可将乙醇催化转化为丙烯。
①分子筛中存在
 ,该化合物中存在的化学键类型为
,该化合物中存在的化学键类型为A.配位键 B.氢键 C.非极性键 D.离子键 E.金属键
②丙烯中碳原子的杂化类型为
 键。
键。(3)金属铝的晶胞结构如图所示,其晶胞参数为0.405nm。金属铝的堆积方式为
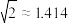 ,结果保留3位小数),铝单质的密度为
,结果保留3位小数),铝单质的密度为 (阿伏加德罗常数用
(阿伏加德罗常数用 表示,只列出算式即可)。
表示,只列出算式即可)。
您最近一年使用:0次



