磷和其化合物在科研及生产中均有着重要的作用。
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为________ 。
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
①平衡常数K:溶液II____ 溶液III(填“>”或“=”或“<”)
②反应达到平衡时,PCl3的转化率:容器II_____ 容器I(填“>”或“=”或“<”)
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
阴极的电极反应式为_______ ;产品室中反应的离子方程式为__________ 。
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成________ 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于105mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= ______ mol/L
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)PCl5(g),反应过程如下:
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态 PCl5生成气态PCl3和Cl2的热化学方程式为
(2)一定温度下,在三个恒容体积均为2.0L的容器中发生反应:PCl5(g)
 PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)| 编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡所需时间/s | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| I | 320 | 0.40 | 0.10 | 0.10 | t1 |
| II | 320 | 0.80 | t2 | ||
| III | 410 | 0.40 | 0.15 | 0.15 | t3 |
①平衡常数K:溶液II
②反应达到平衡时,PCl3的转化率:容器II
(3)亚磷酸(H2PO5)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
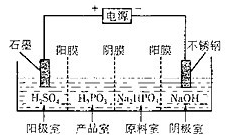
阴极的电极反应式为
(4)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO3,先生成
更新时间:2017-03-06 11:03:26
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】回答下列问题:
(1)2008年北京奥运会火炬采用常温下为气态的丙烷(C3H8)为燃料。一定量丙烷完全燃烧生成CO2和1mol 液态水放出553.75kJ热量,写出表示丙烷燃烧热的热化学方程式:_______ 。并画出丙烷燃烧的焓变示意图_______ 。

二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______ 。
(2)NF3是一种温室气体,分子结构和NH3相似,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能:
根据提供的数据计算反应N2(g)+3F2(g) = 2NF3(g)的
_______ 。
(3)醋酸燃烧的热化学方程式为:CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △H1= -70.3kJ/mol;请用文字表述上述热化学方程式的含义:_______ 。
(4)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g) = H2O(l) △H1=-Q1 kJ/mol
C2H5OH(g) = C2H5OH(l) △H2= -Q2 kJ/mol
C2H5OH(g) + 3O2 (g) = 2CO2 (g) + 3H2O(g) △H3 = -Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为_______ kJ。
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s) +1/2 O2 (g) = CO(g) 的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有_______ 。
(1)2008年北京奥运会火炬采用常温下为气态的丙烷(C3H8)为燃料。一定量丙烷完全燃烧生成CO2和1mol 液态水放出553.75kJ热量,写出表示丙烷燃烧热的热化学方程式:

二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为
(2)NF3是一种温室气体,分子结构和NH3相似,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年,如表所示是几种化学键的键能:
| 化学键 | N≡N | F—F | N—F |
| 键能/(kJ•mol-1) | 941.7 | 154.8 | 283.0 |

(3)醋酸燃烧的热化学方程式为:CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △H1= -70.3kJ/mol;请用文字表述上述热化学方程式的含义:
(4)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g) = H2O(l) △H1=-Q1 kJ/mol
C2H5OH(g) = C2H5OH(l) △H2= -Q2 kJ/mol
C2H5OH(g) + 3O2 (g) = 2CO2 (g) + 3H2O(g) △H3 = -Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为
②碳(s)在氧气供应不充足时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s) +1/2 O2 (g) = CO(g) 的△H。但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】环境问题已成为全球普遍的热门话题。
(1)氮氧化物是空气的主要污染源之一。可利用甲烷催化还原氮氧化物。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ·mol-1
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)ΔH2=-564 kJ·mol-1
则CH4将NO还原为N2的热化学方程式为____ 。
(2)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。催化反硝化法中,用H2在催化剂表面将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为_____ 。

(3)居室装修材料会挥发出甲醛,污染空气。通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的工作原理如图所示,其负极电极反应式为______ 。
(4)排放到大气中的SO2会形成硫酸型酸雨,SO2形成酸雨的化学方程式为______ 。燃煤火电发电厂的尾气中含SO2,常用Na2SO3溶液或氨水吸收尾气,生成NaHSO3 或NH4HSO3,已知NaHSO3溶液显酸性,则其溶液中离子浓度大小关系为______ 。
(5)已知25℃时,Ksp(BaSO4) ="1.0" ×10-10mol2·L-2。现将4.0×10-4mol/L的Na2SO4溶液与一定浓度的BaCl2溶液等体积混合生成沉淀,计算应加入BaCl2溶液的最小浓度为__ 。
(1)氮氧化物是空气的主要污染源之一。可利用甲烷催化还原氮氧化物。已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH1=-867 kJ·mol-1
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g)ΔH2=-564 kJ·mol-1
则CH4将NO还原为N2的热化学方程式为
(2)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。催化反硝化法中,用H2在催化剂表面将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应的离子方程式为

(3)居室装修材料会挥发出甲醛,污染空气。通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的工作原理如图所示,其负极电极反应式为
(4)排放到大气中的SO2会形成硫酸型酸雨,SO2形成酸雨的化学方程式为
(5)已知25℃时,Ksp(BaSO4) ="1.0" ×10-10mol2·L-2。现将4.0×10-4mol/L的Na2SO4溶液与一定浓度的BaCl2溶液等体积混合生成沉淀,计算应加入BaCl2溶液的最小浓度为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】一定条件下合成乙烯:
6H2(g)+2CO2(g) CH2=CH2(g)+4H2O(g) △H1
CH2=CH2(g)+4H2O(g) △H1
已知:2H2(g)+O2(g)=2 H2O(g) △H2=-480 kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2 H2O(g) △H3=-1400 kJ•mol-1
(1)△H1=________ 。请标出该反应电子转移的方向和数目_________ 。
(2)温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是_______ 。

A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM >KN
C.催化剂会影响CO2的平衡转化率
(3)若投料比n(H2)∶n(CO2)=3∶1,则图中M点时,乙烯的体积分数为_______ (保留两位有效数字)。
(4)为提高CO2的平衡转化率,除改变温度外,还可采取的措施有__________ (任写一条)。
(5)电解法可制取乙烯(下图),电极a接电源的_____ 极,该电极反应式为_________ 。

6H2(g)+2CO2(g)
 CH2=CH2(g)+4H2O(g) △H1
CH2=CH2(g)+4H2O(g) △H1已知:2H2(g)+O2(g)=2 H2O(g) △H2=-480 kJ•mol-1
CH2=CH2(g)+3O2(g)=2CO2(g)+2 H2O(g) △H3=-1400 kJ•mol-1
(1)△H1=
(2)温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是

A.生成乙烯的速率:v(M)有可能小于v(N)
B.平衡常数:KM >KN
C.催化剂会影响CO2的平衡转化率
(3)若投料比n(H2)∶n(CO2)=3∶1,则图中M点时,乙烯的体积分数为
(4)为提高CO2的平衡转化率,除改变温度外,还可采取的措施有
(5)电解法可制取乙烯(下图),电极a接电源的

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g) CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________________ 。下图是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____________ 反应(填“放热”或“吸热”)。

(2)500℃该反应的平衡常数为______ (保留两位小数),若提高温度到800℃进行,达平衡时,K值______ (填“增大”、“减小”或“不变”)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(4)下列措施能使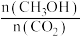 增大的是
增大的是______ 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
 CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=

(2)500℃该反应的平衡常数为
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)
(4)下列措施能使
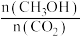 增大的是
增大的是A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)平衡常数随温度的变化如下表:
试回答下列问题
(1)上述正向反应是__ 反应 (填“放热”或“吸热”)
(2)要使上述反应的正反应速率增大且平衡向正反应方向移动,下列措施不可行的有__
A、加入催化剂
B、增大CO的物质的量以提高体系的压强
C、降低温度
D、减小H2的浓度
(3)向某密闭容器中充入2molCO和4molH2O(g),发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有_______
A、1molCO(g)+4molH2O+2molCO2(g)+2molH2(g)
B、2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C、1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g)
D、1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
(4)若反应在800℃时进行,设起始CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO的转化率为y,则y随x变化的函数关系式为y=__
(5)在VL密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2845KJ(已知CO燃烧热为283KJ/mol,H2燃烧热为286KJ/mol),则T℃平衡常数K=__ ,T=__ ℃
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是
(2)要使上述反应的正反应速率增大且平衡向正反应方向移动,下列措施不可行的有
A、加入催化剂
B、增大CO的物质的量以提高体系的压强
C、降低温度
D、减小H2的浓度
(3)向某密闭容器中充入2molCO和4molH2O(g),发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有
A、1molCO(g)+4molH2O+2molCO2(g)+2molH2(g)
B、2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C、1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g)
D、1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
(4)若反应在800℃时进行,设起始CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO的转化率为y,则y随x变化的函数关系式为y=
(5)在VL密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2845KJ(已知CO燃烧热为283KJ/mol,H2燃烧热为286KJ/mol),则T℃平衡常数K=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】t℃时,将3 mol A 和1 mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g) + B(g)⇌4 C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4 mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为_______ 。
(2)达到平衡状态时,B 物质的转化率α(B)=_______ ,平衡常数K=_______ (填计算结果)。
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡_______ (填字母)
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动。
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:n(B) =_______ mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:_______ 。
(1)从反应开始到达到平衡状态,生成C的平均反应速率为
(2)达到平衡状态时,B 物质的转化率α(B)=
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动。
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:n(B) =
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】回答下列问题
(1)已知 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为___________ 。
(2)常温下,用 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡___________ (填“向左”、“向右”或“不”)移动。试计算该溶液中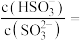
___________ (常温下 的电离平衡常数
的电离平衡常数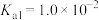 ,
, )。
)。
(3)保险粉样品中 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为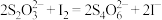 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
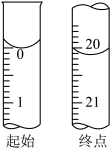
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用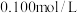 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是___________ 。滴定起始和终点的液面位置如图所示。则样品的纯度为___________ 。(设 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为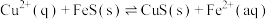 。下列有关叙述正确的是
。下列有关叙述正确的是___________ 。
a、
b、达到平衡时
c、该反应平衡常数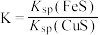
(1)已知
 (次磷酸)的水溶液中存在
(次磷酸)的水溶液中存在 分子。
分子。 与足量
与足量 溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为
溶液充分反应,消耗的酸和碱的物质的量相等,则生成盐的化学式为(2)常温下,用
 溶液吸收
溶液吸收 得到
得到 的
的 溶液,吸收过程中水的电离平衡
溶液,吸收过程中水的电离平衡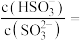
 的电离平衡常数
的电离平衡常数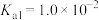 ,
, )。
)。(3)保险粉样品中
 的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为
的纯度(质量分数)可通过氧化还原滴定法来测定,反应的离子方程式为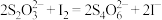 。准确称取
。准确称取 样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用
样品于锥形瓶中,用适量蒸馏水溶解,并滴加淀粉溶液作指示剂。用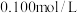 碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是
碘的标准溶液进行滴定,判断达到滴定终点的操作和现象是 的摩尔质量为
的摩尔质量为 )
)
(4)化工生产中常用
 作沉淀剂除去工业废水中的
作沉淀剂除去工业废水中的 ,其反应原理为
,其反应原理为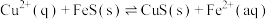 。下列有关叙述正确的是
。下列有关叙述正确的是a、

b、达到平衡时

c、该反应平衡常数
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.4×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH___ (填“大”“小”或“相等”)。
(2)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为____________________ 。
(3)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为______ 。
(4)草酸钙结石是五种肾结石里最为常见的一种。患草酸钙结石的病人多饮白开水有利于结石的消融。请用化学用语和简要的文字说明其原因:______ 。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为______ 。
(1)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH
(2)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为
(3)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为
(4)草酸钙结石是五种肾结石里最为常见的一种。患草酸钙结石的病人多饮白开水有利于结石的消融。请用化学用语和简要的文字说明其原因:
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】金属铝、铁、铜及其化合物与生产、科研关系密切。
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应冶炼金属锰。用化学方程式表示其冶炼原理________ 。
(2)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN—(C为+4价。下同),装置如图所示,通电过程中,阴、阳两极均有无色无味的气体产生,阳极区两种离子的放电产物会进一步发生反应,其方程式为C12+CNO—+OH— →□+Cl—+CO32-+H2O(未配平)。

①铁电极应连接直流电源的__________ (填写电极名称)。
②上述反应方程式配平后“□”内应填写_______ 。
③阴极产物有______ ,阳极上发生的电极反应为2Cl--2e-=Cl2↑和______ 。
(3)用CuSO4溶液为电解质溶液,进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼。下列说法错误的是___________ (填写字母代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)硫酸铝铵水溶液呈酸性,是因为________ (填写离子符号)发生了水解;常温下浓度均为0.1 mol·L-1硫酸铝和硫酸铝铵两种水溶液,c(Al3+)较大的是________ (填“硫酸铝铵”或“硫酸铝”)溶液。
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应冶炼金属锰。用化学方程式表示其冶炼原理
(2)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN—(C为+4价。下同),装置如图所示,通电过程中,阴、阳两极均有无色无味的气体产生,阳极区两种离子的放电产物会进一步发生反应,其方程式为C12+CNO—+OH— →□+Cl—+CO32-+H2O(未配平)。

①铁电极应连接直流电源的
②上述反应方程式配平后“□”内应填写
③阴极产物有
(3)用CuSO4溶液为电解质溶液,进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼。下列说法错误的是
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(4)硫酸铝铵水溶液呈酸性,是因为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是_______________________ 。
(2)铝与氢氧化钾溶液反应的离子方程式是______________ 。
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是______________________ 。
②通电开始后,阴极附近溶液pH会增大,请简述原因______________________ 。
③除去杂质后的氢氧化钾溶液从液体出口___________ (填写“A”或“B”)导出。
(1)工业冶炼铝的化学方程式是
(2)铝与氢氧化钾溶液反应的离子方程式是
(3)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是
②通电开始后,阴极附近溶液pH会增大,请简述原因
③除去杂质后的氢氧化钾溶液从液体出口
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为__________ .
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和______ (填化学式)。
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。

第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:________ (填离子方程式) .
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是_________ (填化学式) 。
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是______________ .

(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为
②从废液中可回收铜井使蚀刻液再生。再生所用的试剂有Fe和
(2)用HCl-CuCl2溶液作蚀刻液蚀刻铜后的废液中含Cu+ 用下图所示方法可使蚀刻液再生并回收金属铜。

第一步BDD电极上生成强氧化性的氢氧自由基(HO·):H2O-e-==HO·+H+: .
第二步HO·氧化Cu+实现CuCl蚀刻液再生:
(3)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O==Cu(NH3)4Cl2+ 4H2O;Cu(NH3)4Cl2+Cu== 2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是
②50℃,c(CuCl2)=2.5mol·L-1, pH对蚀刻速串的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是

您最近一年使用:0次



