常温下,向10mL0.1mol·L-1H2A溶液中逐滴加入0.1mol·L-1NaOH溶液。有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示分析判断,下列微粒浓度大小关系正确的是
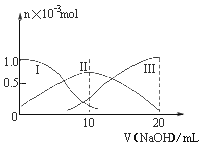

| A.当v=0时,c(H+)=c(OH-)+c(HA-)+c(A2-) |
| B.当v=10时,c(Na+)=c(H2A)+c(HA-)+c(A2-) |
| C.当v=20时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) |
| D.当pH=7时,c(Na+)>c(HA-)+ c(A2-) |
更新时间:2017-02-26 21:26:04
|
相似题推荐
多选题
|
适中
(0.65)
解题方法
【推荐1】25℃时,下列溶液中微粒的物质的量浓度关系正确的是

A. 溶液中: 溶液中: |
B. 溶液中: 溶液中: |
C.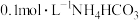 溶液中: 溶液中: |
D.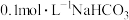 溶液中: 溶液中: |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】25℃时,有关弱酸的电离平衡常数如表:
下列有关微粒浓度的说法正确的是
| 化学式 | HCN | H2CO3 | CH3COOH |
| 电离平衡常数 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
| A.pH均为8的NaCN溶液、Na2CO3溶液、CH3COONa溶液:c(Na2CO3)>c(NaCN)>c(CH3COONa) |
B.浓度均为0.1mol·L-1NaHCO3和Na2CO3混合溶液中:3c(Na+)=2c(HCO )+2c(CO )+2c(CO )+2c(H2CO3) )+2c(H2CO3) |
| C.0.2mol·L-1HCN溶液与0.1mol·L-1NaOH溶液等体积混合所得溶液中:c(HCN)>c(Na+)>c(CN-)>c(OH-)> c(H+) |
| D.浓度均为0.1mol·L-1CH3COOH和CH3COONa混合溶液中:c(CH3COOH)+c(H+)<c(CH3COO-)+c(OH-) |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐3】室温下,Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。CH3COOH和CH3COONH4形成的缓冲溶液常用于高岭土的成分分析。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒浓度关系正确的是( )
| A.0.1 mol·L-1 CH3COOH溶液:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| B.0.1 mol·L-1 CH3COONH4溶液:c(NH4+)=c(CH3COO-)>c(H+)=c(OH-) |
| C.0.1 mol·L-1 CH3COOH溶液和0.1 mol·L-1 CH3COONH4溶液等体积混合:c(NH4+)+c(NH3·H2O)+c(OH-)=c(CH3COOH)+c(H+) |
| D.0.3 mol·L-1 CH3COOH溶液和0.1 mol·L-1 CH3COONH4溶液等体积混合:c(CH3COOH)+c(H+)-c(NH3·H2O)-c(OH-)=0.15 mol·L-1 |
您最近一年使用:0次
多选题
|
适中
(0.65)
解题方法
【推荐1】 时,往
时,往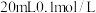 的
的 溶液中滴加
溶液中滴加 的
的 溶液,随着
溶液,随着 溶液的滴入,溶液的
溶液的滴入,溶液的 与所加
与所加 溶液的体积关系如下图所示。下列说法正确的是
溶液的体积关系如下图所示。下列说法正确的是

 时,往
时,往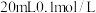 的
的 溶液中滴加
溶液中滴加 的
的 溶液,随着
溶液,随着 溶液的滴入,溶液的
溶液的滴入,溶液的 与所加
与所加 溶液的体积关系如下图所示。下列说法正确的是
溶液的体积关系如下图所示。下列说法正确的是 
A. 的一级水解常数的数量级为 的一级水解常数的数量级为 |
B. 溶液: 溶液: |
C.Z点: |
D. 点中,水的电离程度最大的是Z点 点中,水的电离程度最大的是Z点 |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐2】25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。0.1mol/L的NaHTeO3溶液中,下列粒子的物质的量浓度关系不正确的是( )
| A.c(Na+)>c(HTeO3-)>c(OH-)>c(H2TeO3)>c(H+) |
| B.c(Na+)=c(TeO32-)+c(HTeO3-)+c(H2TeO3) |
| C.c(Na+)+c(H+)≥c(HTeO3-)+c(TeO32-)+c(OH-) |
| D.c(H+)+c(H2TeO3)=c(OH-)+c(TeO32-) |
您最近一年使用:0次

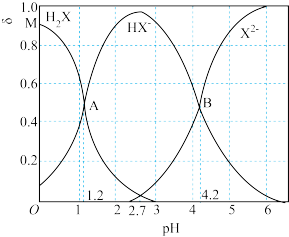
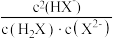 =10, 且始终保持不变
=10, 且始终保持不变

