室温下,有物质的量浓度相等的下列物质的溶液:①NH4NO3 ②CH3COONH4 ③NH4HSO4 ④(NH4)2SO4 ⑤(NH4)2CO3,其中所含的c(NH4+)由大到小的顺序是( )
| A.②①③④⑤ | B.①②③④⑤ | C.④⑤③①② | D.⑤④③②① |
更新时间:2017/03/11 21:07:07
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
 | 向 的 的 溶液中加入等体积浓 溶液中加入等体积浓 溶液,振荡 溶液,振荡 | 分层,下层由紫红色变为浅粉红色,上层呈棕黄色 |  在浓 在浓 溶液中的溶解能力大于在 溶液中的溶解能力大于在 的溶解能力 的溶解能力 |
 | 向 溶液中滴加 溶液中滴加 溶液,再加入少量 溶液,再加入少量 固体 固体 | 溶液先变成血红色后无明显变化 |  与 与 反应不可逆 反应不可逆 |
| C | 向 溶液中先滴加4滴 溶液中先滴加4滴 溶液,再滴加4滴 溶液,再滴加4滴 溶液 溶液 | 先产生白色沉淀,再产生黄色沉淀 |  转化为 转化为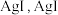 溶解度小于 溶解度小于 溶解度 溶解度 |
 | 向 溶液中滴加 溶液中滴加 溶液 溶液 | 出现黄色沉淀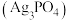 |  发生了水解反应 发生了水解反应 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列装置图或曲线图与对应的叙述相符的是


| A.如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| B.某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+ |
| C.如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+) |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是
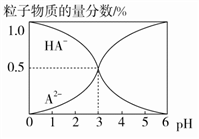

| A.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 |
B.H2A的电离方程式:H2A H++HA- H++HA- |
| C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) |
| D.Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】20℃时,0.1 mol • L-1 NH4Al(SO4)2溶液的pH随温度变化的关系如曲线Ⅰ所示,下列说法中正确的是
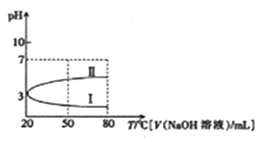
| A.0.1mol·L-1的NH4Al(SO4)2溶液中c(NH4+)大于等浓度的NH4HSO4溶液中的c(NH4+) |
| B.0.1mol·L-1的NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol·L-1 |
| C.向100mL0.1mol·L-1的NH4Al(SO4)2溶液中逐渐滴加80mL0.05mol·L-1NaOH溶液时,溶液pH的变化如曲线Ⅱ |
| D.升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】亚砷酸(H3AsO3)可用于治疗白血病,在溶液中存在多种微粒形态。向1L0.1mol·L-1H3AsO3溶液中逐滴加入0.1mol·L-1KOH溶液,各种微粒物质的量分数与溶液的pH关系如图所示,图中M点对应的pH为a,下列说法正确的是( )


| A.H3AsO3的电离常数Ka1的数量级为10-9 |
| B.pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-=H2AsO3-+H2O |
| C.M点对应的溶液中:c(H2AsO3-)+c(HAsO32-)+c(AsO33-)+c(H3AsO3)=0.1mol·L-1 |
| D.pH=12 时,溶液中:c(H2AsO3-)+2c(HAsO32-)+3c(AsO33-)+c(H3AsO3)>c(H+)+c(K+) |
您最近半年使用:0次




