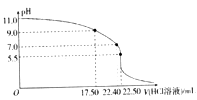
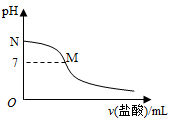
下列装置图或曲线图与对应的叙述相符的是


| A.如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| B.某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+ |
| C.如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+) |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右 |
更新时间:2017-06-01 20:18:11
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】下列说法不正确的是
| A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度 |
| B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12 |
| C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】在常温下,有关下列4种溶液的叙述中错误的是
| 编号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | NaOH溶液 | 氢氟酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
| A.在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小 |
| B.分别加水稀释10倍,四种溶液的pH:①>②>④>③ |
| C.将aL溶液④与bL溶液②混合后,若所得溶液的pH=4,则a∶b=11∶9 |
D.将溶液①、④等体积混合,所得溶液中: |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,用 0.10 mol·L-1NaOH溶液分别滴定20.00 mL 0.10 mol·L-1HCl溶液和20.00 mL 0.10 mol·L-1CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是
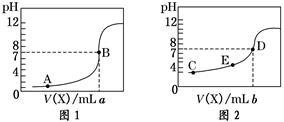

| A.图2是滴定盐酸的曲线 |
| B.a与b的关系是:a<b |
| C.E点对应离子浓度由大到小的顺序为: c(CH3COO-) >c(Na+) >c(H+) >c(OH-) |
| D.这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】化学中常用AG表示溶液的酸度(AG=lg 。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
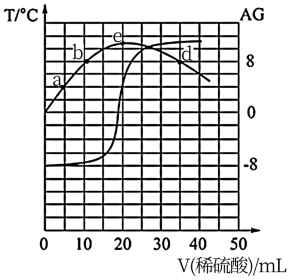
 。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
。室温下,向20.00mL0.1000ml·L-1的某一元碱MOH溶液中滴加未知浓度的稀硫酸溶液,混合溶液的温度与酸度AG随加入稀硫酸体积的变化如图所示。下列说法正确的是
| A.b、c、d三点对应的溶液中,水的电离程度大小为b=d>c |
| B.b点对应的溶液中:c(M+)-c(MOH)=2c(OH-)-2c(H+) |
C.当AG=0时,溶液中存在c(SO )>c(M+)>c(H+)=c(OH-) )>c(M+)>c(H+)=c(OH-) |
| D.室温下M+的水解常数Kh=10×10-5 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】根据下列实验操作和现象所得到的结论错误的是
| 选项 | 实验操作和现象 | 结论 |
| A | 向25mL煮沸的蒸馏水中滴加5~6滴饱和 溶液,加热至液体呈红褐色 溶液,加热至液体呈红褐色 | 制得氢氧化铁胶体 |
| B | 室温下,用pH计测得等浓度 溶液的碱性小于 溶液的碱性小于 溶液 溶液 |  的水解程度大于 的水解程度大于 |
| C | 向2mL0.1  溶液中滴入几滴浓硫酸,溶液由黄色变为橙色 溶液中滴入几滴浓硫酸,溶液由黄色变为橙色 |  增加,反应 增加,反应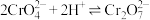  正向移动向 正向移动向 |
| D | 向2mL0.1  溶液中先滴入几滴0.1 溶液中先滴入几滴0.1 NaOH溶液,有白色沉淀生成,再滴入0.1 NaOH溶液,有白色沉淀生成,再滴入0.1  溶液,又有蓝色沉淀生成 溶液,又有蓝色沉淀生成 | 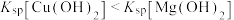 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列实验操作及现象与相关实验目的正确的是
| 选项 | 实验操作及现象 | 实验目的 |
| A | 室温下,用 计分别测定浓度均为 计分别测定浓度均为 的 的 和 和 溶液的 溶液的 | 比较 和 和 的大小 的大小 |
| B | 将镀层破损的镀锌铁片放入酸化的 溶液中一段时间后,取溶液于试管中,滴加 溶液中一段时间后,取溶液于试管中,滴加 溶液,观察现象 溶液,观察现象 | 检查已破损的镀层锌是否仍对铁有保护作用 |
| C | 已知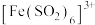 呈红棕色,往 呈红棕色,往 溶液中通入 溶液中通入 ,溶液先变红棕色,后逐渐变为浅绿色 ,溶液先变红棕色,后逐渐变为浅绿色 | 比较 与 与 反应生成 反应生成 和两者发生氧化还原反应的速率快慢和反应程度的大小 和两者发生氧化还原反应的速率快慢和反应程度的大小 |
| D | 用 溶液滴定 溶液滴定 未知浓度盐酸,用温度传感器采集锥形瓶内溶液的温度数据 未知浓度盐酸,用温度传感器采集锥形瓶内溶液的温度数据 | 测定中和反应的反应热 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐3】氮及其化合物在工业生产与生活中应用广泛。合成NH3实现了氮的人工固定,NH3在强碱条件下能被NaClO氧化生成N2H4,N2H4可被NaClO继续氧化生成N2,也可被HNO2氧化生成HN3,HN3是一种弱酸,酸性与醋酸相当。下列有关含氮化合物的性质与制备说法不正确 的是
| A.分析结构可推得,N2H4可溶于水 |
| B.N2H4被NaClO氧化生成N2时,还原剂与氧化剂物质的量之比为1:2 |
| C.制备N2H4时应将NH3缓慢通入NaClO溶液中 |
| D.相同条件下溶液的碱性:NaHCO3强于NaN3 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】常温下,向20.00mL0.1mol•L-1富马酸(简记为H2A)溶液中滴加VmL0.1mol•L-1氨水,混合溶液中-lgX (X=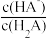 、
、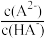 或
或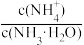 ]与pH的关系如图所示。
]与pH的关系如图所示。
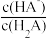 、
、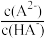 或
或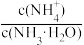 ]与pH的关系如图所示。
]与pH的关系如图所示。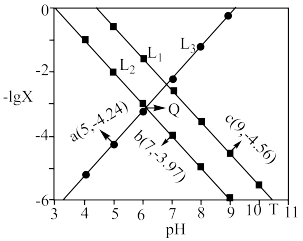
| A.T点对应pH为10.54 |
| B.Q点对应的溶液加入氨水的体积V一定为20.00 |
C.V=40.00的溶液中:c(NH )>c(A2-)>c(OH-)>c(H+) )>c(A2-)>c(OH-)>c(H+) |
D.H2A+2NH3•H2O (NH4)2A+2H2O的K=1.0×1011.01 (NH4)2A+2H2O的K=1.0×1011.01 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】室温下,滴加NaOH溶液改变0.1 RCOOH溶液的pH,溶液中RCOOH、
RCOOH溶液的pH,溶液中RCOOH、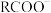 的微粒分布分数
的微粒分布分数 ,甲酸(HCOOH)与乙酸(
,甲酸(HCOOH)与乙酸( )中酸分子的分布分数与pH的关系如图所示。下列说法正确的是
)中酸分子的分布分数与pH的关系如图所示。下列说法正确的是

 RCOOH溶液的pH,溶液中RCOOH、
RCOOH溶液的pH,溶液中RCOOH、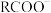 的微粒分布分数
的微粒分布分数 ,甲酸(HCOOH)与乙酸(
,甲酸(HCOOH)与乙酸( )中酸分子的分布分数与pH的关系如图所示。下列说法正确的是
)中酸分子的分布分数与pH的关系如图所示。下列说法正确的是
A.酸性强弱: |
B.pH=3的 溶液中: 溶液中: |
C.室温下 |
D.将1L浓度均为1 的 的 和HCOOH溶液混合后,加入80g NaOH固体充分反应并恢复至室温后,所得混合溶液中: 和HCOOH溶液混合后,加入80g NaOH固体充分反应并恢复至室温后,所得混合溶液中: |
您最近一年使用:0次