室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是
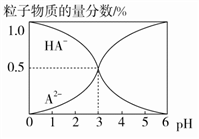

| A.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 |
B.H2A的电离方程式:H2A H++HA- H++HA- |
| C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA-)>c(A2-) |
| D.Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0 |
17-18高二下·湖北·期中 查看更多[2]
更新时间:2018-04-25 17:33:03
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,用0.10mol·L-1的氨水滴定10.00mL0.05mol·L-1的二元酸H2Y的溶液,滴定过程中加入氨水的体积(V)与溶液中lg 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是
A.H2Y的电离方程式为H2Y=H++HY-、HY- H++Y2- H++Y2- |
| B.滳定过程中,水电离出的H+浓度由大到小的顺序为P>N>M |
C.P点溶液中有:c(NH )=c(NH3•H2O)=2c(Y2-) )=c(NH3•H2O)=2c(Y2-) |
D.用x表示的NH3•H2O电离平衡常数值Kb= |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,某有机二元弱碱B(OH)2溶液中B(OH)2、B(OH)+、B2+的浓度之和为0.1 mol/L,微粒的分布分数δ{如 }随pH的变化关系如图所示。X、Z两点的坐标分别为(5.5,0.48)、(9.5,0.48)。下列说法不正确的是
}随pH的变化关系如图所示。X、Z两点的坐标分别为(5.5,0.48)、(9.5,0.48)。下列说法不正确的是
 }随pH的变化关系如图所示。X、Z两点的坐标分别为(5.5,0.48)、(9.5,0.48)。下列说法不正确的是
}随pH的变化关系如图所示。X、Z两点的坐标分别为(5.5,0.48)、(9.5,0.48)。下列说法不正确的是
| A.曲线①表示δ(B2+)随pH的变化关系 |
| B.Y点的横坐标约为7.5 |
| C.pH=11时,当溶液中c[B(OH)2]=0.1 mol/L,则c(B2+)=10-9 mol/L |
D. 的平衡常数K=104 的平衡常数K=104 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】25℃时,向25mL0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是( )


| A.在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
B.用含a的代数式表示CH3COOH的电离常数K=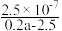 |
| C.C点对应的溶液中,水电离出的H+浓度大于10-7mol·L-1 |
| D.D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(OH-)-2c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】25℃时,在c(Na2CO3)+c(NaHCO3)=0.100mol·L-1的混合溶液中,c(HCO3-)、c(CO32-)与pH的关系如下图所示。下列说法正确的是


| A.pH=10的溶液中:c(HCO3-)<c(CO32-) |
| B.E点溶液中:c(Na+)=3c(CO32-) |
| C.pH=11的溶液中:c(H+)+c(Na+)+c(H2CO3)=c(OH-)+c(CO32-)+0.100mol·L-1 |
| D.在E点溶液中加入等体积0.100mol·L-1的NaOH溶液,c(CO32-)与c(HCO3-)之和保持不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
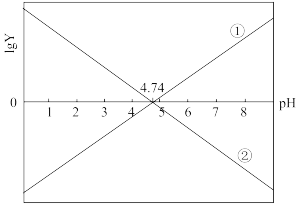
【推荐3】25℃时,分别向20mL浓度均1.0mol·L−1的CH3COOH、CH3COONa溶液中逐滴加入浓度均1.0mol·L−1NaOH、HCl溶液VmL,溶液的pH与lgY[Y= 或
或 ]的关系如图所示。下列说法
]的关系如图所示。下列说法不正确 的是
 或
或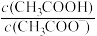 ]的关系如图所示。下列说法
]的关系如图所示。下列说法
A.曲线①中的Y= |
| B.当pH=4.74时,恒有关系:c(H+)+c(Na+)=c(OH−)+c(CH3COOH) |
| C.当滴入体积V=10mL时,溶液pH>4.74 |
| D.25℃时,1.0mol·L−1的CH3COONa的pH=9.37 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,已知某三元弱酸H3A的三级电离平衡常数分别为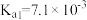 、
、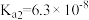 、
、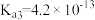 ,下列说法
,下列说法错误 的是
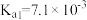 、
、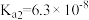 、
、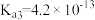 ,下列说法
,下列说法| A.Na3A的第一级水解平衡常数Kh1的数量级为10-2 |
B.在NaH2A溶液中: |
| C.0.1mol/L的Na3A和0.1mol/L的Na2HA溶液中水电离程度,前者大于后者 |
| D.向H3A溶液中加入NaOH溶液至中性时:c(Na+)=3c(A3-)+2c(HA2-)+c(H2A-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向20 mL浓度均为0.1 mol/LHX 和CH3COOH的混合液中滴加0.1 mol·L-1的NH3·H2O,测得混合液的电阻率与加入NH3·H2O 的体积(V)的关系如图所示。已知:物质的电阻率越大,导电能力越弱,CH3COOH的 ,NH3·H2O的
,NH3·H2O的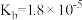 。下列说法错误的是
。下列说法错误的是

 ,NH3·H2O的
,NH3·H2O的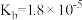 。下列说法错误的是
。下列说法错误的是
| A.常温时,0.1 mol/LHX的pH比0.1 mol/LCH3COOH 的pH小 |
| B.a→c过程中水的电离程度先增大后减小 |
| C.c点溶液中:c(CH3COO-)+c(X-)>c(NH4+) |
| D.d 点有4c(NH4+)+4c(NH3·H2O)=0.3mol/L |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】向0. 10 mol·L -1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f= ]与混合液pH的关系如图所示。下列说法正确的是
]与混合液pH的关系如图所示。下列说法正确的是

 ]与混合液pH的关系如图所示。下列说法正确的是
]与混合液pH的关系如图所示。下列说法正确的是
| A.f=0时,溶液中:c(Na+)=2c(CO32-) |
| B.f=0.5时,溶液中:c(HCO3-)>c(CO32-) |
| C.f= 1时,溶液中:c(Na+) + c(H+) = 2c(CO32-) + c(HCO3-)+c(OH-) |
| D.f=2时,溶液中:1/2c(Na+)=c(CO32-)+c( HCO3-)+c(H2CO3) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是


| A.b点溶液pH=5,此时酸碱恰好中和 |
| B.a~b点导电能力增强,说明HR为弱酸 |
| C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) |
| D.b~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】25℃下,向下列溶液中通入相应的气体至溶液呈中性。已知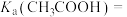
 。对所得溶液中微粒的浓度分析正确的是
。对所得溶液中微粒的浓度分析正确的是
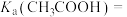
 。对所得溶液中微粒的浓度分析正确的是
。对所得溶液中微粒的浓度分析正确的是| 选项 | 原溶液 | 通入气体 | 分析 |
| A | NaClO |  |  |
| B |  | HI |  |
| C |  |  |   |
| D | 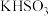 |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐3】25℃时,某酸H2R溶液中存在的各种含R元素微粒在总浓度中所占分数δ随溶液pH的变化关系如图所示。已知常温下Ksp(MR)=1.0×10-18,M2+不水解。下列叙述正确的是
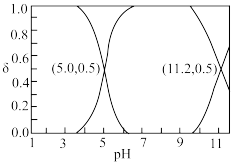
| A.常温下H2R的二级电离常数K的数量级为10-11 |
| B.NaHR溶液中,c(H2R)<c(R2-) |
C.反应H2R(aq)+M2+(aq) MR(s)+2H+(aq)的平衡常数K=101.8 MR(s)+2H+(aq)的平衡常数K=101.8 |
| D.向MR的饱和溶液中加酸调节至中性,则一定存在:2c(M2+)=2c(R2-)+c(HR-) |
您最近一年使用:0次


 H++HA-,HA-
H++HA-,HA-  H++A2
H++A2

