下列溶液中微粒的物质的量浓度关系正确的是
| A.室温下,向0.01mol/LNH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)> c(OH-)= c(H+) |
| B.Na2CO3溶液:c(Na+)+ c(H+)=c(HCO3-)+c(CO32-)+ c(OH-) |
| C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO3-)+c(H2CO3) |
| D.氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) |
更新时间:2017-03-16 19:48:07
|
相似题推荐
单选题
|
较难
(0.4)
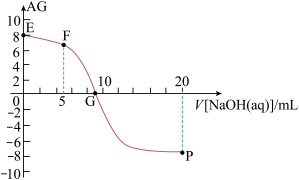
【推荐1】已知AG=lg ,电离度a=
,电离度a=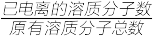 ×l00%。常温下,向l0mL0.lmol•L-1HX溶液中滴加0.lmol•L-1NaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。下列说法错误的是
×l00%。常温下,向l0mL0.lmol•L-1HX溶液中滴加0.lmol•L-1NaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。下列说法错误的是
 ,电离度a=
,电离度a=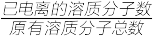 ×l00%。常温下,向l0mL0.lmol•L-1HX溶液中滴加0.lmol•L-1NaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。下列说法错误的是
×l00%。常温下,向l0mL0.lmol•L-1HX溶液中滴加0.lmol•L-1NaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。下列说法错误的是
A.点P前随着NaOH溶液的加入, 增大 增大 | B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-) |
| C.V=10时,溶液中c(OH-)>c(HX) | D.常温下,HX的电离度约为0.1% |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,下图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA- ,Ⅲ代表A2-,下列说法正确的是
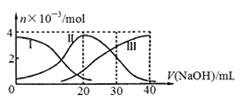
| A.H2A在水中的电离方程式是:H2A═2H++A2- |
| B.当V(NaOH)=40mL时,其溶液中水的电离受到抑制 |
| C.当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| D.当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】已知:常温下邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是( )
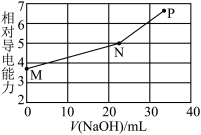

| A.M点离子浓度:c(K+)>c(HA-)>c(H2A)>c(A2-) |
| B.N点溶液中存在:c(Na+)+c(K+)>2c(A2-)+2c(HA-) |
| C.P点溶液中一定存在:c(Na+)>c(K+)>c(OH-)>c(A2-) |
| D.从M到P之间的任一点均存在:c(Na+)+c(K+)+c(H+)=c(A2-)+c(HA-)+c(OH-) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】已知:25℃下,H2C2O4的Ka1=5.6×10-2,Ka2=5.4×10-5。25℃时,向20mL 0.1000mol/L H2C2O4溶液中滴加0.1000mol/L NaOH溶液,混合溶液pH随加入NaOH溶液体积的变化如图所示(不考虑反应过程中温度变化)。下列有关叙述不正确的是( )


| A.点②所示溶液中:2c(H+)+c(HC2O4-)+3c(H2C2O4)=2c(OH-)+c(C2O42-) |
| B.点③所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+) |
| C.滴定过程中c(Na+)+c(HC2O4-)+c(C2O42-)+ c(H2C2O4)=0.1000mol/L |
| D.滴定过程中可能出现:c(Na+)>c(HC2O4-)=c(C2O42-)>c(OH-)>c(H+) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】常温下向1L 0.1 mol·L-1一元弱酸HR溶液中缓慢加入一元碱MOH(加入MOH过程中溶液的温度和溶液的体积变化忽略不计),lg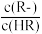 随溶液pH 变化的部分图象如下图所示[已知:Kb(MOH)>Ka(HR)],下列叙述中正确的是
随溶液pH 变化的部分图象如下图所示[已知:Kb(MOH)>Ka(HR)],下列叙述中正确的是
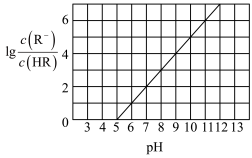
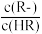 随溶液pH 变化的部分图象如下图所示[已知:Kb(MOH)>Ka(HR)],下列叙述中正确的是
随溶液pH 变化的部分图象如下图所示[已知:Kb(MOH)>Ka(HR)],下列叙述中正确的是
| A.常温下,Ka(HR)=1×10-6 |
| B.常温下,0.1 mol·L-1的HR溶液的pH约为3 |
| C.当HR与MOH恰好完全反应时,溶液中c(R-)>c(M+) |
| D.当溶液呈中性时,c(HR)=c(R-) |
您最近一年使用:0次

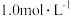 的某二元弱酸
的某二元弱酸 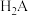 溶液中逐滴加入 NaOH 溶液,
溶液中逐滴加入 NaOH 溶液, A、
A、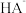 、
、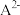 的物质的量分 数随 pH 的变化如图所示。下列叙述正确的是
的物质的量分 数随 pH 的变化如图所示。下列叙述正确的是
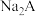 混合物溶于水,所得溶液中
混合物溶于水,所得溶液中 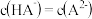
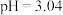 时,溶液中微粒浓度的大小关系为:
时,溶液中微粒浓度的大小关系为:
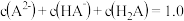
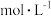
 ,溶液 pH 在
,溶液 pH 在  之间为最佳
之间为最佳

