氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与NaOH溶液反应)中 AlN的含量,某实验小组设计了如下两种实验方案。已知:AlN+NaOH+H2O=NaAlO2+NH3↑
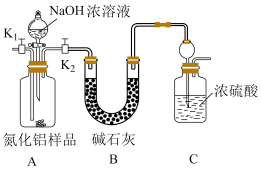
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图装置中,U形管B中所装固体为________ ,C中球形干燥管的作用是____________________ 。
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是___________________ 。
(3)由于上述装置还存在____________ 缺陷,导致测定结果偏高。
【方案2】按以下步骤测定样品中AlN的纯度:
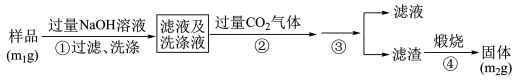
(4)步骤②生成沉淀的离子方程式为___________________ 。
(5)步骤③的操作中用到的主要玻璃仪器是_________ 。AlN的纯度是__________ (用m1、m2表示)。
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图装置中,U形管B中所装固体为
(2)关闭K1打开K2,再打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是
(3)由于上述装置还存在
【方案2】按以下步骤测定样品中AlN的纯度:

(4)步骤②生成沉淀的离子方程式为
(5)步骤③的操作中用到的主要玻璃仪器是
更新时间:2017-03-16 19:48:07
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________ 。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________ 。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________________ 。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________ 。
(5)步骤④的离子方程式是_________________________________________ 。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________________ 。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______ (用a表示)。

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2•xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2•xH2O滤渣,用平衡移动的原理解释得到滤渣的原因
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因
(5)步骤④的离子方程式是
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】铁黄 是一种重要的化工产品。
是一种重要的化工产品。
(1)制备铁黄:向一定浓度 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄.通入氧气过程中,记录溶液pH变化如题所示。
溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄.通入氧气过程中,记录溶液pH变化如题所示。

已知:25℃,pH=8.5时, 恰好沉淀完全
恰好沉淀完全 。
。
①加氨水至pH为6.0时,溶液中残留 浓度为
浓度为_________  。
。
②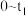 时段,溶液pH几乎不变;
时段,溶液pH几乎不变; 时段,溶液pH明显降低。请解释原因:
时段,溶液pH明显降低。请解释原因:_____________ 。
(2) 在催化剂
在催化剂 的表面上,分解产生
的表面上,分解产生 。
。 较
较 和
和 更易与烟气中的
更易与烟气中的 发生反应生成
发生反应生成 。当一定浓度
。当一定浓度 溶液与烟气以一定的流速经过装有催化剂
溶液与烟气以一定的流速经过装有催化剂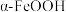 的反应管,
的反应管, 的脱除效率与温度的关系如图所示。仅用相同浓度相同流速的
的脱除效率与温度的关系如图所示。仅用相同浓度相同流速的 溶液通过反应管(无催化剂进行实验测得:随着温度升高,
溶液通过反应管(无催化剂进行实验测得:随着温度升高, 热分解速率加快,升温至
热分解速率加快,升温至 以上,
以上, 大量汽化。
大量汽化。
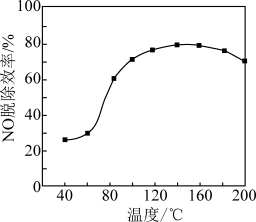
① 时,随着温度升高
时,随着温度升高 的脱除效率显著提高的原因是
的脱除效率显著提高的原因是_________________ 。
②温度高于 的脱除效率降低的原因是
的脱除效率降低的原因是________________ 。
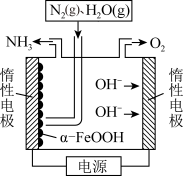
(3)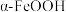 用于常压电化学法合成氨.该电解装置如图所示。在阴极
用于常压电化学法合成氨.该电解装置如图所示。在阴极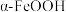 参与反应,电解前后
参与反应,电解前后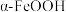 的质量不变。该电极的反应过程可描述为
的质量不变。该电极的反应过程可描述为_________________ 。
 是一种重要的化工产品。
是一种重要的化工产品。(1)制备铁黄:向一定浓度
 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄.通入氧气过程中,记录溶液pH变化如题所示。
溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄.通入氧气过程中,记录溶液pH变化如题所示。
已知:25℃,pH=8.5时,
 恰好沉淀完全
恰好沉淀完全 。
。①加氨水至pH为6.0时,溶液中残留
 浓度为
浓度为 。
。②
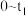 时段,溶液pH几乎不变;
时段,溶液pH几乎不变; 时段,溶液pH明显降低。请解释原因:
时段,溶液pH明显降低。请解释原因:(2)
 在催化剂
在催化剂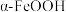 的表面上,分解产生
的表面上,分解产生 。
。 较
较 和
和 更易与烟气中的
更易与烟气中的 发生反应生成
发生反应生成 。当一定浓度
。当一定浓度 溶液与烟气以一定的流速经过装有催化剂
溶液与烟气以一定的流速经过装有催化剂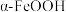 的反应管,
的反应管, 的脱除效率与温度的关系如图所示。仅用相同浓度相同流速的
的脱除效率与温度的关系如图所示。仅用相同浓度相同流速的 溶液通过反应管(无催化剂进行实验测得:随着温度升高,
溶液通过反应管(无催化剂进行实验测得:随着温度升高, 热分解速率加快,升温至
热分解速率加快,升温至 以上,
以上, 大量汽化。
大量汽化。

①
 时,随着温度升高
时,随着温度升高 的脱除效率显著提高的原因是
的脱除效率显著提高的原因是②温度高于
 的脱除效率降低的原因是
的脱除效率降低的原因是(3)
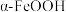 用于常压电化学法合成氨.该电解装置如图所示。在阴极
用于常压电化学法合成氨.该电解装置如图所示。在阴极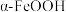 参与反应,电解前后
参与反应,电解前后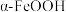 的质量不变。该电极的反应过程可描述为
的质量不变。该电极的反应过程可描述为
您最近一年使用:0次
【推荐3】氧化铈 (CeO2) 是一种广泛应用的稀土氧化物。现以氟碳铈矿 (含 CeFCO3、BaO、SiO2等)为原料制备氧化铈,其工艺流程如图所示;
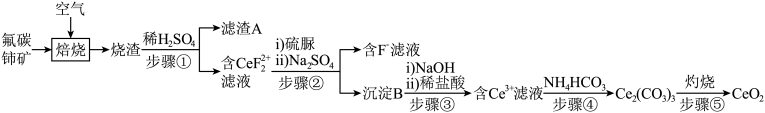
已知:
①稀土离子易与 形成复盐沉淀。
形成复盐沉淀。
②硫脲: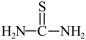 具有还原性,酸性条件下易被氧化为(SCN2H3)2.
具有还原性,酸性条件下易被氧化为(SCN2H3)2.
③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀。
回答下列问题:
(1)“焙烧”时,氧化数据如表所示:
在对流空气氧化炉中可大大缩短氧化时间的原因是 ___________ 。
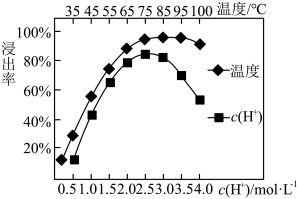
(2)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,则使Ce的浸出率最高应该选择的条件是___________ 。
(3)加入硫脲的目的是将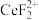 还原为Ce3+,反应的离子方程式为
还原为Ce3+,反应的离子方程式为 ___________ 。步骤③加入盐酸后,通常还需加另一种化学试剂X,根据题中信息推测___________ 。
(4)步骤④的离子方程式为___________ 。若“沉铈”中,Ce3+恰好沉淀完全[c(Ce3+)为1.0×10﹣5mol/L,此时溶液的pH为5,则溶液中c( )=
)=___________ mol/L(保留2位有效数字)。{已知常温下Ka1(H2CO3)=4.3×10﹣7,Ka2(H2CO3)=5.6×10﹣11,Ksp[Ce2(CO3)3]=1.0×10﹣28}。
(5)若Ce2(CO3)3经步骤⑤充分灼烧后质量减少5.8t,则获得CeO2的质量为___________ t。
(6)Ce4+溶液可以吸收大气中的污染物NOx减少空气污染,其转化过程如图所示(以NO2为例)该转化过程中的催化剂为___________ 。


已知:
①稀土离子易与
 形成复盐沉淀。
形成复盐沉淀。②硫脲:
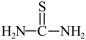 具有还原性,酸性条件下易被氧化为(SCN2H3)2.
具有还原性,酸性条件下易被氧化为(SCN2H3)2.③Ce3+在空气中易被氧化为Ce4+,两者均能形成氢氧化物沉淀。
回答下列问题:
(1)“焙烧”时,氧化数据如表所示:
| 空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
| 暴露空气中 | 450~500 | 80 | 14 |
| 对流空气氧化炉中 | 450~500 | 98 | 6 |
(2)焙烧后加入稀硫酸浸出,Ce的浸出率和稀硫酸浓度、温度有关,其关系如图所示,则使Ce的浸出率最高应该选择的条件是

(3)加入硫脲的目的是将
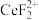 还原为Ce3+,反应的离子方程式为
还原为Ce3+,反应的离子方程式为 (4)步骤④的离子方程式为
 )=
)=(5)若Ce2(CO3)3经步骤⑤充分灼烧后质量减少5.8t,则获得CeO2的质量为
(6)Ce4+溶液可以吸收大气中的污染物NOx减少空气污染,其转化过程如图所示(以NO2为例)该转化过程中的催化剂为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO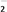 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO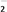 的离子方程式为
的离子方程式为____________________ 。
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是________ (至少写一条)。
(2)H2O2的作用是______________ 。
(3)调pH=8是为了除去__________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+ H2O===
H2O=== Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________ 。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________ ;
②________________________________________________________________________ ;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
(一)染料工业排放的废水中含有大量有毒的NO
 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO 的离子方程式为
的离子方程式为(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)H2O2的作用是
(3)调pH=8是为了除去
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是
(5)试配平氧化还原反应方程式:
 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+ H2O===
H2O=== Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①
②
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】明矾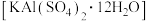 是一种常用的净水剂。实验室以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的流程如下:
是一种常用的净水剂。实验室以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的流程如下:
(1)“碱溶”步骤中发生反应的化学方程式为__________ 。
(2)“沉铝”步骤在煮沸条件下进行,生成 、
、 和
和 ,检验滤液中钠离子的具体操作为
,检验滤液中钠离子的具体操作为__________ 。
(3)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如题图所示,现提供实验所需 固体。制备明矾晶体的实验方案为:将“酸溶”所得溶液转移至蒸发皿中,
固体。制备明矾晶体的实验方案为:将“酸溶”所得溶液转移至蒸发皿中,__________ 至有晶膜出现停止加热,将蒸发液转移至烧杯中,升温至__________ ,少量多次加入__________ ,趁热过滤,再将滤液降温至_____ ,过滤,冷水洗涤,干燥,得到明矾晶体。
取10.00g明矾样品配成500mL溶液,备用。取50.00mL待测液,调节溶液pH约为3.5,加入 (乙二胺四乙酸二钠)标准溶液,加热至沸腾,使
(乙二胺四乙酸二钠)标准溶液,加热至沸腾,使 与
与 迅速反应;待反应完成后调节溶液pH至5~6,加入二甲酚橙指示剂,再用
迅速反应;待反应完成后调节溶液pH至5~6,加入二甲酚橙指示剂,再用 的
的 标准溶液滴定过量的
标准溶液滴定过量的 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液的体积为8.20mL。已知:
标准溶液的体积为8.20mL。已知: ;反应过程中发生的离子反应式有:
;反应过程中发生的离子反应式有: ,
, 。
。
(4)明矾晶体的纯度为__________ (写出计算过程)。
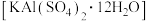 是一种常用的净水剂。实验室以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的流程如下:
是一种常用的净水剂。实验室以废易拉罐(主要成分为铝和少量不溶于碱性溶液的物质)为原料制取明矾晶体的流程如下:
(1)“碱溶”步骤中发生反应的化学方程式为
(2)“沉铝”步骤在煮沸条件下进行,生成
 、
、 和
和 ,检验滤液中钠离子的具体操作为
,检验滤液中钠离子的具体操作为(3)已知明矾、硫酸铝、硫酸钾的溶解度随温度的变化如题图所示,现提供实验所需
 固体。制备明矾晶体的实验方案为:将“酸溶”所得溶液转移至蒸发皿中,
固体。制备明矾晶体的实验方案为:将“酸溶”所得溶液转移至蒸发皿中,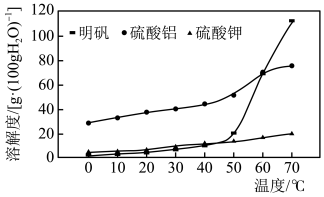
取10.00g明矾样品配成500mL溶液,备用。取50.00mL待测液,调节溶液pH约为3.5,加入
 (乙二胺四乙酸二钠)标准溶液,加热至沸腾,使
(乙二胺四乙酸二钠)标准溶液,加热至沸腾,使 与
与 迅速反应;待反应完成后调节溶液pH至5~6,加入二甲酚橙指示剂,再用
迅速反应;待反应完成后调节溶液pH至5~6,加入二甲酚橙指示剂,再用 的
的 标准溶液滴定过量的
标准溶液滴定过量的 ,至滴定终点时消耗
,至滴定终点时消耗 标准溶液的体积为8.20mL。已知:
标准溶液的体积为8.20mL。已知: ;反应过程中发生的离子反应式有:
;反应过程中发生的离子反应式有: ,
, 。
。(4)明矾晶体的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]是棕色或绿色的鳞片或粉末,易溶于水,不溶于乙醇和乙醚等有机溶剂,常用于照相业、制药工业,还可作为食品铁强化剂,实验室利用柠檬酸(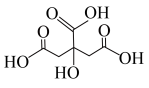 )制备柠檬酸铁铵的步骤如下:
)制备柠檬酸铁铵的步骤如下:

ⅱ.用冷水降温至40℃,再用仪器C滴加一定量的浓氨水充分反应,生成柠檬酸亚铁铵[NH4FeC6H5O7];
ⅲ.继续控温40℃,再用另一个仪器C缓慢滴加一定量的双氧水充分反应;
ⅳ.再向溶液中加入大量的乙醇,经一系列操作,称量得到mg产品。
已知:柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]是柠檬酸铁(FeC6H5O7)和柠檬酸铵[(NH4)3C6H5O7]形成的复盐;5%柠檬酸铁铵的pH约为6.5。
回答下列问题:
(1)仪器A的名称是
(2)步骤ⅱ、ⅲ中均需控温40℃的原因是
(3)步骤ⅲ中制备柠檬酸铁铵的化学方程式
(4)步骤ⅳ中,完成“一系列操作”所需要的装置有

 +6HCHO=3H++6H2O+(CH2)6N4H+、[与NaOH反应时,lmol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用0.1mol/LNaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为16.00mL。
+6HCHO=3H++6H2O+(CH2)6N4H+、[与NaOH反应时,lmol(CH2)6N4H+与1molH+相当]。摇匀、静置5min后,加入1~2滴酚酞试液,用0.1mol/LNaOH标准溶液滴定至终点,消耗NaOH标准溶液的体积为16.00mL。①则x=
②下列操作使测定的y值偏大的是
a.分成两等份时,第一份质量小于第二份的质量
b.在空气中灼烧时,产品没有完全反应就冷却、称量
c.用滴定管量取25.00mL溶液时,先俯视、后仰视读数
d.用NaOH标准溶液滴定时,开始尖嘴有气泡,结束时无气泡
您最近一年使用:0次
【推荐1】工业制硫酸的尾气中含有一定量SO2,处理尾气的手段除了氨吸收法以外还有以下几种方法。
(一)工业实际吸收过程中,第Ⅰ步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氟化后制得产品A。
(1)产品A是_______ (填化学式)。
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?_______ (填“可以”、“不可以”或“不确定”)原因是_______ 。
(二)制备MnSO4•H2O:SO2还原MnO2矿制备MnSO4•H2O,过程如下:
已知25℃时部分物质的溶度积常数如下表:
(3)还原时,若尾气中SO2含量为4.48%,除去标况下lm3尾气至少需要含锰质量分数为55%的MnO2 矿粉_______ g。
(4)除铁时加入碳酸钙,发生的反应的离子反应方程式为_____________________ 。
(5)试剂A最好是______________ (写化学式)。
(6)操作I的名称为_________________ 。MnSO4•H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是________________ 。
(一)工业实际吸收过程中,第Ⅰ步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氟化后制得产品A。
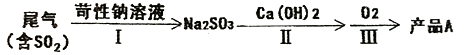
(1)产品A是
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?
(二)制备MnSO4•H2O:SO2还原MnO2矿制备MnSO4•H2O,过程如下:

已知25℃时部分物质的溶度积常数如下表:
物质 | Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | MnS | FeS | CuS |
溶度积 | 2.1×10-13 | 4.0× 10-38 | 2.2×10-23 | 1.0×10-11 | 6.3×10-18 | 6.3×10-38 |
(3)还原时,若尾气中SO2含量为4.48%,除去标况下lm3尾气至少需要含锰质量分数为55%的MnO2 矿粉
(4)除铁时加入碳酸钙,发生的反应的离子反应方程式为
(5)试剂A最好是
(6)操作I的名称为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
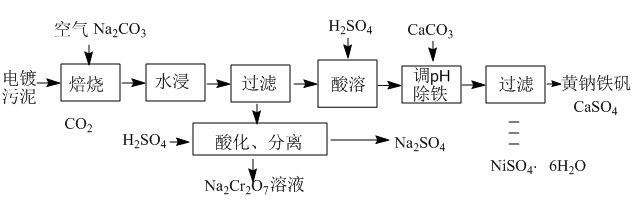
【推荐2】电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4·6H2O 晶体,实现有害物质的资源化利用。已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。
(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为_______________ 。
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:_________________ 。
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。

则除铁时应控制溶液的pH为____________ (填序号)。
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为___________ 。
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是____________ 。
(4)从滤液中获取NiSO4·6H2O晶体的操作为________ 、冷却结晶、过滤、_________ 、干燥。

(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。

则除铁时应控制溶液的pH为
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是
(4)从滤液中获取NiSO4·6H2O晶体的操作为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
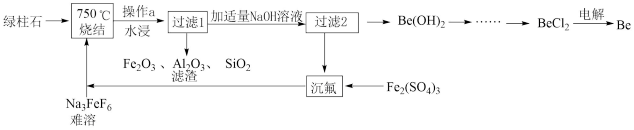
【推荐3】铍有“超级金属”之称。以绿柱石 为原料制备金属铍的工艺如下:
为原料制备金属铍的工艺如下:
已知 可与
可与 、
、 结合成配位数为4的配离子。回答下列问题:
结合成配位数为4的配离子。回答下列问题:
(1)烧结冷却后,水浸之前“操作a”的名称是___ 。
(2)750℃烧结时,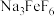 与绿柱石作用生成易溶于水的
与绿柱石作用生成易溶于水的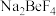 ,写出该反应的化学方程式
,写出该反应的化学方程式___ 。
(3)已知25℃时 ,计算室温时
,计算室温时 开始沉淀时的pH=
开始沉淀时的pH=__ ,“沉氟”反应的离子方程式为_ 。
(4)上述流程中,“ ”可有两种方案:
”可有两种方案:
I: 溶液A
溶液A
II:
I中操作b是___ 。II中 转化为
转化为 的化学方程式为
的化学方程式为___ 。
(5) 在气态时常以二聚体形式存在,此二聚体分子的结构式为
在气态时常以二聚体形式存在,此二聚体分子的结构式为__ ;工业上电解 与
与 熔融体制得金属铍,
熔融体制得金属铍, 的作用是
的作用是___ ,阴极反应式为__ 。
 为原料制备金属铍的工艺如下:
为原料制备金属铍的工艺如下:
已知
 可与
可与 、
、 结合成配位数为4的配离子。回答下列问题:
结合成配位数为4的配离子。回答下列问题:(1)烧结冷却后,水浸之前“操作a”的名称是
(2)750℃烧结时,
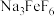 与绿柱石作用生成易溶于水的
与绿柱石作用生成易溶于水的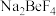 ,写出该反应的化学方程式
,写出该反应的化学方程式(3)已知25℃时
 ,计算室温时
,计算室温时 开始沉淀时的pH=
开始沉淀时的pH=(4)上述流程中,“
 ”可有两种方案:
”可有两种方案:I:
 溶液A
溶液A
II:

I中操作b是
 转化为
转化为 的化学方程式为
的化学方程式为(5)
 在气态时常以二聚体形式存在,此二聚体分子的结构式为
在气态时常以二聚体形式存在,此二聚体分子的结构式为 与
与 熔融体制得金属铍,
熔融体制得金属铍, 的作用是
的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
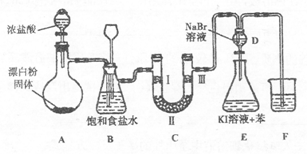
(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:________ 。
(2)装置B中饱和食盐水的作用是______ ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是_________ (填字母编号)。
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是______ ,该现象____ (填“能”或“不能”) 说明溴单质的氧化性强于碘,原因是________ 。
(5)装置F的烧杯中的溶液不能选用下列中的_________ (填字母编号)。
A.饱和NaOH溶液 B.饱和Ca(OH)2溶液 C.饱和Na2CO3溶液

(1)装置A是氯气的发生装置,请写出该反应相应的化学方程式:
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | I | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的烧杯中的溶液不能选用下列中的
A.饱和NaOH溶液 B.饱和Ca(OH)2溶液 C.饱和Na2CO3溶液
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热易脱水、升华,170℃以上分解。常温下它的电离常数K1=5.4×10-2,K2=5.4×10-5。回答下列问题:
(1)查阅资料知:草酸晶体175℃分解成CO2、CO、H2O,请写出草酸晶体分解的化学反应方程式:_____ 。
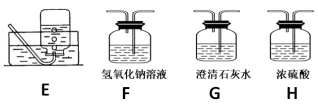
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量CO气体,最佳的连接顺序为:________ 。(填字母序号)

(3)设计实验证明草酸为弱酸的方案及其现象均正确的有_____________ (填序号)。
A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小;
B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5;
C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL。
(4)现需要配制900mL1mol/L的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、_________ 、__________ (填仪器名称)。
②下列操作会使所配溶液浓度偏低的是__________ 。(填字母)
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为_____________________________________________ 。
②量取KMnO4样品溶液应选用__________ (填“酸式”或“碱式”)滴定管;若量取KMnO4样品溶液的滴定管用蒸馏水洗净后未润洗,则最终的测定结果将________ (填“偏大”、“偏小”或“不变”)。
③现取KMnO4粗品10g,配成100mL溶液,取25.0 mL用(4)中配制的草酸溶液滴定,并进行3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,请问KMnO4粗品的质量分数为______________ 。(已知:KMnO4的摩尔质量为158g/mol)
(1)查阅资料知:草酸晶体175℃分解成CO2、CO、H2O,请写出草酸晶体分解的化学反应方程式:
(2)请用下列的装置(图中加热装置已略去)分解草酸晶体以制备少量CO气体,最佳的连接顺序为:


(3)设计实验证明草酸为弱酸的方案及其现象均正确的有
A.室温下,测0.1mol/L的H2C2O4溶液与H2SO4溶液的pH,硫酸溶液的pH比草酸的小;
B.室温下,取pH=3的H2C2O4溶液稀释100倍后,测其pH<5;
C.标况下,取0.10mol/L的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL。
(4)现需要配制900mL1mol/L的草酸溶液。
①需要的仪器有托盘天平(带砝码)、钥匙、烧杯、量筒、胶头滴管、
②下列操作会使所配溶液浓度偏低的是
A.称量时用了生锈的砝码
B.容量瓶未干燥即用来配制溶液
C.H2C2O4·2H2O晶体失去了部分结晶水
D.定容时,仰视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
(5)用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①滴定过程中反应的离子方程式为
②量取KMnO4样品溶液应选用
③现取KMnO4粗品10g,配成100mL溶液,取25.0 mL用(4)中配制的草酸溶液滴定,并进行3次平行实验,所用的草酸溶液的体积分别为23.00 mL、20.02 mL、19.98 mL,请问KMnO4粗品的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】铁红(Fe2O3)常用于油漆、油墨及橡胶工业,常用FeCO3焙烧生成铁红。研究小组采用如下装置制取FeCO3(C后及夹持装置略),操作的关键是向Na2CO3溶液中通入一段时间CO2至溶液呈中性,再滴加一定量FeCl2溶液,产生白色沉淀。
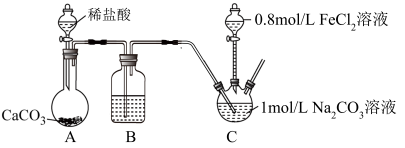
(1)A中反应的离子方程式_______ ;
(2)B中所用试剂为_______ ;
a.饱和食盐水b.浓硫酸c.饱和碳酸钠d.饱和碳酸氢钠e.氢氧化钠溶液
(3)先向1mol/LNa2CO3溶液中通入CO2的目的是_______ ;
(4)C装置中生成FeCO3的离子方程式为______ ;
(5)实验结束后,检验C中的溶液是否还存在亚铁离子,不能用酸性高锰酸钾溶液的原因是:________ 。

(1)A中反应的离子方程式
(2)B中所用试剂为
a.饱和食盐水b.浓硫酸c.饱和碳酸钠d.饱和碳酸氢钠e.氢氧化钠溶液
(3)先向1mol/LNa2CO3溶液中通入CO2的目的是
(4)C装置中生成FeCO3的离子方程式为
(5)实验结束后,检验C中的溶液是否还存在亚铁离子,不能用酸性高锰酸钾溶液的原因是:
您最近一年使用:0次



