是一种重要的化工产品。
是一种重要的化工产品。(1)制备铁黄:向一定浓度
 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄.通入氧气过程中,记录溶液pH变化如题所示。
溶液中加入氨水,产生白色沉淀,并很快变成灰绿色.当滴加氨水至pH为6.0时,停止滴加氨水,开始通氧气,生成铁黄.通入氧气过程中,记录溶液pH变化如题所示。
已知:25℃,pH=8.5时,
 恰好沉淀完全
恰好沉淀完全 。
。①加氨水至pH为6.0时,溶液中残留
 浓度为
浓度为 。
。②
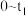 时段,溶液pH几乎不变;
时段,溶液pH几乎不变; 时段,溶液pH明显降低。请解释原因:
时段,溶液pH明显降低。请解释原因:(2)
 在催化剂
在催化剂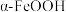 的表面上,分解产生
的表面上,分解产生 。
。 较
较 和
和 更易与烟气中的
更易与烟气中的 发生反应生成
发生反应生成 。当一定浓度
。当一定浓度 溶液与烟气以一定的流速经过装有催化剂
溶液与烟气以一定的流速经过装有催化剂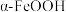 的反应管,
的反应管, 的脱除效率与温度的关系如图所示。仅用相同浓度相同流速的
的脱除效率与温度的关系如图所示。仅用相同浓度相同流速的 溶液通过反应管(无催化剂进行实验测得:随着温度升高,
溶液通过反应管(无催化剂进行实验测得:随着温度升高, 热分解速率加快,升温至
热分解速率加快,升温至 以上,
以上, 大量汽化。
大量汽化。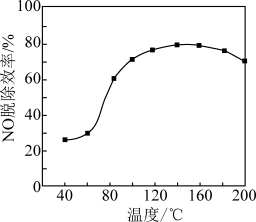
①
 时,随着温度升高
时,随着温度升高 的脱除效率显著提高的原因是
的脱除效率显著提高的原因是②温度高于
 的脱除效率降低的原因是
的脱除效率降低的原因是(3)
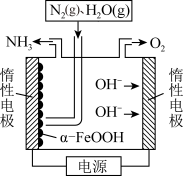
 用于常压电化学法合成氨.该电解装置如图所示。在阴极
用于常压电化学法合成氨.该电解装置如图所示。在阴极 参与反应,电解前后
参与反应,电解前后 的质量不变。该电极的反应过程可描述为
的质量不变。该电极的反应过程可描述为相似题推荐
| 序号 | 实验试剂(20℃) | 实验现象 |
| Ⅰ | 过量铜粉、2mL0.5mol/LHNO3 | 无色气体(遇空气变红棕色),溶液变为蓝色 |
| Ⅱ | 过量铁粉、2mL0.5mol/LHNO3 | 6mL无色气体(经检测为H2),溶液几乎无色 |
(2)Ⅱ中生成H2的离子方程式是
(3)研究Ⅱ中的氧化剂。
① 甲同学通过理论分析,认为NO
 也能被还原。其依据是
也能被还原。其依据是② 乙认为该浓度的硝酸中H+的氧化性大于NO
 ,所以NO
,所以NO 没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是
没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是③ 丙同学通过实验证实了反应后的溶液中含有NH
 。生成NH
。生成NH 的离子方程式是
的离子方程式是(4)丙同学进一步研究了Al与NO
 反应的情况。
反应的情况。| 序号 | 实验试剂(20℃) | 实验现象 |
| Ⅲ | 铝粉、稀硝酸 | 溶液无色,试管上方呈浅红棕色 |
| Ⅳ | 铝粉、NaNO3溶液、几滴NaOH | 产生大量气泡,能使湿润红色石蕊试纸变蓝 |
| Ⅴ | 铝粉、NaNO3溶液 | 产生气泡,能使湿润红色石蕊试纸变蓝 |
 反应时,影响NO
反应时,影响NO 还原产物不同的因素有
还原产物不同的因素有(5)将一定质量的铁粉加入装有100mL某浓度稀硝酸的容器中充分反应,容器中剩余铁粉,收集到NO气体448mL(标准状况下),所得溶液溶质的化学式是
【推荐2】钛铁铳矿可有效富集回收矿石中铁、钛、钪金属,获得铁精矿、钛精矿、钪精矿等主产品。从钛铁钪矿(主要成分有Sc2O3、FeTiO3、SiO2等)中制备草酸铳晶[Sc2(C2O4)3•5H2O]流程如下:
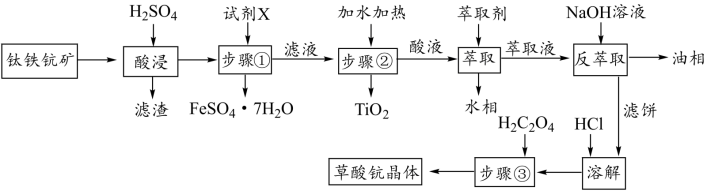
已知:①钪的萃取是根据协萃反应机理,利用P-204(磷酸二辛酯)[可用H2A2表示]和TBP(磷酸三辛酯)两种萃取剂,以煤油做萃取溶剂,将废酸中的钪以配位体形式萃取出来,经反萃取、提纯,从而得到高纯度的钪的氢氧化物。主要反应步骤由以下方程式表示萃取:Sc3++3H2A2+xH2O Sc(HA2)3•xH2O+3H+
Sc(HA2)3•xH2O+3H+
Sc(HA2)3•xH2O+xTBP Sc(HA2)3•xTBP+xH2O
Sc(HA2)3•xTBP+xH2O
②常温下Sc(OH)3的Ksp约为1.0×10-31
请回答下列问题:
(1)酸浸时为了提高酸浸速率,可采取的措施
(2)酸浸时“FeTiO3”溶解的离子方程式为
(3)步骤①的操作是浓缩、冷却、
(4)步骤②加大量的水稀释,同时加热的原因为
(5)“反萃取”的化学方程式为
(6)称取2.22g步骤③得到的草酸钪晶体[Sc2(C2O4)3•5H2O],在一定温度下加热得到0.69g固体,通过计算确定固体成分化学式为
(7)常温下,使0.1mol/LScCl3溶液中钪离子开始沉淀时的pH为
 的工艺流程如图。
的工艺流程如图。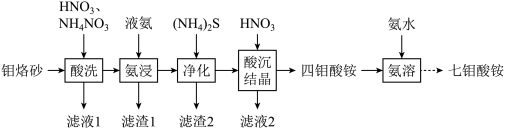
已知:生成多钼酸铵的种类主要由溶液的pH来决定
二钼酸铵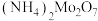 | 四钼酸铵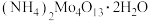 | 七钼酸铵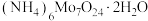 | |
| pH | 8.0~9.0 | 2.0~2.5 | 6.0~7.0 |
(1)
 的Mo的化合价是
的Mo的化合价是(2)“酸洗”时,
 被稀
被稀 氧化为
氧化为 和H2SO4,反应的离子方程式为
和H2SO4,反应的离子方程式为(3)“净化”时, 若浸出液中还残留
 、
、 , 可转化为硫化物沉淀除去。
, 可转化为硫化物沉淀除去。已知
 ,该溶液中
,该溶液中 和pH的关系为:
和pH的关系为: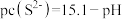 。为了使溶液中的杂质离子浓度小于
。为了使溶液中的杂质离子浓度小于 ,应控制溶液的pH不小于
,应控制溶液的pH不小于 ;CuS和FeS的
;CuS和FeS的 分别为35.2和17.2)
分别为35.2和17.2)(4)“净化”后,溶液中若有低价钼(以
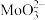 表示),可以加入适量的
表示),可以加入适量的 将其氧化为
将其氧化为 ,反应的离子方程式为
,反应的离子方程式为(5)“酸沉结晶”使用
 的目的是
的目的是(6)“氨溶”后,通过降温结晶可得到七钼酸铵。由图可知应选用最佳结晶条件为
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
(2)探究浓度对化学反应速率的影响,应选择
(3)若同时选择①②③溶液变浑浊的时间,探究
(4)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是
甲同学设计如下实验流程探究Na2S2O3的化学性质。
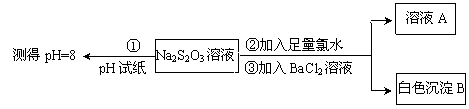
(5)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(6)加入BaCl2溶液生成白色沉淀B的离子方程式是
(7)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
(1)乙酸是合成乙酸乙酯的重要原料,制备原理如下:
CH3COOH(l)+ C2H5OH(l)
 CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol
CH3COOHC2H5(l)+H2O(l) △H=-8.62kJ/mol已知:CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78 ℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示:
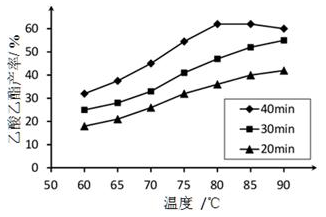
①该研究小组的实验目的是
②如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是
③利用此原理制得的乙酸乙酯粗品中常含有一定量的乙酸、乙醇以及微量的硫酸,提纯时可向粗品中加入
(2)乙二酸俗名草酸(二元弱酸,结构简式:HOOC—COOH),被广泛的应用于抗生素类药物的合成。
①实验室中经常利用酸性KMnO4溶液滴定法测其纯度。已知草酸与酸性KMnO4溶液反应过程有无色无味气体产生,且KMnO4溶液紫色褪去,写出草酸与酸性KMnO4溶液反应的离子方程式
②资料表明:25℃时草酸的电离平衡常数Ka1=6.0×10-2;Ka2=6.4×10-5;据此分析,室温时草酸氢钾(KHC2O4)的水解反应平衡常数Kh=

回答下列问题:
(1)为提高第③步的浸出速率,可采取的措施之一是
(2)第④步通入
 ,将溶液的pH调至10-11时,
,将溶液的pH调至10-11时, 完全转化为
完全转化为 和
和 。第①步碱熔时发生反应的化学方程式为
。第①步碱熔时发生反应的化学方程式为(3)第⑥步母液中主要含有的溶质一定有
 、
、 和
和(4)调节溶液pH可实现工业废气
 的捕获和释放。已知25℃时碳酸的电离常数为
的捕获和释放。已知25℃时碳酸的电离常数为 、
、 ,当溶液
,当溶液 时,
时, 1:
1: 、
、 表示)。
表示)。(5)工业上可采用如图所示装置电解
 溶液制备
溶液制备

①该装置中的离子交换膜是
②电解时阳极的电极反应式是

回答下列问题:
(1)写出赤泥经盐酸处理后所得“浸渣”与强碱溶液反应的离子方程式
(2)赤泥“酸浸”时温度过高,酸浸速率反而下降,其原因是
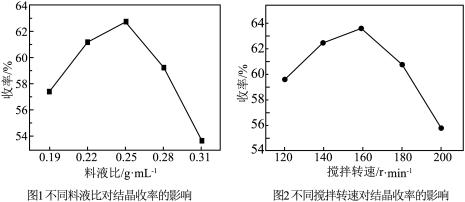
(3)P2O4萃取浸出液,其浓度、料液温度对萃取率的影响如表所示,萃取时P2O4最佳浓度及料液温度分别为
| 试验编号 | P2O4浓度/% | 分相情况 | 钪萃取率/% | 铁萃取率/% |
| 1-1 | 1 | 分相快 | 90.76 | 15.82 |
| 1-2 | 2 | 分相容易 | 91.53 | 19.23 |
| 1-3 | 3 | 分相容易 | 92.98 | 13.56 |
| 1-4 | 4 | 有第三相 | 90.69 | 30.12 |
| 1-5 | 5 | 轻微乳化 | 91.74 | 39.79 |
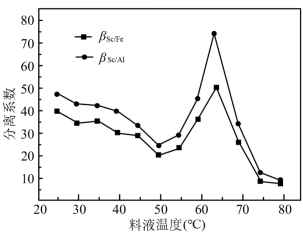
(4)反萃取时,Sc3+完全沉淀(浓度为1.0×10-6mol·L-1)时,反萃液的pH为
(5)为探究所得草酸钪晶体Sc2(C2O4)3·xH2O中结晶水的含量,取2.96g样品(纯度为75%),灼烧得到0.69gSc2O3固体,则x=
(6)草酸钪晶体灼烧分解反应方程式为
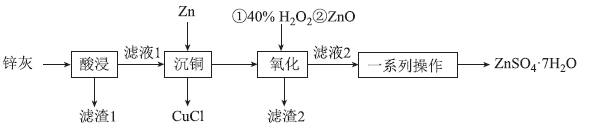
已知:①锌灰的主要成分为ZnO、ZnCl2,还含有SiO2、CuO、PbO和FeO;
②酸浸所使用的酸为稀硫酸;
③CuCl为不溶于水的白色固体。
请回答下列问题:
(1)写出增大锌灰酸浸速率的一种措施
(2)“滤渣1”的主要成分是
(3)写出沉铜过程中的离子反应方程式
(4)从平衡角度解释加入ZnO得到滤渣2的原理
(5)检验滤液2中是否含有滤渣2中阳离子的方法是
(6)由滤液2得到ZnSO4•7H2O晶体的一系列操作为
(7)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S
 ZnS(s)+2H+。处理后的废水中部分微粒浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒浓度为:| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度/mol•L-1 | 0.20 | 0.10 | 0.20 |
则处理后的废水中c(Zn2+)=

已知:有机萃取剂HR可以萃取Cu2+,其萃取原理(org为有机相)Cu2+(aq)+2HR(org)
 CuR2(org)+2H+(aq)。
CuR2(org)+2H+(aq)。回答下列问题:
(1)焙烧前粉碎的目的是
(2)“调节pH时,生成氢氧化铁沉淀的离子方程式为
a.HCl b.NaOH c.H2SO4 d.NH3•H2O
(3)25℃时,“调节pH”后,测得滤液中各离子浓度及相关数据如表所示。(lg2=0.3)
| 离子 | Fe3+ | Cu2+ | Ni2+ | Fe2+ |
| 浓度/(mol·L-1) | 1.0×10-6 | 5.0 | 1.2 | 0 |
| 对应氢氧化物的Ksp | 6.4×10-38 | 2.2×10-20 | 2.0×10-15 | 8.0×10-16 |
(4)向“萃取”后的水相中加入一定量的NaClO和NaOH,能制得黑色不溶物NiOOH,该反应的化学方程式为
(5)“操作Ⅱ”包括洗涤,洗涤该沉淀的操作为
(6)将得到的胆矾产品做热重分析,测得的数据如图所示。
已知:杂质不分解,250℃时,胆矾失去所有结晶水。则A点胆矾分解得到的物质为

I.研究氮氧化物的反应机理,对消除环境污染有重要意义。在空气中NO与O2反应转化成NO2更易引发光化学烟雾,已知反应2NO(g)+O2(g)
 2NO2(g)反应的历程为:第一步:2NO(g)
2NO2(g)反应的历程为:第一步:2NO(g) N2O2(g)快,第二步:N2O2(g)+O2(g)
N2O2(g)快,第二步:N2O2(g)+O2(g) 2NO2(g)慢,下列有关说法不正确的是
2NO2(g)慢,下列有关说法不正确的是A. 2NO(g)+O2(g)
 2NO2(g)的K=K1(第一步反应的平衡常数)×K2(第二步反应的平衡常数)
2NO2(g)的K=K1(第一步反应的平衡常数)×K2(第二步反应的平衡常数)B.第一步反应的活化能E1大于第二步反应的活化能E2
C.第二步中的N2O2和O2的碰撞只部分有效
D. 2NO(g)+O2(g)
 2NO2(g)的△S<0,该反应能自发进行,说明一定是放热反应
2NO2(g)的△S<0,该反应能自发进行,说明一定是放热反应II.目前汽车尾气中的NO处理有以下几种方法:
(1)①已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ/mol,C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol,2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2NO(g)+2CO(g)
 N2(g)+2CO2(g)的△H=
N2(g)+2CO2(g)的△H=②某兴趣小组对某汽车冷启动时的尾气催化处理过程中CO、NO百分含量随时间变化加以分析,结果如图1所示,前0-10s阶段CO、NO百分含量没明显变化的原因是
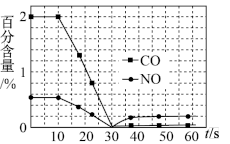
③某温度℃下,向2L密闭容器中充入一定量NO和CO,在

 时刻达到平衡状态,此时n(CO)=1mol,n(NO)=2mol,n(N2)=2mol,在该温度下平衡常数K=
时刻达到平衡状态,此时n(CO)=1mol,n(NO)=2mol,n(N2)=2mol,在该温度下平衡常数K= 时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下,
时刻,将容器迅速压缩到原容积的一半,在其它条件不变的情况下, 时刻达到新的平衡状态,则请在下图中补充画出
时刻达到新的平衡状态,则请在下图中补充画出 时段N2物质的量浓度的变化趋势曲线。
时段N2物质的量浓度的变化趋势曲线。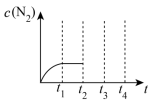
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度十倍),装置如右图所示,固体电解质可传导O2-。
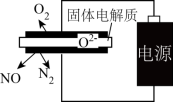
①阴极的电极反应式为
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)
 以及燃煤废气中的
以及燃煤废气中的 都是大气污染物,对它们的治理具有重要意义。
都是大气污染物,对它们的治理具有重要意义。 氧化还原法消除NOx的转化如下:
氧化还原法消除NOx的转化如下:
 反应I为
反应I为 ,生成标准状况下
,生成标准状况下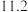 L
L  时,转移电子的物质的量是
时,转移电子的物质的量是 反应Ⅱ中,当
反应Ⅱ中,当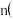
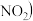 :
: :2时,氧化产物与还原产物的质量比为
:2时,氧化产物与还原产物的质量比为 吸收
吸收 和NO,获得
和NO,获得 和
和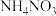 产品的流程图如下
产品的流程图如下 为铈元素
为铈元素 。装置Ⅰ中发生反应的离子方程式为
。装置Ⅰ中发生反应的离子方程式为
 装置Ⅱ中,酸性条件下NO被
装置Ⅱ中,酸性条件下NO被 氧化的产物主要是
氧化的产物主要是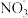 、
、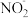 ,请写出生成等物质的量的
,请写出生成等物质的量的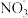 和
和 时的离子方程式
时的离子方程式 装置Ⅲ的作用之一是用质子交换膜电解槽电解使得
装置Ⅲ的作用之一是用质子交换膜电解槽电解使得 再生,再生时生成的
再生,再生时生成的 在电解槽的
在电解槽的 填“阳极”或“阴极”
填“阳极”或“阴极” ,同时在另一极生成
,同时在另一极生成 的电极反应式为
的电极反应式为 取少量装置Ⅳ所得的产品溶于水,溶液中离子浓度由大到小的顺序为
取少量装置Ⅳ所得的产品溶于水,溶液中离子浓度由大到小的顺序为(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是
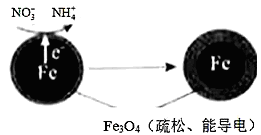
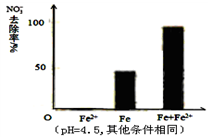
(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
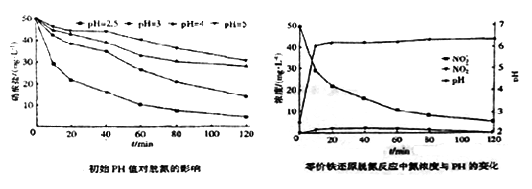
针对假设I:做对比实验,结果如图所示,可得到的结论是
②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为