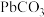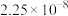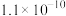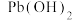利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO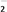 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO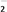 的离子方程式为
的离子方程式为____________________ 。
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)酸浸时,为了提高浸取率可采取的措施是________ (至少写一条)。
(2)H2O2的作用是______________ 。
(3)调pH=8是为了除去__________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________ (填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+ H2O===
H2O=== Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________ 。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________ ;
②________________________________________________________________________ ;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
(一)染料工业排放的废水中含有大量有毒的NO
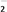 ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO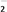 的离子方程式为
的离子方程式为(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(2)H2O2的作用是
(3)调pH=8是为了除去
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是
(5)试配平氧化还原反应方程式:
 Na2Cr2O7+
Na2Cr2O7+ SO2+
SO2+ H2O===
H2O=== Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+ Na2SO4;
Na2SO4;每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①
②
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
更新时间:2017-09-15 18:55:29
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌,以某硫化锌精矿(主要成分是ZnS,还含有少量FeS等其他成分)为原料冶炼锌的工艺流程如图所示:
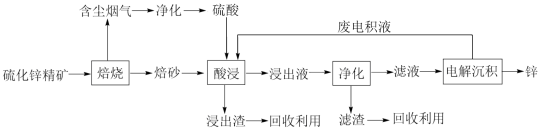
回答下列问题:
(1)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:_______ ;“含尘烟气”中的SO2可用氨水吸收,经循环利用后制取硫酸,用氨水吸收SO2至溶液的pH=5时,所得溶液中的 =
=_______ 。[已知:Ka1(H2SO3)=l。4×10-2;Ka2(H2SO3)=6.0×10-8]
(2)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为_______ (填化学式),分离“滤液”'“滤渣”的操作名称为_______ 。
(3)在该流程中可循环使用的物质是Zn和_______ (填化学式)。
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是_______ (填标号)。
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq) CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=_______ 。[已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36]
(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2+ Zn+(1+
Zn+(1+ )H2O+
)H2O+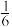 ZnSO4
ZnSO4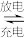 MnOOH+
MnOOH+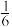 [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
[ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为_______ 。

回答下列问题:
(1)“焙烧”过程在氧气气氛的沸腾炉中进行,“焙砂”中铁元素主要以Fe3O4形式存在,写出“焙烧”过程中FeS主要发生反应的化学方程式:
 =
=(2)浸出液“净化”过程中加入的主要物质为锌粉,所得“滤渣”的成分为
(3)在该流程中可循环使用的物质是Zn和
(4)改进的锌冶炼工艺,采用了“氧压酸(稀硫酸)浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。
①下列设想的加快浸取反应速率的措施中不合理的是
A.将稀硫酸更换为98%的浓硫酸
B.将硫化锌精矿粉碎
C.适当升高温度
②硫化锌精矿的主要成分ZnS遇到硫酸铜溶液可慢慢地转化为铜蓝(CuS):ZnS(s)+Cu2+(aq)
 CuS(s)+Zn2+(aq),该反应的平衡常数K=
CuS(s)+Zn2+(aq),该反应的平衡常数K=(5)金属锌化学性质活泼,可用于多种化学电源的电极材料。一种3D打印机的柔性电池以碳纳米管作电极材料,以吸收了ZnSO4溶液的有机高聚物为固态电解质,电池总反应为MnO2+
 Zn+(1+
Zn+(1+ )H2O+
)H2O+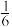 ZnSO4
ZnSO4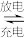 MnOOH+
MnOOH+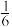 [ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
[ZnSO4·3Zn(OH)2·xH2O]。放电时正极的电极反应式为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】从一种含银矿(含Ag、Zn、Cu、Pb及少量SiO2)中提取Ag、Cu及Pb的工艺流程如下:

(1)步骤①提高矿物中金属离子浸取率,除可改变盐酸的浓度和氯酸钾的量外,还可采取的措施是__________ (写出两种即可)
(2)步骤②中试剂X为______ (填化学式,下同);步骤④滤渣的成分为_______ 。
(3)步骤③发生反应的化学方程式为____________________ 。
(4)步骤⑤发生反应的离子方程式为____________________ ;其中N2H4(肼) 的电子式为____ 。
(5)“还原”后的“滤液”经氧化后,其中的溶质主要为_______ 。
(6)已知常温下,Ksp(AgCl)=1.8×10−10,Ksp(AgI)=1.0×10−16。若在AgC1的悬浊液中加入NaCl 固体,AgCl 沉淀的溶解度_____ (填“升高”、“不变”或“降低”),往AgCl 的悬浊液中滴加NaI溶液,当AgCl 开始转化为AgI时,I-的浓度必须不低于_____ mol∙L−1 (不用化简)。

(1)步骤①提高矿物中金属离子浸取率,除可改变盐酸的浓度和氯酸钾的量外,还可采取的措施是
(2)步骤②中试剂X为
(3)步骤③发生反应的化学方程式为
(4)步骤⑤发生反应的离子方程式为
(5)“还原”后的“滤液”经氧化后,其中的溶质主要为
(6)已知常温下,Ksp(AgCl)=1.8×10−10,Ksp(AgI)=1.0×10−16。若在AgC1的悬浊液中加入NaCl 固体,AgCl 沉淀的溶解度
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】铜的硫化物可用于冶炼金属铜。为测定某试样中Cu2S、CuS的质量分数,进行如下实验:
步骤1:在0.7500g试样中加入100.00mL0.1200mol/L KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用0.1000mol/L FeSO4溶液滴定至终点,消耗16.00mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1gKI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-=2CuI↓+I2。用0.05000
mol/L Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2 2I-+S4O62-),消耗14.00mL。
2I-+S4O62-),消耗14.00mL。
(1)写出Cu2S与KMnO4酸性溶液反应的化学方程式________________
(2)步骤3中加入氨水的目的为__________________ ;如果未加入氨水,则测得的Cu2+的物质的量将__________ (填“偏高”“偏低”或“不变”),混合固体中CuS的质量分数将__________ (填“偏高”“偏低”或“不变”)
(3)当加入氨水使得溶液pH=2.0时,则溶液中c(Fe3+)=____________ ,
(4)根据题中数据,计算混合固体中Cu2S的质量分数w(Cu2S)=______ ,CuS的质量分数w(CuS)=_______ 。
步骤1:在0.7500g试样中加入100.00mL0.1200mol/L KMnO4的酸性溶液,加热,硫元素全部转化为SO42-,铜元素全部转化为Cu2+,滤去不溶性杂质。
步骤2:收集步骤1所得滤液至250mL容量瓶中,定容。取25.00mL溶液,用0.1000mol/L FeSO4溶液滴定至终点,消耗16.00mL。
步骤3:在步骤2滴定所得溶液中滴加氨水至出现沉淀,然后加入适量NH4HF2溶液(使Fe、Mn元素不参与后续反应),加入约1gKI固体(过量),轻摇使之溶解并发生反应:2Cu2++4I-=2CuI↓+I2。用0.05000
mol/L Na2S2O3溶液滴定至终点(离子方程式为2S2O32-+I2
 2I-+S4O62-),消耗14.00mL。
2I-+S4O62-),消耗14.00mL。(1)写出Cu2S与KMnO4酸性溶液反应的化学方程式
(2)步骤3中加入氨水的目的为
(3)当加入氨水使得溶液pH=2.0时,则溶液中c(Fe3+)=
(4)根据题中数据,计算混合固体中Cu2S的质量分数w(Cu2S)=
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如图所示。
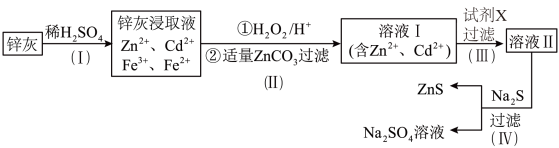
请回答下列问题:
(1)为提高锌灰的浸取率,除了适当升温外,还可采用的方法有______________________ (请写出两种方法)。
(2)步骤II先加入H2O2的目的是________________________________ (用离子方程式表示),再加入适量ZnCO3,过滤,所得滤渣为红褐色的不溶物,写出该反应的化学方程式________________________________________ 。
(3)步骤III中可得Cd单质,为避免引入新的杂质,试剂X应为____________ 。
(4)步骤IV过滤后需对所得ZnS固体进行洗涤、干燥,在实验室中进行过滤操作时,用到的主要玻璃仪器有_____________________________________ 。
(5)若步骤II中加入的ZnCO3为bmol,步骤III所得Cd单质为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液,则理论上所用锌灰中锌元素的质量为_____________ 。

请回答下列问题:
(1)为提高锌灰的浸取率,除了适当升温外,还可采用的方法有
(2)步骤II先加入H2O2的目的是
(3)步骤III中可得Cd单质,为避免引入新的杂质,试剂X应为
(4)步骤IV过滤后需对所得ZnS固体进行洗涤、干燥,在实验室中进行过滤操作时,用到的主要玻璃仪器有
(5)若步骤II中加入的ZnCO3为bmol,步骤III所得Cd单质为dmol,最后得到VL、物质的量浓度为cmol/L的Na2SO4溶液,则理论上所用锌灰中锌元素的质量为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________ 。
(2)“合成”的化学方程式为___________________ 。 “合成”温度控制在70℃以下,其原因是__________ 。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________ 。
(3)“滤渣”的主要成分为_________________ (填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________ 。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
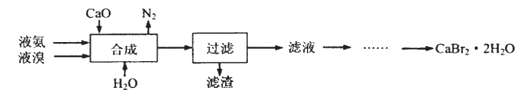
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,
(2)“合成”的化学方程式为
(3)“滤渣”的主要成分为
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,
您最近半年使用:0次
【推荐3】铅酸蓄电池(如图)的电压稳定、使用方便、安全可靠、价格低廉而使用广泛。
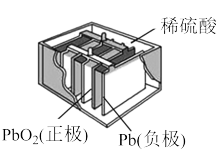
I.
(1)写出电池使用过程中的两个电极反应方程式:
负极______ ; 正极______ 。
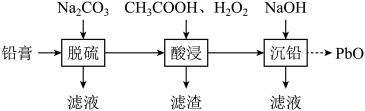
II.使用后的废旧铅酸蓄电池需要回收,废旧电池的铅膏中主要含有、 、PbO和Pb,还有少量
、PbO和Pb,还有少量 、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。
、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。
一些难溶电解质的溶度积常数如下表:
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:
(2)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为______ ; 饱和溶液中
饱和溶液中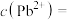
______ 。
(3)在“脱硫”中,加入 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是______ 。
(4)在“酸浸”中,除加入醋酸( ),还要加入
),还要加入 。
。
①能被 氧化的离子是
氧化的离子是______ ;
② 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为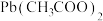 ,其化学方程式为
,其化学方程式为______ 。
③ 也能使
也能使 转化为
转化为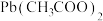 ,
, 的作用是
的作用是______ 。
(5)“酸浸”后溶液的pH应控制在______ (填范围),滤渣的主要成分是______ (填化学式)。

I.
(1)写出电池使用过程中的两个电极反应方程式:
负极
II.使用后的废旧铅酸蓄电池需要回收,废旧电池的铅膏中主要含有、
 、PbO和Pb,还有少量
、PbO和Pb,还有少量 、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。
、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。
一些难溶电解质的溶度积常数如下表:
难溶电解质 |
|
|
|
|
|
|
|
|
|
金属氢氧化物 |
|
|
|
|
开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(2)在“脱硫”中
 转化反应的离子方程式为
转化反应的离子方程式为 饱和溶液中
饱和溶液中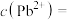
(3)在“脱硫”中,加入
 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是(4)在“酸浸”中,除加入醋酸(
 ),还要加入
),还要加入 。
。①能被
 氧化的离子是
氧化的离子是②
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为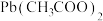 ,其化学方程式为
,其化学方程式为③
 也能使
也能使 转化为
转化为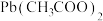 ,
, 的作用是
的作用是(5)“酸浸”后溶液的pH应控制在
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
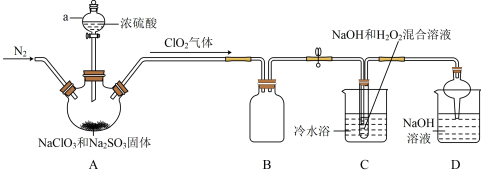
【推荐1】新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
(1)实验加药品前应进行的实验操作是____ 。
(2)盛放NaClO3和Na2SO3固体的仪器名称是____ 。
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为____ 。
(4)B装置的作用是____ 。
(5)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃蒸发结晶; ②____ ;
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(6)装置D是处理尾气,反应的化学方程式____ 。
(7)实验结束后,继续通入一段时间N2的目的是____ 。
Ⅲ.测量与计算:
(8)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
①滴定终点的现象是____ 。
②下列滴定操作会导致测量结果偏低的是____ (填字母)。
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为____ %(用含c、v的代数式表示)。

I.查阅资料:
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
Ⅱ.制备与分离:
(1)实验加药品前应进行的实验操作是
(2)盛放NaClO3和Na2SO3固体的仪器名称是
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为
(4)B装置的作用是
(5)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃蒸发结晶; ②
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(6)装置D是处理尾气,反应的化学方程式
(7)实验结束后,继续通入一段时间N2的目的是
Ⅲ.测量与计算:
(8)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品1.4450g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。①滴定终点的现象是
②下列滴定操作会导致测量结果偏低的是
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
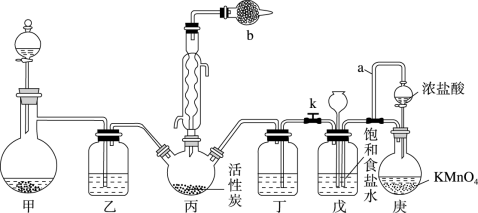
【推荐2】磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2在活性炭作用下反应制取少量的SO2Cl2,装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1°C,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。
(1)甲装置可以用于实验室制SO2,则下列试剂组合中合适的是_____ 。
A.18.4mol∙L-1的硫酸和Cu
B.10mol∙L-1的硝酸和Na2SO3固体
C.70%的硫酸和Na2SO3固体
(2)导管a的作用是①__________ 。仪器b盛放的试剂为②______ 。装置乙和丁中可以使用同一种试剂,该试剂为③__________ 。
(3)控制反应过程中装置丙中进气速率的方法是①____________ ,实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是②____________ 。
(4)氯磺酸(ClSO3H)加热分解,也能制得磺酰氯与另外一种物质,该反应的化学方程式为①______ 。分离产物的方法是②______ (填字母)。
A. 蒸发 B. 过滤 C. 蒸馏 D. 洗气

回答下列问题。
(1)甲装置可以用于实验室制SO2,则下列试剂组合中合适的是
A.18.4mol∙L-1的硫酸和Cu
B.10mol∙L-1的硝酸和Na2SO3固体
C.70%的硫酸和Na2SO3固体
(2)导管a的作用是①
(3)控制反应过程中装置丙中进气速率的方法是①
(4)氯磺酸(ClSO3H)加热分解,也能制得磺酰氯与另外一种物质,该反应的化学方程式为①
A. 蒸发 B. 过滤 C. 蒸馏 D. 洗气
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】叠氮化钠( )是一种白色剧毒晶体,是汽车安全气囊的主要成分;易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(
)是一种白色剧毒晶体,是汽车安全气囊的主要成分;易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(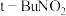 ,以t-Bu表示叔丁基)与
,以t-Bu表示叔丁基)与 、氢氧化钠溶液混合反应制备
、氢氧化钠溶液混合反应制备 。
。 溶液呈弱碱性的原因:
溶液呈弱碱性的原因:___________ (用离子方程式表示)。
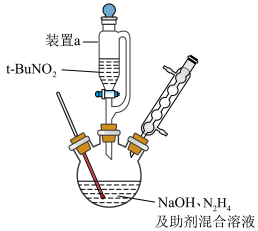
(2)制备
按图示组装仪器(加热装置略)进行反应,反应的化学方程式为: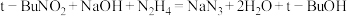 。
。
①装置a的名称是___________ 滴液漏斗;
②反应后溶液在0℃下冷却至有大量晶体析出后过滤。所得晶体使用乙醇洗涤的原因________ 。
(3)产率计算
①称取 试样,配成100mL溶液,并量取20.00mL溶液于锥形瓶中。
试样,配成100mL溶液,并量取20.00mL溶液于锥形瓶中。
②用滴定管加入 。溶液40.00mL(假设杂质均不参与反应)。
。溶液40.00mL(假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用 标准液,滴定过量的
标准液,滴定过量的 ,终点时消耗标准溶液20.00mL(滴定原理:
,终点时消耗标准溶液20.00mL(滴定原理: )。
)。
i.写出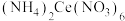 与叠氮化钠反应生成
与叠氮化钠反应生成 、
、 、
、 和
和 化学方程式:
化学方程式:________ 。
ii. 的质量分数为
的质量分数为________ (保留2位有效数字)。
iii.下列操作会导致所测定样品中 质量分数偏大的是
质量分数偏大的是________ 。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加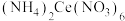 溶液时,滴加前仰视读数,滴加后俯视读数
溶液时,滴加前仰视读数,滴加后俯视读数
C.滴定过程中,将挂在锥形瓶壁上的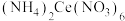 标准液滴用蒸馏水冲进瓶内
标准液滴用蒸馏水冲进瓶内
(4)不直接用酸性高锰酸钾滴定 可能的原因是
可能的原因是___________ 。
(5) 有毒,可以使用NaClO溶液对含有
有毒,可以使用NaClO溶液对含有 的溶液进行销毁,反应产生无色无味的无毒气体,试解释原因
的溶液进行销毁,反应产生无色无味的无毒气体,试解释原因___________ (用离子方程式表示),每生成3mol气体转移的电子数为___________ mol。
 )是一种白色剧毒晶体,是汽车安全气囊的主要成分;易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(
)是一种白色剧毒晶体,是汽车安全气囊的主要成分;易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(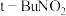 ,以t-Bu表示叔丁基)与
,以t-Bu表示叔丁基)与 、氢氧化钠溶液混合反应制备
、氢氧化钠溶液混合反应制备 。
。
 溶液呈弱碱性的原因:
溶液呈弱碱性的原因:(2)制备

按图示组装仪器(加热装置略)进行反应,反应的化学方程式为:
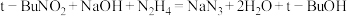 。
。①装置a的名称是
②反应后溶液在0℃下冷却至有大量晶体析出后过滤。所得晶体使用乙醇洗涤的原因
(3)产率计算
①称取
 试样,配成100mL溶液,并量取20.00mL溶液于锥形瓶中。
试样,配成100mL溶液,并量取20.00mL溶液于锥形瓶中。②用滴定管加入
 。溶液40.00mL(假设杂质均不参与反应)。
。溶液40.00mL(假设杂质均不参与反应)。③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用
 标准液,滴定过量的
标准液,滴定过量的 ,终点时消耗标准溶液20.00mL(滴定原理:
,终点时消耗标准溶液20.00mL(滴定原理: )。
)。i.写出
 与叠氮化钠反应生成
与叠氮化钠反应生成 、
、 、
、 和
和 化学方程式:
化学方程式:ii.
 的质量分数为
的质量分数为iii.下列操作会导致所测定样品中
 质量分数偏大的是
质量分数偏大的是A.锥形瓶使用叠氮化钠溶液润洗
B.滴加
 溶液时,滴加前仰视读数,滴加后俯视读数
溶液时,滴加前仰视读数,滴加后俯视读数C.滴定过程中,将挂在锥形瓶壁上的
 标准液滴用蒸馏水冲进瓶内
标准液滴用蒸馏水冲进瓶内(4)不直接用酸性高锰酸钾滴定
 可能的原因是
可能的原因是(5)
 有毒,可以使用NaClO溶液对含有
有毒,可以使用NaClO溶液对含有 的溶液进行销毁,反应产生无色无味的无毒气体,试解释原因
的溶液进行销毁,反应产生无色无味的无毒气体,试解释原因
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】环己烯是重要的化工原料。其实验室制备流程如图:
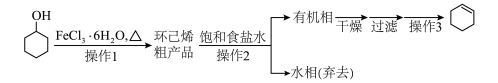
已知:环己醇和环己烯常温下都为液体,环己烯密度0.83 g·mL-1,沸点:82.98℃,能与水形成共沸物。
回答下列问题:
I.环己烯的制备与提纯
(1)操作1进行的可逆反应化学方程式为___________ ,浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为___________ (填标号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
(2)操作2用到的玻璃仪器有___________ ,饱和食盐水的作用是___________ 。有机相从该步使用仪器的___________ (填“上口”或“下口”)倒出。
(3)分离出有机相后,需加入无水氯化钙干燥,在操作3(蒸馏)之前需要将其过滤掉,原因是___________ 。
(4)将操作3(蒸馏)的步骤补齐:安装好蒸馏装置,检查装置气密性后加入待蒸馏的物质和沸石,重新安装好蒸馏装置,___________ ,弃去前馏分,收集83℃的馏分。
II.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①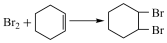
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(5)滴定所用指示剂为___________ 。样品中环己烯的质量分数为___________ (用字母表示)。

已知:环己醇和环己烯常温下都为液体,环己烯密度0.83 g·mL-1,沸点:82.98℃,能与水形成共沸物。
回答下列问题:
I.环己烯的制备与提纯
(1)操作1进行的可逆反应化学方程式为
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
(2)操作2用到的玻璃仪器有
(3)分离出有机相后,需加入无水氯化钙干燥,在操作3(蒸馏)之前需要将其过滤掉,原因是
(4)将操作3(蒸馏)的步骤补齐:安装好蒸馏装置,检查装置气密性后加入待蒸馏的物质和沸石,重新安装好蒸馏装置,
II.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。测定过程中,发生的反应如下:
①

②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(5)滴定所用指示剂为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:

(1)测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为____________ ,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________ 。
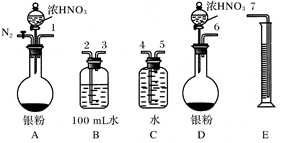
(2)测定NO的体积
①从上图所示的装置中,你认为应选用________ 装置进行Ag与浓硝酸反应实验,选用的理由是______________________________ 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________________________ (填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置______ (选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________ (填“有”或“没有”)NO产生,作此判断的依据是_________________ 。

(1)测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为

(2)测定NO的体积
①从上图所示的装置中,你认为应选用
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某化学学习小组在实验室模拟工业法制取Br2,装置如图所示。
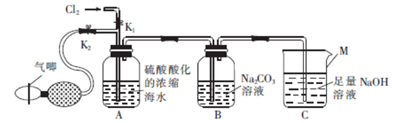
(1)仪器M的名称是____________ 。
(2)实验室制取的Cl2在通入装置A之前______ (填“需要”或“不需要”)除杂。
(3)实验前检查装置气密性的方法是__________ 。
(4)反应过程中,Br2在装置B中与Na2CO3反应生成NaBrO3______ 。为使装置A中产生的Br尽可能被吸收,可采取的合理措施是
(5)反应结束后,取下装置B,向装置B中加入稀H2SO4会生成Br2,该反应的离子方程式为_________ 。

(1)仪器M的名称是
(2)实验室制取的Cl2在通入装置A之前
(3)实验前检查装置气密性的方法是
(4)反应过程中,Br2在装置B中与Na2CO3反应生成NaBrO3
(5)反应结束后,取下装置B,向装置B中加入稀H2SO4会生成Br2,该反应的离子方程式为
您最近半年使用:0次