硫酸的消费量是衡量一个国家化工生产水平的重要标志。在硫酸的生产中,最关键的一步反应为2SO2(g)+O2(g)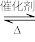 2SO3(g)
2SO3(g)
(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3的物质的量浓度分别为1 mol/L和3 mol/L,则SO2起始物质的量浓度为____________________ ;10 min内生成SO3的平均反应速率v(SO3)为____ 。
(2)下列关于该反应的说法正确的是_________ (填选项字母)。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是___________ (填选项字母)。
A.O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO3为0.4 mol/L D.SO2、SO3均为0.15 mol/L
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g)⇌2SO3(g) △H1=-197 kJ•mol-1;
H2O(g)=H2O(l) △H2=-44 kJ•mol-1;
2SO2+O2(g)+2H2O(l)═2H2SO4(l) △H3=-545 kJ•mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是____________________ 。
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为__________ 。
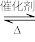 2SO3(g)
2SO3(g)(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3的物质的量浓度分别为1 mol/L和3 mol/L,则SO2起始物质的量浓度为
(2)下列关于该反应的说法正确的是
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是
A.O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO3为0.4 mol/L D.SO2、SO3均为0.15 mol/L
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g)⇌2SO3(g) △H1=-197 kJ•mol-1;
H2O(g)=H2O(l) △H2=-44 kJ•mol-1;
2SO2+O2(g)+2H2O(l)═2H2SO4(l) △H3=-545 kJ•mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为
更新时间:2017-05-05 18:40:00
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】化学反应伴随有能量的变化,获取反应能量变化有多条途径。
Ⅰ.用如图所示的装置测定中和反应反应热,实验药品: 盐酸、
盐酸、 溶液、
溶液、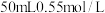 氨水。已知弱碱电离时吸热。回答下列问题。
氨水。已知弱碱电离时吸热。回答下列问题。__________ 。
(2)将浓度为 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容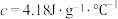 ,测得温度如下:
,测得温度如下:
①甲组实验放出的热量__________ 乙组实验放出的热量(填“>”、“<”或“=”)。
②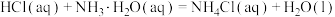 的
的
__________  (保留一位小数)。
(保留一位小数)。
Ⅱ.通过化学键的键能计算。
(3)汽车发动机工作时会引发 和
和 反应,其能量变化示意图如下:
反应,其能量变化示意图如下:__________ 。
Ⅲ.通过盖斯定律计算。
(4)氧化亚铜常用于制船底防污漆,已知反应:
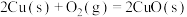

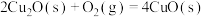

则 的
的
__________ 。
(5)利用丁烯和乙烯的催化歧化反应制丙烯:
 。相关物质的燃烧热数据如下表所示:
。相关物质的燃烧热数据如下表所示:
该催化歧化反应的
__________  。
。
Ⅰ.用如图所示的装置测定中和反应反应热,实验药品:
 盐酸、
盐酸、 溶液、
溶液、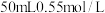 氨水。已知弱碱电离时吸热。回答下列问题。
氨水。已知弱碱电离时吸热。回答下列问题。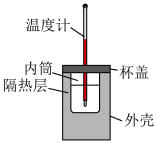
(2)将浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合(溶液密度均为
的碱溶液各50mL混合(溶液密度均为 ),生成的溶液的比热容
),生成的溶液的比热容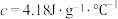 ,测得温度如下:
,测得温度如下:反应物 | 起始温度 | 最高温度 |
甲组 | 15.0 | t |
乙组 | 15.0 | 18.1 |
②
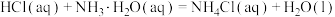 的
的
 (保留一位小数)。
(保留一位小数)。Ⅱ.通过化学键的键能计算。
(3)汽车发动机工作时会引发
 和
和 反应,其能量变化示意图如下:
反应,其能量变化示意图如下: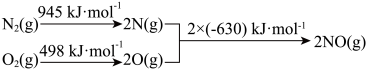
Ⅲ.通过盖斯定律计算。
(4)氧化亚铜常用于制船底防污漆,已知反应:
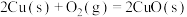

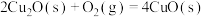

则
 的
的
(5)利用丁烯和乙烯的催化歧化反应制丙烯:

 。相关物质的燃烧热数据如下表所示:
。相关物质的燃烧热数据如下表所示:物质 |
|
|
|
燃烧热 |
|
|
|

 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量:________________ 。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量:______________ 。
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:__________________ 。
⑷已知下列反应的反应热为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) 1=-870.3kJ/mol
1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) 2=-393.5kJ/mol
2=-393.5kJ/mol
③H2(g)+1/2O2(g)=H2O(l) 3=-285.8kJ/mol
3=-285.8kJ/mol
试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) =
=_______________
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量:
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量:
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量:
⑷已知下列反应的反应热为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)
 1=-870.3kJ/mol
1=-870.3kJ/mol②C(s)+O2(g)=CO2(g)
 2=-393.5kJ/mol
2=-393.5kJ/mol③H2(g)+1/2O2(g)=H2O(l)
 3=-285.8kJ/mol
3=-285.8kJ/mol试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l)
 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】将气体A、B置于2L的刚性密闭绝热容器中,发生如下反应: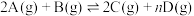 ,反应进行到20s末,测得A的物质的量为
,反应进行到20s末,测得A的物质的量为 ,C的物质的量为
,C的物质的量为 ,20s内D的反应速率为
,20s内D的反应速率为 ,则:
,则:
(1)用C表示20s内反应的平均反应速率为______  。
。
(2)生成物D的化学计量数n为______ 。
(3)20s末反应物A的转化率为______ 。
(4)反应进程中,正反应速率随时间的变化曲线如图所示:
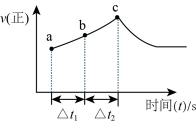
①该反应为______ 反应(填“吸热”或“放热”),理由是______ 。
②反应在c点处
______  (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。
③若 ,反应物B的转化率:ab段
,反应物B的转化率:ab段______ bc段(填“>”或“=”或“<”)。
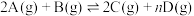 ,反应进行到20s末,测得A的物质的量为
,反应进行到20s末,测得A的物质的量为 ,C的物质的量为
,C的物质的量为 ,20s内D的反应速率为
,20s内D的反应速率为 ,则:
,则:(1)用C表示20s内反应的平均反应速率为
 。
。(2)生成物D的化学计量数n为
(3)20s末反应物A的转化率为
(4)反应进程中,正反应速率随时间的变化曲线如图所示:
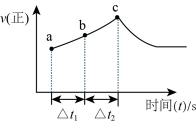
①该反应为
②反应在c点处

 (填“>”或“=”或“<”)。
(填“>”或“=”或“<”)。③若
 ,反应物B的转化率:ab段
,反应物B的转化率:ab段
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
【推荐2】在溶液中,反映 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为 、
、 及
及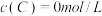 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_____________ ;
③______________ ;
(2)实验②平衡时B的转化率为_________ ;实验③平衡时C的浓度为__________ ;
(3)该反应的 >0,判断其理由是
>0,判断其理由是________________ ;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: =
=___________ ;
实验③: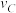 =
=_______________ 。
 分别在三种不同实验条件下进行,它们的起始浓度均为
分别在三种不同实验条件下进行,它们的起始浓度均为 、
、 及
及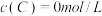 。反映物A的浓度随时间的变化如下图所示。
。反映物A的浓度随时间的变化如下图所示。
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②
③
(2)实验②平衡时B的转化率为
(3)该反应的
 >0,判断其理由是
>0,判断其理由是(4)该反应进行到4.0min时的平均反应速度率:
实验②:
 =
=实验③:
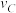 =
=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】汽车尾气中的CO、NO2在一定条件下可以发生反应:4CO(g)+2NO2(g)4CO2(g)+N2(g) ΔH=−1 200 kJ·mol-1。在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示:

(1)0~10 min内该反应的平均速率v(CO)=________ ,从11 min起其他条件不变,压缩容器的容积变为1 L,则n(NO2)的变化曲线可能为图中的______ (填字母)。
(2)恒温恒容条件下,不能说明该反应已达到平衡状态的是________ (填字母)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变

(1)0~10 min内该反应的平均速率v(CO)=
(2)恒温恒容条件下,不能说明该反应已达到平衡状态的是
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)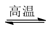 Si(s)+4HCl(g)-236kJ,完成下列填空:
Si(s)+4HCl(g)-236kJ,完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为 2L,经 3min 后达到平衡,获得固体的质量 8.4 g,则用 H2表示的平均反应速率为_________ 。
(2)该反应的平衡常数表达式 K=_________ ,若欲使 K 增大,可采取的措施是_________ 。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是_________ 。
a.2v 逆(SiCl4)=v 正(H2) b.断开 4mol Si-Cl 键的同时,生成 4mol H-Cl 键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
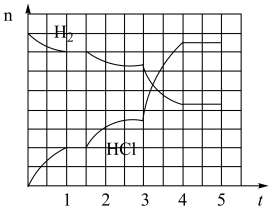
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第 1.5 分钟v(正)____ v(逆)(填><或=),第 3 分钟改变的条件是_______ ,各平衡态中氢气转化率最小的时间段是_______ 。
 Si(s)+4HCl(g)-236kJ,完成下列填空:
Si(s)+4HCl(g)-236kJ,完成下列填空:(1)在一定温度下进行上述反应,若反应容器的容积为 2L,经 3min 后达到平衡,获得固体的质量 8.4 g,则用 H2表示的平均反应速率为
(2)该反应的平衡常数表达式 K=
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是
a.2v 逆(SiCl4)=v 正(H2) b.断开 4mol Si-Cl 键的同时,生成 4mol H-Cl 键
c.混合气体密度保持不变 d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第 1.5 分钟v(正)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向。回答下列问题:
(1)与CO2相似,羰基硫(COS)中所有原子最外层也都满足8电子结构,COS电子式可表示为___________ 。
(2)有人提出,可以设计反应CO2 C+O2(ΔH>0,ΔS<0)来消除CO2对环境的影响。请你判断是否可行,并说明理由
C+O2(ΔH>0,ΔS<0)来消除CO2对环境的影响。请你判断是否可行,并说明理由___________ 。
(3)CO2和H2在一定条件下可制取甲醇,反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49kJ/mol。
①在体积为1L的密闭容器中,充入1molCO2和3molH2,发生上述反应。若10分钟后,容器内压强为原来的0.625倍,则0到10分钟,氢气的平均反应速率为___________ 。
②该反应的平衡常数K的表达式为___________ 。已知某温度下,K=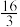 。该温度下,测得容器中c(CO2)=0.30mol•L-1、c(H2)=c(CH3OH)=c(H2O)=0.75mol•L-1,此时,该反应化学反应速率v正
。该温度下,测得容器中c(CO2)=0.30mol•L-1、c(H2)=c(CH3OH)=c(H2O)=0.75mol•L-1,此时,该反应化学反应速率v正___________ v逆(选填“>”、“<”或“=”)。
(4)向容积相同的恒容密闭容器中分别充入等量的CO2和H2,在不同催化剂(M型、N型)条件下反应相同时间,CO2转化率随反应温度变化如图示。
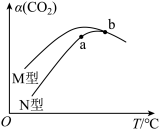
①使用___________ (选填M、N)型催化剂反应的活化能更高。
②a点处,v正___________ v逆(选填“>”、“<”或“=”)。
③b点不同催化剂作用下,CO2的转化率相同且均有下降趋势的原因是___________ 。
(1)与CO2相似,羰基硫(COS)中所有原子最外层也都满足8电子结构,COS电子式可表示为
(2)有人提出,可以设计反应CO2
 C+O2(ΔH>0,ΔS<0)来消除CO2对环境的影响。请你判断是否可行,并说明理由
C+O2(ΔH>0,ΔS<0)来消除CO2对环境的影响。请你判断是否可行,并说明理由(3)CO2和H2在一定条件下可制取甲醇,反应如下:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH=-49kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49kJ/mol。①在体积为1L的密闭容器中,充入1molCO2和3molH2,发生上述反应。若10分钟后,容器内压强为原来的0.625倍,则0到10分钟,氢气的平均反应速率为
②该反应的平衡常数K的表达式为
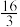 。该温度下,测得容器中c(CO2)=0.30mol•L-1、c(H2)=c(CH3OH)=c(H2O)=0.75mol•L-1,此时,该反应化学反应速率v正
。该温度下,测得容器中c(CO2)=0.30mol•L-1、c(H2)=c(CH3OH)=c(H2O)=0.75mol•L-1,此时,该反应化学反应速率v正(4)向容积相同的恒容密闭容器中分别充入等量的CO2和H2,在不同催化剂(M型、N型)条件下反应相同时间,CO2转化率随反应温度变化如图示。

①使用
②a点处,v正
③b点不同催化剂作用下,CO2的转化率相同且均有下降趋势的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】高中化学涉及的平衡理论主要包括化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,它们在工农业生产中都有广泛的应用,请回答下列问题:
(1)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中: ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:
完成下列填空:
①试比较 、
、 的大小,
的大小,
________  (填写“>”、“=”或“<”)。
(填写“>”、“=”或“<”)。
②将 和
和 投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是________ (填字母)。
A. B.混合气体的密度不再改变
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D. 的体积分数不再改变
的体积分数不再改变
(2)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸( )的结构如图:
)的结构如图: ,亚磷酸可由
,亚磷酸可由 水解而成,
水解而成, 溶液存在电离平衡:
溶液存在电离平衡: ,
, ,回答下列问题:
,回答下列问题:
① 属于
属于___________ (填“正盐”或“酸式盐”)。
②已知25℃时, 的
的 溶液的电离度为
溶液的电离度为 ,
, 的一级电离平衡常数
的一级电离平衡常数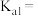
___________ (用含 的计算式表示,
的计算式表示, 第二步电离忽略不计,忽略水的电离)。
第二步电离忽略不计,忽略水的电离)。
③常温下,将 溶液滴加到亚磷酸(
溶液滴加到亚磷酸( )溶液中,混合溶液的
)溶液中,混合溶液的 与离子浓度变化的关系如图所示,则表示
与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线___________ (填“I”或“II”),亚磷酸( )的
)的
___________ 。

(1)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:
 ,其化学平衡常数K与温度t的关系如表:
,其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K |  |  | 0.5 |
①试比较
 、
、 的大小,
的大小,
 (填写“>”、“=”或“<”)。
(填写“>”、“=”或“<”)。②将
 和
和 投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是
投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是A.
 B.混合气体的密度不再改变
B.混合气体的密度不再改变C.混合气体的平均相对分子质量不再改变 D.
 的体积分数不再改变
的体积分数不再改变(2)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸(
 )的结构如图:
)的结构如图: ,亚磷酸可由
,亚磷酸可由 水解而成,
水解而成, 溶液存在电离平衡:
溶液存在电离平衡: ,
, ,回答下列问题:
,回答下列问题:①
 属于
属于②已知25℃时,
 的
的 溶液的电离度为
溶液的电离度为 ,
, 的一级电离平衡常数
的一级电离平衡常数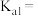
 的计算式表示,
的计算式表示, 第二步电离忽略不计,忽略水的电离)。
第二步电离忽略不计,忽略水的电离)。③常温下,将
 溶液滴加到亚磷酸(
溶液滴加到亚磷酸( )溶液中,混合溶液的
)溶液中,混合溶液的 与离子浓度变化的关系如图所示,则表示
与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线 )的
)的

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】一定条件下铁可以和CO2发生反应Fe(s)+CO2(g)⇌FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示

(1)t1min时,正、逆反应速率的大小关系为v正_______ v逆(填“>”“<“或“=”)。
(2)4min时,CO2的转化率为_______ (保留3位有效数字);0~4min内,CO的平均反应速率v(CO)=_______ 。
(3)下列选项能说明上述反应已达平衡状态的是_______ 。
①容器中CO2体积分数不再变化
②容器中气体质量不再变化
③容器中气体压强不再变化
④容器中气体的平均相对分子质量不再变化

(1)t1min时,正、逆反应速率的大小关系为v正
(2)4min时,CO2的转化率为
(3)下列选项能说明上述反应已达平衡状态的是
①容器中CO2体积分数不再变化
②容器中气体质量不再变化
③容器中气体压强不再变化
④容器中气体的平均相对分子质量不再变化
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某温度时,在2L密闭容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

(1)该反应的化学方程式为______ 。
(2)反应开始至2min,用Z表示的平均反应速率为______ ,平衡时X的转化率为______ ,此时加入1体积Ar,反应速率_______ (填“变大”、“变小”、“不变”)
(3)下列叙述能说明上述反应达到化学平衡状态的是_____ (填序号)。
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变

(1)该反应的化学方程式为
(2)反应开始至2min,用Z表示的平均反应速率为
(3)下列叙述能说明上述反应达到化学平衡状态的是
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.混合气体的密度不再发生改变
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某温度下,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。

(1)从开始至2min,Y的平均反应速率为_______  。
。
(2)该反应的化学方程式为_______ 。
(3)比较正逆反应速率的大小(填“>”或“<”或“=”)1min时,v(逆)_______ v(正);2min时,v(逆)_______ v(正)。
(4)X的平衡转化率为_______ 。
(5)下列能说明反应已达平衡的是_______ 。
a.X、Y、Z三种气体的浓度相等
b.气体混合物总物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=2︰1
e.单位时间内消耗3molX同时消耗2molZ

(1)从开始至2min,Y的平均反应速率为
 。
。(2)该反应的化学方程式为
(3)比较正逆反应速率的大小(填“>”或“<”或“=”)1min时,v(逆)
(4)X的平衡转化率为
(5)下列能说明反应已达平衡的是
a.X、Y、Z三种气体的浓度相等
b.气体混合物总物质的量不再改变
c.反应已经停止
d.反应速率v(X)︰v(Y)=2︰1
e.单位时间内消耗3molX同时消耗2molZ
您最近一年使用:0次

 /℃
/℃ /℃
/℃

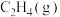
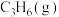
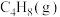



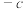
 催化还原
催化还原 、
、 的反应如下:
的反应如下: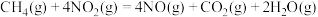
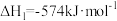
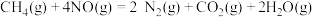

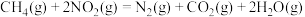

 还原
还原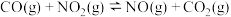
 ,其反应过程中的能量变化如图所示。
,其反应过程中的能量变化如图所示。
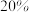 ,则
,则

