铜镍合金曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)铜元素基态原子的电子排布式为_________ ,3d能级上的未成对电子数为_________ 。
(2)氢氧化铜与氨水作用形成[Cu(NH3)4](OH)2深蓝色溶液。
①[Cu(NH3)4](OH)2中阳离子的立体构型是_________ 。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为_______________ ,提供孤电子对的成键原子是_______________ 。
③氨可以形成的晶体属于_______ 晶体(填晶体类型),其结构中的氮原子只能形成_______ 个氮氢键,其原因是______________________________________ 。
(3)N原子的第一电离能IN=l402.3kJ/mol,0原子的第一电离能I0=1313.9kJ/mol。IN>I0的原因是_____________________________ 。
(4)单质铜及镍都是由__________ 键形成的晶体。
(5)铜镍合金的立方晶胞结构如图所示。
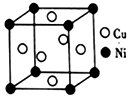
①晶胞中镍原子与铜原子的数量比为_______ 。
②若合金的密度为dg/cm3,晶体中任意―个Ni原子到最近Cu原子的距离为_______ cm(设NA为阿伏伽德罗常数的值)。
(1)铜元素基态原子的电子排布式为
(2)氢氧化铜与氨水作用形成[Cu(NH3)4](OH)2深蓝色溶液。
①[Cu(NH3)4](OH)2中阳离子的立体构型是
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为
③氨可以形成的晶体属于
(3)N原子的第一电离能IN=l402.3kJ/mol,0原子的第一电离能I0=1313.9kJ/mol。IN>I0的原因是
(4)单质铜及镍都是由
(5)铜镍合金的立方晶胞结构如图所示。

①晶胞中镍原子与铜原子的数量比为
②若合金的密度为dg/cm3,晶体中任意―个Ni原子到最近Cu原子的距离为
更新时间:2017-09-02 16:51:32
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】乙二胺四乙酸(EDTA)及其盐类能与多种金属离子发生络合反应,具有广泛用途。EDTA的分子结构如图所示。
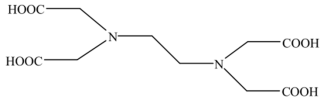
(1)EDTA所含元素电负性有小到大的顺序为_______ 。
(2)EDTA分子中碳原子采取的杂化类型为_______ 。基态氧原子核外电子有_______ 种运动状态。
(3)EDTA可以与 形成盐,
形成盐, 分子的VSEPR模型为
分子的VSEPR模型为_______ 。氨熔沸点低,铵盐熔沸点高,原因是_______ 。
(4)EDTA及其盐可与 形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中
形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中_______ 原子能够提供孤电子对有关。

(1)EDTA所含元素电负性有小到大的顺序为
(2)EDTA分子中碳原子采取的杂化类型为
(3)EDTA可以与
 形成盐,
形成盐, 分子的VSEPR模型为
分子的VSEPR模型为(4)EDTA及其盐可与
 形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中
形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.
(1)基态砷原子的电子排布式为 .
(2)K3[Fe(CN)5]晶体中Fe3+与CN﹣之间的化学键类型为 键,与CN﹣互为等电子体的化合物的分子式为 .
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B﹣N﹣B之间的夹角是 (填角度).
(4)对硝基苯酚水合物(化学式为C4H5NO3•1.5H2O)是一种含氮化合物.实验表明:加热至94℃时该晶体会失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性.
①该晶体中四种基本元素的电负性由大到小的顺序是 .
②对硝基苯酚分子中氮原子的杂化轨道类型是 .
(5)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜,它是通过在高温(T>750℃)氢气氛围下三溴化硼和三溴化磷反应制得的,三溴化硼分子的空间构型为 ,BP晶胞的结构如图所示,当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时,磷化硼中硼原子和磷原子之间的最近距离为 .

(1)基态砷原子的电子排布式为 .
(2)K3[Fe(CN)5]晶体中Fe3+与CN﹣之间的化学键类型为 键,与CN﹣互为等电子体的化合物的分子式为 .
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B﹣N﹣B之间的夹角是 (填角度).
(4)对硝基苯酚水合物(化学式为C4H5NO3•1.5H2O)是一种含氮化合物.实验表明:加热至94℃时该晶体会失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性.
①该晶体中四种基本元素的电负性由大到小的顺序是 .
②对硝基苯酚分子中氮原子的杂化轨道类型是 .
(5)磷化硼(BP)是一种有价值的耐磨硬涂层材料,这种陶瓷材料可作为金属表面的保护薄膜,它是通过在高温(T>750℃)氢气氛围下三溴化硼和三溴化磷反应制得的,三溴化硼分子的空间构型为 ,BP晶胞的结构如图所示,当晶胞晶格参数为478pm(即图中立方体的每条边长为478pm)时,磷化硼中硼原子和磷原子之间的最近距离为 .

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】以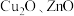 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2) 等金属具有良好的导电性,从金属键的理论看,原因是
等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
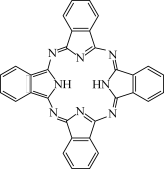
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(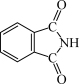 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属 能溶于氨水,生成以氨为配体,配位数为4的配离子,
能溶于氨水,生成以氨为配体,配位数为4的配离子, 与氨水反应的离子方程式为
与氨水反应的离子方程式为_______ 。
(5) 晶体中部分O原子被N原子替代后可以改善半导体的性能,
晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是_______ 。
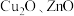 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)
 等金属具有良好的导电性,从金属键的理论看,原因是
等金属具有良好的导电性,从金属键的理论看,原因是(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属
 能溶于氨水,生成以氨为配体,配位数为4的配离子,
能溶于氨水,生成以氨为配体,配位数为4的配离子, 与氨水反应的离子方程式为
与氨水反应的离子方程式为(5)
 晶体中部分O原子被N原子替代后可以改善半导体的性能,
晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出R原子核外能量最高的电子的电子排布式:___________ 。
②常温下,不能与R单质发生反应的是___________ (选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高,不溶于水。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
①C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:___________ 。
②配平上述反应的化学方程式:___________ 。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
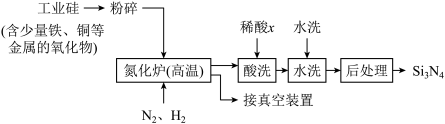
适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。x可能是___________ (选填:“盐酸”“硝酸”或“硫酸”),理由是___________ 。
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出R原子核外能量最高的电子的电子排布式:
②常温下,不能与R单质发生反应的是
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高,不溶于水。可由下列反应制得:SiO2+C+N2
 Si3N4+CO
Si3N4+CO①C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:
②配平上述反应的化学方程式:
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:

适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。x可能是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】中科院大连化学物理研究所科学家用Ni-BaH3/Al2O3、Ni-LiH等作催化剂,实现了在常压、100~300℃的条件下合成氨,这一成果发表在《Nature Energy》杂志上。
(1)基态 的核外电子排布式为
的核外电子排布式为___________ ,若该离子核外电子空间运动状态有15种,则该离子处于___________ (填“基”或“激发”)态。
(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中 的空间构型为
的空间构型为___________ 。
②甘氨酸中C原子的杂化方式为___________ ,晶体类型是___________ ,其熔、沸点远高于相对分子质量几乎相等的丙酸(熔点为-21℃,沸点为141℃)的主要原因:一是甘氨酸能形成内盐;二是___________ 。
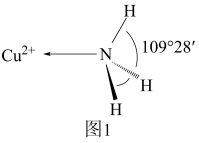
(3)NH3分子中的键角为107°,但在 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是___________ 。
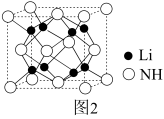
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数
___________  (列出表达式)。
(列出表达式)。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氨在粮食生产、国防中有着无可替代的地位,也是重要的化工原料,可用于合成氨基酸、硝酸、TNT等。甘氨酸(NH2CH2COOH)是组成最简单的氨基酸,熔点为182℃,沸点为233℃。
①硝酸溶液中
 的空间构型为
的空间构型为②甘氨酸中C原子的杂化方式为
(3)NH3分子中的键角为107°,但在
 中NH3分子的键角如图1所示,导致这种变化的原因是
中NH3分子的键角如图1所示,导致这种变化的原因是
(4)亚氨基锂(Li2NH)是一种储氢容量高、安全性能好的固体储氢材料,其晶胞结构如图2所示,若晶胞参数为dpm,密度为ρg/cm3,则阿伏加德罗常数

 (列出表达式)。
(列出表达式)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】钼酸铋作为新型半导体光催化材料,广泛应用于生产生活中。以氧化铋渣(主要成分是Bi2O3、Sb2O3、还含有Fe2O3、ZnO、Ag2O和SiO2等杂质)为原料制备钼酸铋(Bi2MoO6,其中Mo为+6价)的工艺流程如下:

回答下列问题:
(1)基态S的价电子排布式为___________ 。
(2)“浸渣”的主要成分为___________ (填化学式)。
(3)①“除锑”过程中发生反应的化学方程式为___________ ;
②该过程需要加热的原因为___________ 。
(4)H2S常温下为气体,而H2O常温下为液体的原因为___________ 。
(5)“酸溶”时会有NO逸出,此过程中氧化剂与还原剂的物质的量之比为___________ 。
(6)Bi2O3的立方晶胞结构如图所示(O占据部分Bi的四面体空隙),以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为( ,
, ,
, ),则C点坐标为
),则C点坐标为___________ 。晶胞边长为anm,则密度为___________ g·cm-3(Bi2O3的摩尔质量为Mr,阿伏加德罗常数为NA)


回答下列问题:
(1)基态S的价电子排布式为
(2)“浸渣”的主要成分为
(3)①“除锑”过程中发生反应的化学方程式为
②该过程需要加热的原因为
(4)H2S常温下为气体,而H2O常温下为液体的原因为
(5)“酸溶”时会有NO逸出,此过程中氧化剂与还原剂的物质的量之比为
(6)Bi2O3的立方晶胞结构如图所示(O占据部分Bi的四面体空隙),以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为(
 ,
, ,
, ),则C点坐标为
),则C点坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
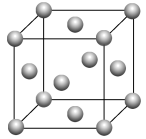
图5
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为_____________ 。
②Fe的一种晶胞结构如图5所示,测得晶胞边长为 a pm,
则Fe原子半径为_______ 。
③已知FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为___________ 。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体
是_________ ;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,图6所示的结构示意图中呈亮黄色的是______ (填“A”或“B”),理由是_________________________ 。
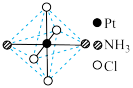
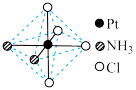
A B
图6
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图7。
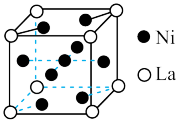
图7
①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为______________ 。
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为______ 。(不必计算出结果)

图5
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为
②Fe的一种晶胞结构如图5所示,测得晶胞边长为 a pm,
则Fe原子半径为
③已知FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体
是


A B
图6
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图7。

图7
①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】M、N、R、T为周期表中前四周期相邻两个周期的元素,且原子序数依次增大。已知T的次外层上电子没有排满,且该能层中成对电子数等于其它各能层上电子的总数;R和T在同一族;N的外围电子总数为6,均为未成对电子。根据以上信息,回答下列问题:
(1)T的元素符号为___________ ,在周期表中位于__________ 族,N的价电子排布式为___________ 。
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式:_________________________ 。
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为_____________ 。

(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为__________ ,配位数为__________ 。N与甲基丙烯酸根的配合物为:
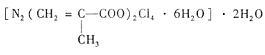 该化合物中存在的化学键类型有
该化合物中存在的化学键类型有__________ 。甲基丙烯酸分子中C原子的杂化方式有_____________ 。
(1)T的元素符号为
(2)M和R两种元素组成的常见化合物有两种,其中一种可以单质之间进行化合,生成R的高价态化合物,请写出该反应的化学方程式:
(3)表面上附着氮原子的R可做为工业催化剂,下图为氮原子在R的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表R原子)。则图示颗粒表面上氮原子与R原子的个数比为

(4)T、N都有多种配合物,[T(NH3)3(H2O)M2]M是T配合物的一种,其中心离子的化合价为
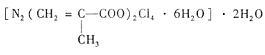 该化合物中存在的化学键类型有
该化合物中存在的化学键类型有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铬及其化合物在工业上有重要用途 请回答下列问题:
请回答下列问题:
(1)基态铬原子的核外电子排布式为_______ 。
(2)沙瑞特试剂[(C5H5N)2∙CrO3]是一种高选择性氧化剂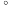 例如它可将乙醇氧化生成乙醛而不继续氧化生成乙酸。
例如它可将乙醇氧化生成乙醛而不继续氧化生成乙酸。
①沙瑞特试剂组成元素中C、O、N的第一电离能从大到小顺序为_______ 。
②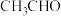 分子中C原子的杂化类型为
分子中C原子的杂化类型为_______ 。
(3)氯化铬酰(CrO2Cl2)熔点: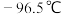 ,沸点:
,沸点: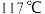 ,能与CS2等互溶
,能与CS2等互溶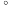 则固态
则固态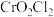 属于
属于_______ 晶体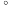 已知
已知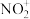 与CS2互为等电子体,则1mol
与CS2互为等电子体,则1mol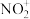 中含有
中含有 键数目为
键数目为_______ 。
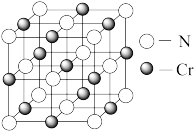
(4)元素Cr的一种氮化物晶体的晶胞结构如图所示,则该化合物的化学式为_______ 。
(5)已知配合物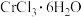 中心原子
中心原子 配位数为6,向含
配位数为6,向含 的溶液中滴加
的溶液中滴加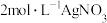 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液50mL,则配离子的化学式为
溶液50mL,则配离子的化学式为_______ 。
 请回答下列问题:
请回答下列问题:(1)基态铬原子的核外电子排布式为
(2)沙瑞特试剂[(C5H5N)2∙CrO3]是一种高选择性氧化剂
 例如它可将乙醇氧化生成乙醛而不继续氧化生成乙酸。
例如它可将乙醇氧化生成乙醛而不继续氧化生成乙酸。①沙瑞特试剂组成元素中C、O、N的第一电离能从大到小顺序为
②
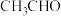 分子中C原子的杂化类型为
分子中C原子的杂化类型为(3)氯化铬酰(CrO2Cl2)熔点:
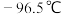 ,沸点:
,沸点: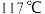 ,能与CS2等互溶
,能与CS2等互溶 则固态
则固态 属于
属于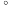 已知
已知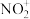 与CS2互为等电子体,则1mol
与CS2互为等电子体,则1mol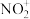 中含有
中含有 键数目为
键数目为(4)元素Cr的一种氮化物晶体的晶胞结构如图所示,则该化合物的化学式为

(5)已知配合物
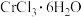 中心原子
中心原子 配位数为6,向含
配位数为6,向含 的溶液中滴加
的溶液中滴加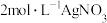 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液50mL,则配离子的化学式为
溶液50mL,则配离子的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】A、B、C、D、E、F是元素周期表前四周期的元素, 它们在元素周期表中的位置如下图所示:

(1)写出F的基态原子核外电子排布式:___ 。E的晶胞结构如图所示,该晶胞中含有金属原子的数目为__ 。

(2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是_______ 。
(3)由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是_________ ,其中碳氧原子之间的共价键是________ (填序号)。
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)EB晶胞如图所示,EB晶体中E2+的配位数为____ ,EB晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:EB—3401 kJ·mol-1、NaCl—786 kJ·mol-1。导致两者晶格能差异的主要原因是____

(5)元素A形成的单质的晶体类型可以是原子晶体,如___ (填写物质名称),也可以是___ ,如C60。

(1)写出F的基态原子核外电子排布式:

(2)C元素的第一电离能比同周期相邻的两种元素的第一电离能都高的原因是
(3)由A、B、D三种元素形成的一种物质俗称光气,分子中A原子采取sp2杂化成键。光气分子的结构式是
a.2个σ键 b.2个π键 c.1个σ键、1个π键
(4)EB晶胞如图所示,EB晶体中E2+的配位数为

(5)元素A形成的单质的晶体类型可以是原子晶体,如
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)铜原子在基态时的价电子排布式为__________ 。金属铜的结构形式为面心立方最密堆积,晶胞中每个铜原子周围最近的铜原子有________ 个。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释_______________________ 。
(3)GaC13和AsF3的空间构型分别是:_________ ,_______ 。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________ ;
②[B(OH)4]-的结构式为_________________ 。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______________ (用化学式表示);
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm (1pm=10-12m)。立方氮化硼的密度是______ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(1)铜原子在基态时的价电子排布式为
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度加以解释
(3)GaC13和AsF3的空间构型分别是:
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为
②[B(OH)4]-的结构式为
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm (1pm=10-12m)。立方氮化硼的密度是
您最近一年使用:0次
【推荐3】钛由于其稳定的化学性质和良好的机械、物理性能被美誉为“未来钢铁”、“战略金属”,二氧化钛是性能很好的一种美白、防晒化妆品原料。回答下列问题:
(1)基态钛原子核外共有___________ 种运动状态不相同的电子;下列Ti原子价电子排布图中,因违背“洪特规则”而不可能存在的是___________ (填标号,下同);可能存在的基态或激发态原子中能量最高的是___________ 。
A. B.
B.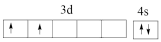
C. D.
D.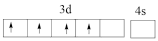
(2)从物质结构角度解释钛比铝硬度大、强度高的原因___________ 。
(3)常温下TiCl4是一种无色液体,分子结构与CCl4相同。TiCl4极易水解生成Ti(OH)4,再使Ti(OH)4受热分解制备TiO2。
①TiCl4晶体类型是___________ 。
②Ti(OH)4中Ti原子采取___________ 杂化方式。
③TiCl4稳定性比CCl4差,试从物质结构角度分析其原因___________ 。
④焙烧Ti(OH)4后会有少量的TiO2残留在容器内壁不易去除,我们可以用NaOH溶液将残留的TiO2洗干净。请用化学方程式表示该洗涤原理___________ 。
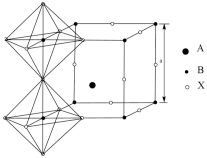
(4)钙钛矿材料具备了吸光性、电催化性等很多独特的理化性质,CaTiO3晶体结构如图所示。其中A代表___________ (写离子符号),它的配位数是___________ 。CaTiO3晶体密度约为4.0 g/cm3,阿伏加德罗常数用NA表示,则该立方晶胞参数a=___________ nm(写出计算式即可)。
(1)基态钛原子核外共有
A.
 B.
B.
C.
 D.
D.
(2)从物质结构角度解释钛比铝硬度大、强度高的原因
(3)常温下TiCl4是一种无色液体,分子结构与CCl4相同。TiCl4极易水解生成Ti(OH)4,再使Ti(OH)4受热分解制备TiO2。
①TiCl4晶体类型是
②Ti(OH)4中Ti原子采取
③TiCl4稳定性比CCl4差,试从物质结构角度分析其原因
④焙烧Ti(OH)4后会有少量的TiO2残留在容器内壁不易去除,我们可以用NaOH溶液将残留的TiO2洗干净。请用化学方程式表示该洗涤原理
(4)钙钛矿材料具备了吸光性、电催化性等很多独特的理化性质,CaTiO3晶体结构如图所示。其中A代表

您最近一年使用:0次



