Ⅰ、某同学想通过下列实验装置来验证硫、碳、硅的非金属性的强弱:

则A中的药品是____________ (写化学式,下同),B中的药品是_________ ,C中的药品是___________ 。
Ⅱ、为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
(1)上表中,反应速率最快的是____ ;
(2)设计实验2、3的目的是____________________ ;
(3)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响___________ 。

则A中的药品是
Ⅱ、为分别验证温度、浓度、催化剂颗粒大小对化学反应速率的影响规律,某同学设计了如下4组实验。
| 实验序号 | 温度 | H2O2溶液初始浓度 | MnO2颗粒大小 |
| 1 | 25℃ | 4% | 无MnO2 |
| 2 | 25℃ | 12% | 1g细颗粒MnO2 |
| 3 | 25℃ | 4% | 1g细颗粒MnO2 |
| 4 | 25℃ | 4% | 1g粗颗粒MnO2 |
(2)设计实验2、3的目的是
(3)设计一个实验证明在其它条件相同时,改变温度对过氧化氢分解速率的影响
更新时间:2017-09-19 08:08:16
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某酸性工业废水中含有K2Cr2O7 ,光照下,草酸(H2C2O4)能将其中的Cr2O 转化为Cr3+。某课题组为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表。
测得实验①和②溶液中的Cr2O 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为____________________ (填化学式);
(3)实验①和②的结果表明_______________________________ ;
(4)实验①中0~t1时间段反应速率v(Cr3+)=___________________ mol·L-1·min-1(用代数式表示)。

 转化为Cr3+。某课题组为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Cr3+。某课题组为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表。
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 | a= |
测得实验①和②溶液中的Cr2O
 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。(2)上述反应后草酸被氧化为
(3)实验①和②的结果表明
(4)实验①中0~t1时间段反应速率v(Cr3+)=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】某化学兴趣学习小组用实验探究铜与硝酸反应的快慢及产物。
(1)[实验1]将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,溶液呈蓝色,在液面上方出现浅红棕色气体的化学方程式为___________ 。
(2)[实验2]铜与浓HNO3反应,装置、现象如下:
实验现象“最初反应较慢,随后加快”的原因可能是___________ 。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。设计[实验3]探究如下:
[实验3-1]向1mL浓硝酸中加入几滴30%H2O2溶液、铜片,反应较慢,溶液呈蓝色。
[实验3-2]向1mL浓硝酸中加入几滴30%H2O2溶液,无明显变化。
①[实验2]的B溶液中存在的阴离子有NO 、
、___________ 和极少量的OH-。[实验3-1]中反应变慢的原因是___________ 。
②对比[实验3-1]与[实验3-2]的现象分析,浓硝酸的氧化性比亚硝酸氧化性___________ (填“强”或“弱”)。
③对生成HNO2后反应变快的原因进行实验探究。
[实验3-3]中加入的固体为___________ 。[实验3-4]中“放置一段时间”的目的是___________ 。
(4)化学小组同学结合[实验1]、[实验2]中HNO3被还原后的气体产物以及[实验3-3]的产物,综合上述实验,分析判断[实验1]中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是___________ 。
(1)[实验1]将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,溶液呈蓝色,在液面上方出现浅红棕色气体的化学方程式为
(2)[实验2]铜与浓HNO3反应,装置、现象如下:
| 实验装置 | 实验现象 |
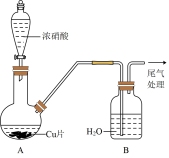 | A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色 B中:溶液呈淡蓝色 |
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。设计[实验3]探究如下:
[实验3-1]向1mL浓硝酸中加入几滴30%H2O2溶液、铜片,反应较慢,溶液呈蓝色。
[实验3-2]向1mL浓硝酸中加入几滴30%H2O2溶液,无明显变化。
①[实验2]的B溶液中存在的阴离子有NO
 、
、②对比[实验3-1]与[实验3-2]的现象分析,浓硝酸的氧化性比亚硝酸氧化性
③对生成HNO2后反应变快的原因进行实验探究。
| 序号 | 实验操作 | 实验现象 |
| [实验3-3] | 取[实验2]B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
| [实验3-4] | 取[实验2]B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较[实验3-3]慢;液面上方呈浅红棕色 |
(4)化学小组同学结合[实验1]、[实验2]中HNO3被还原后的气体产物以及[实验3-3]的产物,综合上述实验,分析判断[实验1]中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】I、某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用滴定管量取20.00mL待测溶液到锥形瓶中
②将甲仪器用蒸馏水洗净,再用标准酸液润洗2次~3次后,向其中注入 标准盐酸,调节甲仪器的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
标准盐酸,调节甲仪器的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定,测得消耗盐酸的体积为 mL。
mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为 mL。
mL。
试回答下列问题:
(1)甲仪器的名称为_______ 。
(2)如图是某次滴定时的甲仪器中的液面,其读数为_______ mL。

(3)滴定至终点时的现象为:_______ 。
(4)根据下列数据:
请计算待测烧碱溶液的浓度为_______  (保留四位有效数字)。
(保留四位有效数字)。
(5)滴定前,甲仪器的尖嘴部分有气泡未排出,滴定后气泡消失。则所测得的NaOH浓度将_______ (填“偏大”、“偏小”或“不变)。
II.探究酸性 溶液与
溶液与 溶液反应速率的影响因素,已知反应化学方程式为(部分产物未写出):
溶液反应速率的影响因素,已知反应化学方程式为(部分产物未写出):  _______,有关实验数据如表所示:
_______,有关实验数据如表所示:
(6)比较a和b的大小:a_______ b(填“<”、“>”或“=”)
(7)25℃,编号1实验,用 的浓度表示该反应速率,
的浓度表示该反应速率,
_______ (保留两位有效数字)。
①用滴定管量取20.00mL待测溶液到锥形瓶中
②将甲仪器用蒸馏水洗净,再用标准酸液润洗2次~3次后,向其中注入
 标准盐酸,调节甲仪器的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
标准盐酸,调节甲仪器的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。③向锥形瓶中滴入酚酞作指示剂,进行滴定,测得消耗盐酸的体积为
 mL。
mL。④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为
 mL。
mL。试回答下列问题:
(1)甲仪器的名称为
(2)如图是某次滴定时的甲仪器中的液面,其读数为

(3)滴定至终点时的现象为:
(4)根据下列数据:
| 滴定次数 | 待测液体体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第1次 | 20.00 | 0.50 | 25.40 |
| 第2次 | 20.00 | 4.00 | 29.10 |
 (保留四位有效数字)。
(保留四位有效数字)。(5)滴定前,甲仪器的尖嘴部分有气泡未排出,滴定后气泡消失。则所测得的NaOH浓度将
II.探究酸性
 溶液与
溶液与 溶液反应速率的影响因素,已知反应化学方程式为(部分产物未写出):
溶液反应速率的影响因素,已知反应化学方程式为(部分产物未写出):  _______,有关实验数据如表所示:
_______,有关实验数据如表所示:| 实验编号 | 温度/℃ | 催化剂用量/g | 酸性 |  溶液 溶液 |  溶液褪色平均时间(min) 溶液褪色平均时间(min) | ||
| 体积(mL) | 浓度( ) ) | 体积(mL) | 浓度( ) ) | ||||
| 1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
| 2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
| 3 | 25 | 0 | 4 | 0.1 | 8 | 0.2 | b |
(7)25℃,编号1实验,用
 的浓度表示该反应速率,
的浓度表示该反应速率,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某研究性学习小组设计了一组实验来探究元素周期律。甲同学一次性完成N、C、Si的非金属性强弱的比较;乙同学完成了氧元素的非金属性比硫强的实验。
(1)从以下所给物质中选出甲同学设计的实验所用到物质: 稀
稀 溶液
溶液 稀盐酸
稀盐酸 碳酸钙
碳酸钙 溶液
溶液

试剂A为______ ;试剂C为______  填序号
填序号
(2)乙同学设计的实验所用到试剂A为______ ;装置C中反应的化学方程式为______ 。
(1)从以下所给物质中选出甲同学设计的实验所用到物质:
 稀
稀 溶液
溶液 稀盐酸
稀盐酸 碳酸钙
碳酸钙 溶液
溶液

试剂A为
 填序号
填序号
(2)乙同学设计的实验所用到试剂A为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】如图是元素周期表的一部分,表中所列字母分别代表某一种元素,请回答相关问题:
(1)元素E为_______ (填元素符号)。
(2)元素D与C形成的既有离子键又有共价键的化合物的电子式为_______ 。
(3)元素B、C、F、M分别与元素A形成的最简单化合物中沸点最高的是_______ (填化学式)。
(4)元素C和F形成的一种化合物能使酸性高锰酸钾溶液褪色,离子方程式为_______ ,该反应中的氧化产物、还原产物物质的量之比为_______ 。
(5)元素B与A形成的有机物BA4与M的单质在光照下可发生取代反应,当二者按等物质的量反应时,产物有_______ 种。分子式为B2A4的不饱和烃,使N单质的四氯化碳溶液褪色,其化学方程式为_______ 。
| A | |||||||||||||||||
| B | C | ||||||||||||||||
| D | E | F | M | ||||||||||||||
| N |
(2)元素D与C形成的既有离子键又有共价键的化合物的电子式为
(3)元素B、C、F、M分别与元素A形成的最简单化合物中沸点最高的是
(4)元素C和F形成的一种化合物能使酸性高锰酸钾溶液褪色,离子方程式为
(5)元素B与A形成的有机物BA4与M的单质在光照下可发生取代反应,当二者按等物质的量反应时,产物有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是_______(填字母序号);
(2)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_______ (填字母序号)。
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
实验结论:随原子序数增大,同周期元素失电子能力依次_______ (填“增强”或“减弱”,下同),得电子能力依次_______ 。同主族元素失电子能力依次_______ (填“增强”或“减弱”,下同),得电子能力依次_______ ;
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题实验装置:(已知酸性强弱:亚硫酸>碳酸)
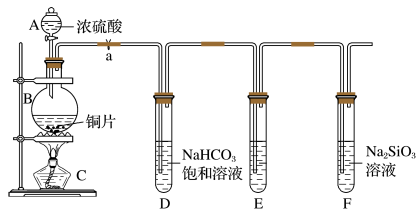
(3)铜与浓硫酸反应的化学方程式是_______ ;
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是_______ ;试管F中发生反应的离子方程式为_______ 。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)反应最剧烈的烧杯中金属是_______(填字母序号);
| A.钠 | B.镁 | C.铝 | D.钾 |
A.把烧杯中的冷水换成热水
B.把烧杯中的冷水换成盐酸
C.把烧杯中的冷水换成浓硝酸
实验结论:随原子序数增大,同周期元素失电子能力依次
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题实验装置:(已知酸性强弱:亚硫酸>碳酸)

(3)铜与浓硫酸反应的化学方程式是
(4)能说明碳元素的非金属性比硅元素非金属性强的实验现象是
您最近一年使用:0次



