工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3,难溶于水),其中一部分铁元素在风化过程中会转化为+3价。
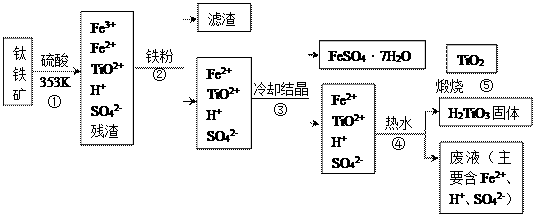
已知:TiOSO4遇水会水解。
(1)步骤①中,钛酸亚铁与硫酸反应的离子方程式为__________________ 。
(2)步骤③中,实现混合物的分离是利用物质的___________ (填字母序号)。
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤④的操作是_______________ (填操作名称)。
(4)步骤④中将TiO2+转化为H2TiO3的原理TiO2++2H2O⇌H2TiO3+2H+,该反应的∆H_______ 0(填>或<);加水稀释,平衡_________ (填“正向”、“逆向”或“不”)移动。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________ 。
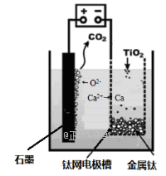
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。在制备金属钛前后,CaO的总量不变,其原因是(请用化学方程式解释)______________________________ 。

已知:TiOSO4遇水会水解。
(1)步骤①中,钛酸亚铁与硫酸反应的离子方程式为
(2)步骤③中,实现混合物的分离是利用物质的
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤④的操作是

(4)步骤④中将TiO2+转化为H2TiO3的原理TiO2++2H2O⇌H2TiO3+2H+,该反应的∆H
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。在制备金属钛前后,CaO的总量不变,其原因是(请用化学方程式解释)
更新时间:2017-10-07 09:07:38
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的实验现象是___________ 。
②将Y电极反应产物通入Na2S溶液中,发生反应的离子方程式为___________ 。
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为___________ ,工作一段时间后pH将___________ (填“增大”或 “减小”或“不变”) 。
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2g,该金属的摩尔质量是___________ 。

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的实验现象是
②将Y电极反应产物通入Na2S溶液中,发生反应的离子方程式为
(2)若要在铁制品上镀一定厚度的Ag,Y电极反应式为
(3)若X、Y都是铂电极,电解某金属M的氯化物(MCl2)溶液,当收集到1.12 L氯气时(标准状况),阴极增重3.2g,该金属的摩尔质量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某实验小组欲通过测定单位时间内酸性KMnO4溶液和H2C2O4(草酸)溶液反应生成CO2的体积,探究影响该化学反应速率的因素,设计的实验方案如下(KMnO4溶液已酸化),实验装置如图所示。
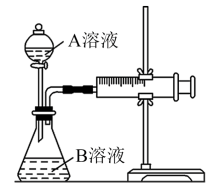
(1)写出酸性KMnO4溶液和H2C2O4(草酸)溶液反应的离子方程式____ 。
(2)该实验探究的是____ 因素对化学反应速率的影响;相同时间内针筒中所得CO2的体积大小关系是①____ ②(填“>”、“<”或“=”)。
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c( )=
)=___ mol/L。(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定___ 来比较化学反应速率。
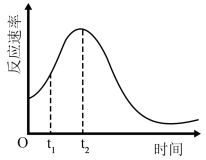
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②____ 。

实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol/LH2C2O4溶液 | 30mL0.01mol/LKMnO4溶液 |
② | 20mL0.2mol/LH2C2O4溶液 | 30mL0.01mol/LKMnO4溶液 |
(2)该实验探究的是
(3)若实验①在2min末收集了4.48mLCO2(标准状况下),则在2min末,c(
 )=
)=(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂、②

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】三氯化六氨合钴(Ⅲ){[Co(NH3)6]Cl3}是制备其它三价钴配合物的重要试剂。
已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3•6H2O在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
制备[Co(NH3)6]Cl3•6H2O的实验操作步骤如下:
第一步:混合。取研细的CoCl2•6H2O和NH4Cl溶解后转入三颈烧瓶,加入活性炭作催化剂。
第二步:配合、氧化。如图装置,先向三颈烧瓶滴加过量氨水,充分反应,再向混合溶液中滴加H2O2,水浴加热温度控制在50~60℃,充分搅拌,生成的[Co(NH3)6]Cl3吸附在活性炭上。

第三步:获取[Co(NH3)6]Cl3•6H2O。
回答下列问题:
(1)加入的NH4Cl溶液有利于后续Co2+与NH3的配合反应,其原理是_______ 。
(2)加入H2O2溶液时发生反应的离子方程式为_________ 。
(3)向三颈烧瓶中先滴加氨水后滴加H2O2的原因是_________ 。
(4)已知:稀盐酸可将吸附在活性炭上的[Co(NH3)6]Cl3溶解。请补充完整第三步实验方案:将三颈烧瓶中所得混合物充分搅拌、趁热过滤,________ ,低温干燥。(实验中须使用的试剂:稀盐酸、浓盐酸、无水乙醇。)
(5)为测定产品中钴的含量,进行下列实验:
称取3.5400g产品,加入足量NaOH溶液蒸出NH3,再加入稀硫酸,使[Co(NH3)6]Cl3全部转化为Co3+,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液12.00mL。(反应原理:Co3++I-→Co2++I2、I2+S2O →I-+S4O
→I-+S4O 未配平),计算产品中钴元素的质量分数
未配平),计算产品中钴元素的质量分数________ (写出计算过程)。
已知:①Co2+不易被氧化,Co3+具有强氧化性;[Co(NH3)6]2+具有较强还原性,[Co(NH3)6]3+性质稳定。
②[Co(NH3)6]Cl3•6H2O在水中的溶解度随温度的升高而增大,加入浓盐酸有利于晶体析出。
制备[Co(NH3)6]Cl3•6H2O的实验操作步骤如下:
第一步:混合。取研细的CoCl2•6H2O和NH4Cl溶解后转入三颈烧瓶,加入活性炭作催化剂。
第二步:配合、氧化。如图装置,先向三颈烧瓶滴加过量氨水,充分反应,再向混合溶液中滴加H2O2,水浴加热温度控制在50~60℃,充分搅拌,生成的[Co(NH3)6]Cl3吸附在活性炭上。

第三步:获取[Co(NH3)6]Cl3•6H2O。
回答下列问题:
(1)加入的NH4Cl溶液有利于后续Co2+与NH3的配合反应,其原理是
(2)加入H2O2溶液时发生反应的离子方程式为
(3)向三颈烧瓶中先滴加氨水后滴加H2O2的原因是
(4)已知:稀盐酸可将吸附在活性炭上的[Co(NH3)6]Cl3溶解。请补充完整第三步实验方案:将三颈烧瓶中所得混合物充分搅拌、趁热过滤,
(5)为测定产品中钴的含量,进行下列实验:
称取3.5400g产品,加入足量NaOH溶液蒸出NH3,再加入稀硫酸,使[Co(NH3)6]Cl3全部转化为Co3+,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入过量的KI溶液,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液12.00mL。(反应原理:Co3++I-→Co2++I2、I2+S2O
 →I-+S4O
→I-+S4O 未配平),计算产品中钴元素的质量分数
未配平),计算产品中钴元素的质量分数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验,回答下列问题:
I.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a盛装的物质是为_______ (填试剂的名称);装置中F的作用:_______ 。
(2)硬质玻璃管直接接入收集器的优点是_______ 。
II.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是_______ 。
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______ 。
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4mL0.1mol/LFeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______ (填化学式)。
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应ii:2Cu2++4SCN-=2CuSCN↓+(SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______ (填“反应i”或“反应ii”)。小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______ 。
I.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a盛装的物质是为
(2)硬质玻璃管直接接入收集器的优点是
II.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4mL0.1mol/LFeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应ii:2Cu2++4SCN-=2CuSCN↓+(SCN)2
设计实验如下:
| 操作 | 现象 |
| 在盛有2mL0.1mol·L-1CuSO4溶液的试管中滴加KSCN溶液 | 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:
您最近一年使用:0次
【推荐2】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍和硫酸铜晶体的新工艺。工艺流程如图所示:
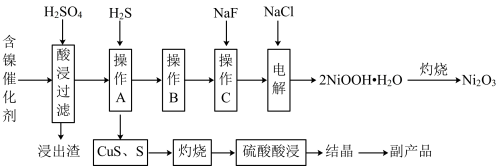
已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
请回答下列问题:
(1)加快酸浸速率的常用措施有___________ (任写一条即可)。
(2)“浸出渣”主要成分为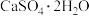 和
和___________ 两种物质。
(3)“操作B”的过程是:先在40~50℃温度下加入 ,其作用是
,其作用是___________ (用离子方程式表示);再调pH至___________ (填pH范围),操作B可除去溶液中的___________ 元素(填元素名称)。
(4)在碱性条件下,电解产生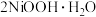 的原理是:
的原理是: 在阳极被氧化为
在阳极被氧化为 ,
, 再被
再被 氧化产生
氧化产生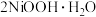 沉淀。请写出
沉淀。请写出 被
被 氧化得到
氧化得到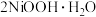 沉淀的离子方程式
沉淀的离子方程式___________ 。
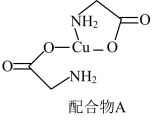
(5)配合物A常用于医药、电镀等方面,其结构如图所示。向硫酸铜溶液中滴入氨基乙酸钠(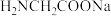 )即可得到它,配合物A中的配位原子的电负性由大到小的顺序是
)即可得到它,配合物A中的配位原子的电负性由大到小的顺序是___________ 。

已知:常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 |  |  |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
请回答下列问题:
(1)加快酸浸速率的常用措施有
(2)“浸出渣”主要成分为
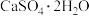 和
和(3)“操作B”的过程是:先在40~50℃温度下加入
 ,其作用是
,其作用是(4)在碱性条件下,电解产生
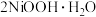 的原理是:
的原理是: 在阳极被氧化为
在阳极被氧化为 ,
, 再被
再被 氧化产生
氧化产生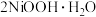 沉淀。请写出
沉淀。请写出 被
被 氧化得到
氧化得到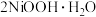 沉淀的离子方程式
沉淀的离子方程式(5)配合物A常用于医药、电镀等方面,其结构如图所示。向硫酸铜溶液中滴入氨基乙酸钠(
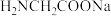 )即可得到它,配合物A中的配位原子的电负性由大到小的顺序是
)即可得到它,配合物A中的配位原子的电负性由大到小的顺序是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】钯(Pd)是有机合成中常用的催化剂。一种由废钯催化剂(主要成分为Pd,还有PdO、Fe有机物残留以及其他杂质)制取金属Pd的工艺流程如图:

回答下列问题:
(1)废钯催化剂经烘干、粉碎后,再在700℃的高温下焙烧,不断通入足量空气的目的除了使有机物充分燃烧而除去,还可以___ 。
(2)查资料可知,PdO不溶于王水,加入甲酸还原PdO,其目的是___ ,
(3)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为___ ;酸溶时温度不能过高,原因是___ 。
(4)加入适量的稀氨水溶液调节pH至3~4除杂,废渣的主要成分是___ 。
(5)焙烧2的目的是___ ;
(6)有水参加情况下,可以将CO通入氯化钯(PdCl2)得到黑色金属Pd粉末,化学方程式为___ 。

回答下列问题:
(1)废钯催化剂经烘干、粉碎后,再在700℃的高温下焙烧,不断通入足量空气的目的除了使有机物充分燃烧而除去,还可以
(2)查资料可知,PdO不溶于王水,加入甲酸还原PdO,其目的是
(3)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为
(4)加入适量的稀氨水溶液调节pH至3~4除杂,废渣的主要成分是
(5)焙烧2的目的是
(6)有水参加情况下,可以将CO通入氯化钯(PdCl2)得到黑色金属Pd粉末,化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】汽车尾气中含有 、
、 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)已知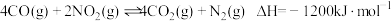
①该反应在__________ (填“高温”“低温”或“任何温度”)下能自发进行。
②某实验小组模拟上述净化过程,一定温度下,在容积为 的恒容密闭容器中起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中
的恒容密闭容器中起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为______ ;两种方式达平衡时, 的体积分数:甲
的体积分数:甲_______ 乙(填“>”“=”“<”或“不确定”,下同), 的浓度:甲
的浓度:甲_______ 乙。
(2)柴油汽车尾气中的碳烟 和
和 可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(
可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物( 、
、 、
、 )与
)与 的相关数据如图所示。
的相关数据如图所示。
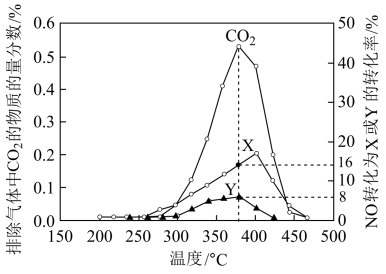
①375℃时,测得排出的气体中含 和
和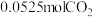 ,则Y的化学式为
,则Y的化学式为______ 。
②实验过程中采用 模拟
模拟 ,而不采用
,而不采用 的原因是
的原因是_________ 。
 、
、 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。(1)已知
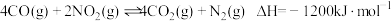
①该反应在
②某实验小组模拟上述净化过程,一定温度下,在容积为
 的恒容密闭容器中起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中
的恒容密闭容器中起始时按照甲、乙两种方式进行投料,经过一段时间后达到平衡状态,测得甲中 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为 的体积分数:甲
的体积分数:甲 的浓度:甲
的浓度:甲| 甲 | 乙 |
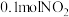 | 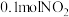 |
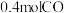 |  |
 和
和 可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物(
可通过某含钴催化剂催化消除。不同温度下,将模拟尾气(成分如表所示)以相同的流速通过该催化剂测得所有产物( 、
、 、
、 )与
)与 的相关数据如图所示。
的相关数据如图所示。
| 模拟尾气 | 气体 | 碳烟 | ||
 |  |  | ||
| 物质的量 | 0.025 | 0.5 | 9.475 | a |
 和
和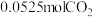 ,则Y的化学式为
,则Y的化学式为②实验过程中采用
 模拟
模拟 ,而不采用
,而不采用 的原因是
的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】亚硝酰氯(NOCl)是有机合成中的重要试剂,工业上可由NO与Cl2反应制得,回答下列问题:
Ⅰ.(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g)ΔH1;K1
NaNO3(s)+NOCl(g)ΔH1;K1
4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NO(g)+Cl2(g) 2NOCl(g)ΔH3;K3
2NOCl(g)ΔH3;K3
则ΔH3=___________ (用ΔH1和ΔH2表示)。
Ⅱ.工业上通常用如下反应制备亚硝酰氯:2NO(g)+Cl2(g) 2NOCl(g)ΔH<0。
2NOCl(g)ΔH<0。
(2)已知上述反应中逆反应速率的表达式为v逆=k·cn(NOCl)。300℃时,测得逆反应速率与NOCl的浓度的关系如表所示:
当c(NOCl)=0.50mol·L-1时,v逆=___________ mol·L-1·s-1。
(3)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
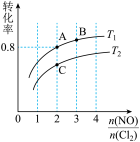
①图中T1、T2的关系为T1___________ T2(填“>”“<”或“=”);图中纵坐标为物质___________ 的转化率。图中A、B、C三点对应的NOCl体积分数最大的是___________ (填“A”“B”或“C”)。
②若容器容积为1L,B点的平衡常数为___________ 。
③若在温度为T1,容积为1L的容器中,充入0.5molNO、1molCl2、2molNOCl,υ(正)___________ υ(逆)(填“<”“>”或“=”)。
Ⅰ.(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
2NO2(g)+NaCl(s)
 NaNO3(s)+NOCl(g)ΔH1;K1
NaNO3(s)+NOCl(g)ΔH1;K14NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K2
2NaNO3(s)+2NO(g)+Cl2(g)ΔH2;K22NO(g)+Cl2(g)
 2NOCl(g)ΔH3;K3
2NOCl(g)ΔH3;K3则ΔH3=
Ⅱ.工业上通常用如下反应制备亚硝酰氯:2NO(g)+Cl2(g)
 2NOCl(g)ΔH<0。
2NOCl(g)ΔH<0。(2)已知上述反应中逆反应速率的表达式为v逆=k·cn(NOCl)。300℃时,测得逆反应速率与NOCl的浓度的关系如表所示:
| c(NOCl)/(mol/L) | v逆/(mol∙L-1∙s-1) |
| 0.20 | 1.6×10-9 |
| 0.40 | 6.4×10-9 |
(3)保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为T1
②若容器容积为1L,B点的平衡常数为
③若在温度为T1,容积为1L的容器中,充入0.5molNO、1molCl2、2molNOCl,υ(正)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氮的化合物应用广泛,但氮氧化物是主要的空气污染物,应降低其排放量。
(1) 用CO2和NH3可合成氮肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ·mol-1;
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ·mol-1;
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1。
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为_______ 。
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)ΔH在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:
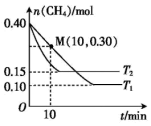
①据图判断该反应的ΔH_______ (填“>”“<”“=”)0,理由是 _______ 。
②温度为T1时,0~10 min内,NO2的平均反应速率v(NO2)=_______ 。
③该反应达到平衡后,为提高反应速率同时提高NO2的转化率,可采取的措施有_______ (填字母)。
A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增大CH4的浓度
(3) 利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液。工作一段时间后,该电池正极附近溶液的pH_______ (填“增大” “减小”或“不变”),负极的电极反应式为_______ 。
(4)氮的一种氢化物为HN3,其水溶液酸性强弱与醋酸相似,25℃时,将a mol·L-1HN3与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N ),则该混合溶液呈
),则该混合溶液呈_______ (填“酸”“碱”或“中”)性,溶液中c(HN3)=_______ mol·L-1。此温度下Ka(HN3)=_______ (用a.b表示)
(1) 用CO2和NH3可合成氮肥尿素[CO(NH2)2]。
已知:①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-159.5 kJ·mol-1;
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5 kJ·mol-1;
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1。
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g)ΔH在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中,n(CH4)随反应时间的变化如图所示:

①据图判断该反应的ΔH
②温度为T1时,0~10 min内,NO2的平均反应速率v(NO2)=
③该反应达到平衡后,为提高反应速率同时提高NO2的转化率,可采取的措施有
A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增大CH4的浓度
(3) 利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为NaOH溶液。工作一段时间后,该电池正极附近溶液的pH
(4)氮的一种氢化物为HN3,其水溶液酸性强弱与醋酸相似,25℃时,将a mol·L-1HN3与b mol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N
 ),则该混合溶液呈
),则该混合溶液呈
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】镍是一种银白色金属,被用来制造不锈钢、高镍合金钢和合金结构钢,广泛用于飞机、坦克、雷达等各种军工制造业。工业上以一种富镍矿石(主要含有NiS,还含有Cu、Si、Fe、Mg、Ca等元素)中提取镍的工艺流程如图所示。

查阅资料:室温下,氢氧化物沉淀的pH如下表所示:
回答下列问题:
(1)煅烧前要将矿石粉碎过筛,能够达到同样目的的措施还有_______ (任写两条),酸浸后得到的滤渣主要成分有_______ 、_______ (填化学式)。
(2)写出NiS在空气中煅烧的反应化学方程式:_______ 。
(3)“沉镍”时需保持pH不低于_______ ,此时溶液中 的最大值为
的最大值为_______ mol/L。
(4)若采用惰性电极电解硫酸镍溶液制镍,阳极产物是_______ 。

查阅资料:室温下,氢氧化物沉淀的pH如下表所示:
| 沉淀物 |  |  |  |  |
| 开始沉淀时(0.01mol/L)的pH | 2.2 | 9.4 | 6.3 | 7.2 |
沉淀完全时(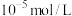 )的pH )的pH | 3.2 | 12.4 | 8.3 | 9.2 |
(1)煅烧前要将矿石粉碎过筛,能够达到同样目的的措施还有
(2)写出NiS在空气中煅烧的反应化学方程式:
(3)“沉镍”时需保持pH不低于
 的最大值为
的最大值为(4)若采用惰性电极电解硫酸镍溶液制镍,阳极产物是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】科学家对航天员在空间站中产生的 循环利用的探索取得诸多成果。按要求回答下列有关问题:
循环利用的探索取得诸多成果。按要求回答下列有关问题:
(1)将航天员呼出的 进行
进行 化反应,完成空间站中
化反应,完成空间站中 和
和 的循环利用。
的循环利用。 分子的空间结构相同的一种阳离子:
分子的空间结构相同的一种阳离子:_______ 。
②标准生成焓(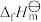 )是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的
)是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的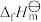 。
。
完善反应器中进行的如下反应即Sabatier反应的热化学方程式:_______ 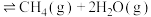

_____ 。
③图中 来自于电解水装置的
来自于电解水装置的_____ (填“阳极产物”或“阴极产物”)
④在恒温密闭刚性反应器中增大Sabatier反应中 的反应速率可行的措施有
的反应速率可行的措施有_______ 。写出一项说明该反应已达到化学平衡的标志:________ 。
⑤写出碱性燃料电池中负极反应式:_______ 。
(2)将航天员呼出的 回收,可利用Bosch反应即
回收,可利用Bosch反应即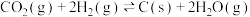 替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol
替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol 和1mol
和1mol 发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。
发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。______ 。
②已知 为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中
为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中 的转化率=
的转化率=______ ;
_______ (写算式,不化简 )。
③加入催化剂(其他条件相同)此反应达平衡时 分压为
分压为_______ 。
 循环利用的探索取得诸多成果。按要求回答下列有关问题:
循环利用的探索取得诸多成果。按要求回答下列有关问题:(1)将航天员呼出的
 进行
进行 化反应,完成空间站中
化反应,完成空间站中 和
和 的循环利用。
的循环利用。
 分子的空间结构相同的一种阳离子:
分子的空间结构相同的一种阳离子:②标准生成焓(
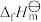 )是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的
)是指在特定温度下由稳定态单质生成1mol化合物的焓变。表中为几种物质在25℃时的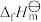 。
。| 物质 |  |  |  |  |
 | a | b | c | 0 |
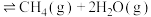

③图中
 来自于电解水装置的
来自于电解水装置的④在恒温密闭刚性反应器中增大Sabatier反应中
 的反应速率可行的措施有
的反应速率可行的措施有⑤写出碱性燃料电池中负极反应式:
(2)将航天员呼出的
 回收,可利用Bosch反应即
回收,可利用Bosch反应即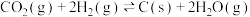 替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol
替换Sabatier反应。在T℃时,向容积为2L的密闭刚性反应器中通入3mol 和1mol
和1mol 发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。
发生Bosch反应,平衡时恢复至T℃。测得容器内气压变化如图所示。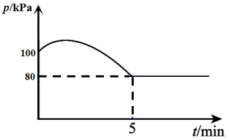
②已知
 为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中
为用各组分气体的分压表示的平衡常数,气体分压=气体的体积分数×体系总压。T℃下,Bosch反应中 的转化率=
的转化率=
③加入催化剂(其他条件相同)此反应达平衡时
 分压为
分压为
您最近一年使用:0次
【推荐3】 的资源化利用是实现我国“双碳”目标的有效途径之一
的资源化利用是实现我国“双碳”目标的有效途径之一
(1)杭州第19届亚洲运动会开幕式主火炬创新使用“零碳”甲醇燃料,综合利用焦炉气中的 与工业尾气中
与工业尾气中 合成绿色甲醇,实现了循环内零碳排放。
合成绿色甲醇,实现了循环内零碳排放。
①制备甲醇的主反应: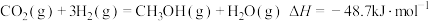 该过程中还存在一个生成
该过程中还存在一个生成 的副反应,结合反应:
的副反应,结合反应:
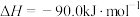 写出该副反应的热化学方程式:
写出该副反应的热化学方程式:___________ 。
②将 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放 催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
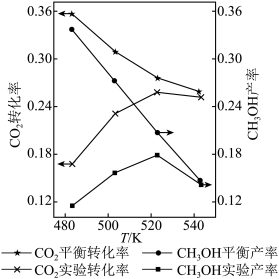
已知:CH3OH产率=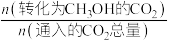
i.催化剂活性最好的温度为___________ 。(填字母序号)
a. 483 K b. 503 K c. 523 K d. 543 K
ii.温度升高时 的平衡转化率降低,解释原因:
的平衡转化率降低,解释原因:___________ 。
iii.温度由 升到543K,CH3OH的实验产率降低,解释原因:
升到543K,CH3OH的实验产率降低,解释原因:___________ 。
(2)近年研究发现,电催化 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含食废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含食废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。

①电极b是电解池的___________ 极。
②电解过程中生成尿素的电极反应式是___________ 。
 的资源化利用是实现我国“双碳”目标的有效途径之一
的资源化利用是实现我国“双碳”目标的有效途径之一(1)杭州第19届亚洲运动会开幕式主火炬创新使用“零碳”甲醇燃料,综合利用焦炉气中的
 与工业尾气中
与工业尾气中 合成绿色甲醇,实现了循环内零碳排放。
合成绿色甲醇,实现了循环内零碳排放。①制备甲醇的主反应:
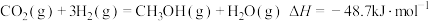 该过程中还存在一个生成
该过程中还存在一个生成 的副反应,结合反应:
的副反应,结合反应:
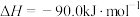 写出该副反应的热化学方程式:
写出该副反应的热化学方程式:②将
 和
和 按物质的量比
按物质的量比 混合,以固定流速通过盛放
混合,以固定流速通过盛放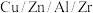 催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
催化剂的反应器,在相同时间内,不同温度下的实验数据如图所示。
已知:CH3OH产率=
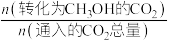
i.催化剂活性最好的温度为
a. 483 K b. 503 K c. 523 K d. 543 K
ii.温度升高时
 的平衡转化率降低,解释原因:
的平衡转化率降低,解释原因:iii.温度由
 升到543K,CH3OH的实验产率降低,解释原因:
升到543K,CH3OH的实验产率降低,解释原因:(2)近年研究发现,电催化
 和含氮物质(
和含氮物质( 等)在常温常压下合成尿素,有助于实现碳中和及解决含食废水污染问题。向一定浓度的
等)在常温常压下合成尿素,有助于实现碳中和及解决含食废水污染问题。向一定浓度的 溶液通
溶液通 至饱和,在电极上反应生成
至饱和,在电极上反应生成 ,电解原理如图所示。
,电解原理如图所示。
①电极b是电解池的
②电解过程中生成尿素的电极反应式是
您最近一年使用:0次



