反应物和生成物均为气态的平衡体系,平衡常数表达式为:K= 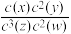 ,有关该平衡体系说法
,有关该平衡体系说法不正确 的是
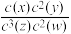 ,有关该平衡体系说法
,有关该平衡体系说法| A.升温温度,该反应平衡常数K一定发生改变 |
| B.增大压强,w的质量分数减小 |
C.该反应的化学方程式为:3z(g)+2w(g)  x(g)+2y(g) x(g)+2y(g) |
| D.增大x气体浓度平衡向正反应方向移动 |
更新时间:2017-10-17 14:36:34
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g) 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
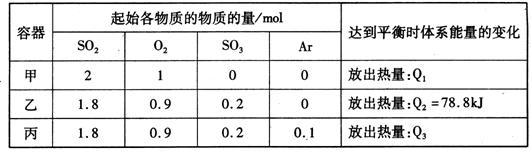
下列叙述正确的是
2SO2(g)+O2(g)
 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是
| A.Q1>Q3>Q2=78.8kJ |
| B.三个容器中反应的平衡常数均为K=2 |
| C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% |
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=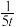 mol/(L·min) mol/(L·min) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】在恒温恒压下,向密闭容器中充入4molSO2和2molO2,发生如下反应:2SO2(g)+O2(g)  2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是
 2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是
2SO3(g) ΔH<0,2min后,反应达到平衡,生成SO3为1.4mol,同时放出热量QkJ。则下列分析正确的是| A.若把条件“恒温恒压”改为“恒温恒容”,则平衡时放出热量小于QkJ |
| B.2min后,向容器中再通入一定量的SO3气体,重新达到平衡时,SO2的含量变小 |
| C.若把条件“恒温恒压”改为“恒压绝热”,则平衡后n(SO3)大于1.4mol |
| D.若反应开始时容器体积为2L,则v(SO3)=0.7mol·L-1·min-1 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(s)
2CO2(g)+S(s)
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
SO2(g)+2CO(g)
 2CO2(g)+S(s)
2CO2(g)+S(s)若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
| A.平衡前,随着反应的进行,容器内压强始终不变 |
| B.平衡时,其他条件不变,分离出硫,正反应速率加快 |
| C.平衡时,若升高温度,CO体积分数增大,则该反应的△H>0 |
| D.其他条件不变,增大压强,该反应平衡常数不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】实验室常用 (铁氰化钾)检验
(铁氰化钾)检验 。一种制备铁氰化钾的流程如下:
。一种制备铁氰化钾的流程如下:
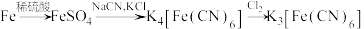
已知:

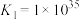
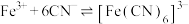
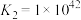
下列叙述错误的是
 (铁氰化钾)检验
(铁氰化钾)检验 。一种制备铁氰化钾的流程如下:
。一种制备铁氰化钾的流程如下: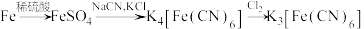
已知:

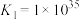
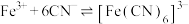
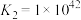
下列叙述错误的是
A.NaCN中 健和 健和 键数之比为1∶2 键数之比为1∶2 | B. 中 中 轨道和 轨道和 轨道以“头对头”重叠成键 轨道以“头对头”重叠成键 |
C. 中 中 的配位数为6 的配位数为6 | D.稳定性: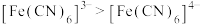 |
您最近一年使用:0次

 (g)
(g) (g)
(g)  。将3mol双环戊二烯通入恒温、恒容密闭容器中,分别在
。将3mol双环戊二烯通入恒温、恒容密闭容器中,分别在 和
和 温度下进行反应,起始压强分别为
温度下进行反应,起始压强分别为 和
和 ,n(双环戊二烯)、n(环戊二烯)随时间t的变化关系如图所示。下列说法错误的是
,n(双环戊二烯)、n(环戊二烯)随时间t的变化关系如图所示。下列说法错误的是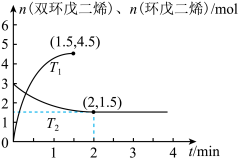


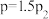 时
时
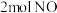 和
和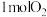 通入恒容密闭容器中进行反应,容器中发生两个反应
通入恒容密闭容器中进行反应,容器中发生两个反应 和
和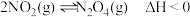 。在不同温度下,测得平衡时体系中
。在不同温度下,测得平衡时体系中 的物质的量与温度的关系如图所示。下列说法正确的是
的物质的量与温度的关系如图所示。下列说法正确的是
 的物质的量与温度的关系
的物质的量与温度的关系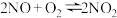 的平衡常数
的平衡常数 (x点)
(x点)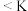 (y点)
(y点)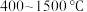 时,随着温度升高,
时,随着温度升高, 的体积分数不断增大
的体积分数不断增大

