(1)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。
①三种溶液pH由大到小的顺序为:__________________ 填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)____ c(CO32-) (填“>”、“<”或“=”)。
(2)已知25℃时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是________ 。 (填写序号);b中氯离子的浓度为_______ mol/L。
①三种溶液pH由大到小的顺序为:
②溶液a的pH大于8,则溶液中c(H2CO3)
(2)已知25℃时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是
更新时间:2018/02/07 17:34:57
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】二氧化钛(TiO2)是一种重要的工业原料,可用四氯化钛(TiCl4)制备。已知:
Ⅰ.TiCl4(g)+O2(g) TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
Ⅱ.2C(s)+O2(g) 2CO(g) ΔH2=-219.9 kJ•mol -1
2CO(g) ΔH2=-219.9 kJ•mol -1
请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成 TiO2(s)、C(s)和氯气的热化学方程式为___________ 。
(2)若反应Ⅰ的逆反应活化能表示为 E kJ•mol -1,则 E___________ 178.4(填“>”“<”或 “=”)。
(3)t℃时,向10 L恒容密闭容器中充入1 mol TiCl4和2 mol O2,发生反应Ⅰ.4 min 达到平衡时测得 TiO2 的物质的量为 0.2 mol。
①0~4 min 内,用 Cl2 表示的反应速率 v(Cl2)=___________ 。
②TiCl4的平衡转化率 α=___________ 。
③下列措施,既能加快反应速率又能增大TiCl4平衡转化率的是___________ (填选项字母)。
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大 O2 浓度 E.降低温度
④ t℃时,向10 L恒容密闭容器中充入4 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比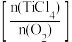 的关系如图所示:
的关系如图所示:
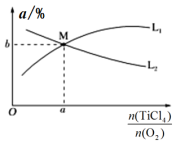
能表示TiCl4平衡转化率的曲线为___________ (填“L1”或 “L2”);M 点的坐标为___________ 。
(4)也可以利用四氯化钛(TiCl4)水解制备TiO2,该反应的方程式为:___________ 。
Ⅰ.TiCl4(g)+O2(g)
 TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1
TiO2(s)+2Cl2(g) ΔH1=-178.4 kJ•mol-1Ⅱ.2C(s)+O2(g)
 2CO(g) ΔH2=-219.9 kJ•mol -1
2CO(g) ΔH2=-219.9 kJ•mol -1请回答下列问题:
(1)TiCl4(g)与CO(g)反应生成 TiO2(s)、C(s)和氯气的热化学方程式为
(2)若反应Ⅰ的逆反应活化能表示为 E kJ•mol -1,则 E
(3)t℃时,向10 L恒容密闭容器中充入1 mol TiCl4和2 mol O2,发生反应Ⅰ.4 min 达到平衡时测得 TiO2 的物质的量为 0.2 mol。
①0~4 min 内,用 Cl2 表示的反应速率 v(Cl2)=
②TiCl4的平衡转化率 α=
③下列措施,既能加快反应速率又能增大TiCl4平衡转化率的是
A.缩小容器容积 B.加入催化剂 C.分离出部分TiO2 D.增大 O2 浓度 E.降低温度
④ t℃时,向10 L恒容密闭容器中充入4 mol TiCl4和一定量O2的混合气体,发生反应Ⅰ,两种气体的平衡转化率(α)与起始的物质的量之比
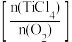 的关系如图所示:
的关系如图所示:
能表示TiCl4平衡转化率的曲线为
(4)也可以利用四氯化钛(TiCl4)水解制备TiO2,该反应的方程式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】回答下列问题:
(1)农业常用的三类化肥有①草木灰②Ca(H2PO4)2③NH4NO3,其中能混合施用的是___ (填序号)。
(2)现有浓度均为0.1mol/L的几种溶液:①NH3·H2O②NH4Cl③CH3COONH4④(NH4)2CO3⑤(NH4)2SO4⑥(NH4)2Fe(SO4)2,以上溶液中c(NH )由大到小的顺序
)由大到小的顺序___ (填序号)。
(3)已知CH3COONH4溶液显中性,若K(CH3COOH)>K(HA),则NH4A显___ 性(填“酸”“碱”或“中”)。
(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COOH-),则该混合溶液中醋酸的电离常数Ka=___ (用含a和b的代数式表示)。
(5)SOCl2遇水能剧烈水解反应,生成能使品红溶液褪色的SO2,并有白雾形成。将SOCl2与AlCl3·6H2O混合加热可以得到无水AlCl3,用化学方程式及简单文字说明原因___ 。
(1)农业常用的三类化肥有①草木灰②Ca(H2PO4)2③NH4NO3,其中能混合施用的是
(2)现有浓度均为0.1mol/L的几种溶液:①NH3·H2O②NH4Cl③CH3COONH4④(NH4)2CO3⑤(NH4)2SO4⑥(NH4)2Fe(SO4)2,以上溶液中c(NH
 )由大到小的顺序
)由大到小的顺序(3)已知CH3COONH4溶液显中性,若K(CH3COOH)>K(HA),则NH4A显
(4)常温下,将amol·L-1的醋酸与bmol·L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COOH-),则该混合溶液中醋酸的电离常数Ka=
(5)SOCl2遇水能剧烈水解反应,生成能使品红溶液褪色的SO2,并有白雾形成。将SOCl2与AlCl3·6H2O混合加热可以得到无水AlCl3,用化学方程式及简单文字说明原因
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】已知Ka、Kb、Kw、Kh、Ksp分别表示弱酸的电离平衡常数、弱碱的电离平衡常数,水的离子积常数、盐的水解平衡常数、难溶电解质的溶度积常数。通过查阅资料获得温度为25℃时以下数据:Kw=1.0×10-14,Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13,Ka(HF)=4.0×10-4,Ksp[Mg(OH)2]=1.8×10-11
(1)有关上述常数的说法正确的是_______ 。
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka•Kh
(2)25℃时,1.0mol•L-1HF溶液的pH约等于_______ (已知lg2≈0.3)。将浓度相等的HF与NaF溶液等体积混合,判断溶液呈______ (填“酸”、“碱”或“中”)性,
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:
A.NH4Cl B.NH4SCN C.CH3COONH4 D.NH4HCO3
回答下列问题:
①试推断NH4HCO3溶液的pH_______ 7(填“>”、“<”或“=”)。
②将四种溶液按 浓度由大到小的顺序排列是
浓度由大到小的顺序排列是__________ (填序号)。
③NH4SCN溶液中所有离子浓度由大到小的顺序为_________ 。
(1)有关上述常数的说法正确的是
a.它们都能反映一定条件下对应变化进行的程度
b.所有弱电解质的电离常数和难溶电解质的Ksp都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
d.一定温度下,在CH3COONa溶液中,Kw=Ka•Kh
(2)25℃时,1.0mol•L-1HF溶液的pH约等于
(3)已知CH3COONH4溶液为中性,又知CH3COOH溶液加到Na2CO3溶液中有气体放出,现有25℃时等浓度的四种溶液:
A.NH4Cl B.NH4SCN C.CH3COONH4 D.NH4HCO3
回答下列问题:
①试推断NH4HCO3溶液的pH
②将四种溶液按
 浓度由大到小的顺序排列是
浓度由大到小的顺序排列是③NH4SCN溶液中所有离子浓度由大到小的顺序为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现有25℃,0.1mol·L-1的以下溶液:A.NaOH B.NH4Cl C.Al2(SO4)3 D.Na2CO3 E.NaHSO4 F.NaHCO3
(1)A、B、D、F四种溶液的pH由大到小的顺序是_____________ 。(填编号)
(2)常温下,溶液E的pH_______ 7(填“>”、“<”、“=”),其原因是___________ 。(用电离方程式表示)
(3)泡沫灭火器原料是C与F两溶液,其反应原理的离子方程式为______________ 。
(1)A、B、D、F四种溶液的pH由大到小的顺序是
(2)常温下,溶液E的pH
(3)泡沫灭火器原料是C与F两溶液,其反应原理的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】25 ℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=____________________
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序________________________
(3)H2C2O4与少量的KOH溶液反应的化学方程式:_______________________
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:_______________________
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是__________ (填写序号)。
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余
| 化学式 | CH3COOH | H2C2O4 | H2S |
| 电离平衡常数 | 1.8×10-5 | Ka1=5.4×10-2 Ka2=5.4×10-5 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
请回答下列问题:
(1)H2S的一级电离常数表达式为Ka1=
(2)CH3COOH、H2C2O4、H2S的酸性由强到弱的顺序
(3)H2C2O4与少量的KOH溶液反应的化学方程式:
(4)NaHS溶液与NaHC2O4溶液反应的离子方程式:
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤B中有锌剩余
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知硼酸为一元酸:H3BO3+H2O [B(OH)4]-+H+。常温下,三种酸的电离平衡常数数值如下表:
[B(OH)4]-+H+。常温下,三种酸的电离平衡常数数值如下表:
(1)某小组利用如图装置探究醋酸、碳酸、硼酸的酸性相对强弱,两支试管分别盛有相同浓度的醋酸溶液和硼酸溶液各2 mL。实验时,向试管A和试管B中分别滴加相同浓度与体积的___________ 溶液(填化学式),可观察到的现象是___________ ;A试管中发生反应的离子方程式为___________ 。

(2)由上表判断H3BO3与Na2CO3溶液能否发生反应___________ (填“能”或“不能”)。
(3)浓度相同的①Na2CO3、②Na[B(OH)4]、③CH3COONa三种溶液的pH由小到大的顺序为_______ (填编号)。
(4)计算可知碳酸氢根离子水解常数Kh 数量级为10的_____ 次方,NaHCO3溶液显________ (填“酸性”“碱性”或“中性”)。
 [B(OH)4]-+H+。常温下,三种酸的电离平衡常数数值如下表:
[B(OH)4]-+H+。常温下,三种酸的电离平衡常数数值如下表:| CH3COOH | H3BO3 | H2CO3 | |
| Ka | Ka | Ka1 | Ka2 |
| 1.8×10-5 | 5.8×10-10 | 4.4×10-7 | 4.7×10-11 |
(1)某小组利用如图装置探究醋酸、碳酸、硼酸的酸性相对强弱,两支试管分别盛有相同浓度的醋酸溶液和硼酸溶液各2 mL。实验时,向试管A和试管B中分别滴加相同浓度与体积的

(2)由上表判断H3BO3与Na2CO3溶液能否发生反应
(3)浓度相同的①Na2CO3、②Na[B(OH)4]、③CH3COONa三种溶液的pH由小到大的顺序为
(4)计算可知碳酸氢根离子水解常数Kh 数量级为10的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】按要求完成下列问题。
(1)25°C时,pH试纸测得0.1 mol/L醋酸溶液的pH约为3,则估算出醋酸的电离常数约为___________ ; 向10 mL此溶液中加水稀释的 值将
值将___________ (填“增大”、“减小”或“无法确定”)
(2)常温下,已知H2A为二元弱酸,溶液M由20 mLl mol·L-1NaHA溶液与20 mL 1mol·L-1NaOH溶液等体积混合而得,则溶液M的pH___________ 7(填“>”“<”或“=”), 溶液M中各微粒的浓度关系正确的是___________ 。
A. c(A2-)+c(HA-)+c(OH-)=c(Na+ )+c(H+)
B. c(HA-)+c(H2A)+c(H+)=c(OH-)
C. c(A2-)+c(HA-)+c(H2A)=lmol·L-l
D. c(Na+)> c(A2-)> c(OH-)>c(H+)
(1)25°C时,pH试纸测得0.1 mol/L醋酸溶液的pH约为3,则估算出醋酸的电离常数约为
 值将
值将(2)常温下,已知H2A为二元弱酸,溶液M由20 mLl mol·L-1NaHA溶液与20 mL 1mol·L-1NaOH溶液等体积混合而得,则溶液M的pH
A. c(A2-)+c(HA-)+c(OH-)=c(Na+ )+c(H+)
B. c(HA-)+c(H2A)+c(H+)=c(OH-)
C. c(A2-)+c(HA-)+c(H2A)=lmol·L-l
D. c(Na+)> c(A2-)> c(OH-)>c(H+)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】常温下,浓度均为0.2 的A、B、C、D四种溶液,分别是
的A、B、C、D四种溶液,分别是 溶液、
溶液、 溶液、
溶液、 溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[
溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[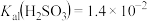 ,
,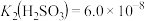 ,
, ,
,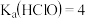
 ,
,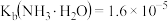 ,
, ]。回答下列问题:
]。回答下列问题:
(1)A溶液的溶质为_______ (填化学式),其电离平衡常数表达式为_______ 。
(2)常温下,将上述B和C两种溶液等体积混合(忽略溶液混合后的体积变化):
①写出B和C发生反应的离子方程式:_______ 。
②充分反应后,所得溶液中微粒有_______ 种,其中
_______ 。
(3)常温下,将上述C和D溶液分别加水稀释:
①若要达到相同的pH,C溶液所加水的体积_______ (填“大于”、“小于”或“等于”)D溶液所水的体积。
②若D溶液加水稀释至原溶液体积的200倍,此时D溶液的pH=_______ 。
(4)常温下,将上述A和D两种溶液等体积混合,溶液混合后各离子浓度由大到小的关系为_______ 。
 的A、B、C、D四种溶液,分别是
的A、B、C、D四种溶液,分别是 溶液、
溶液、 溶液、
溶液、 溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[
溶液和HClO溶液中的一种,它们的pH由大到小的顺序是A>B>C>D[已知常温下[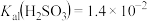 ,
,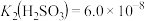 ,
, ,
,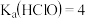
 ,
,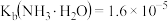 ,
, ]。回答下列问题:
]。回答下列问题:(1)A溶液的溶质为
(2)常温下,将上述B和C两种溶液等体积混合(忽略溶液混合后的体积变化):
①写出B和C发生反应的离子方程式:
②充分反应后,所得溶液中微粒有

(3)常温下,将上述C和D溶液分别加水稀释:
①若要达到相同的pH,C溶液所加水的体积
②若D溶液加水稀释至原溶液体积的200倍,此时D溶液的pH=
(4)常温下,将上述A和D两种溶液等体积混合,溶液混合后各离子浓度由大到小的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】氢氧化钠溶液处理铝土矿井过滤,得到含铝酸钠的溶液。向该溶液中通入二氯化碳,有下列反应:2Na[Al(OH)4]+CO2→2Al(OH)3↓+Na2CO3+H2O。
(1)上述五种物质中沸点最低物质的结构式为______ ,由上述物质中的两种元素按原子个数比1:1形成的离子化合物的电子式为______ (写一例)。
(2)请将Na、Al、O的原子半径和简单离子的半径分别按由小到大的顺序排列:______ (用元素符号表示),______ (用离子符号表示)。
(3)①在上述混合物的组成元素中,与铝元素同周期的另一元素的原子共有______ 种不同能级的电子,该元素的最高价氧化物对应水合物与铝单质反应的离子反应方程式为______ 。
②已知AlN的熔点2200℃,AlCl3的熔点194℃,二者常温下均为固体,其熔点差异较大的原因是______ 。
(4)NaHCO3溶液中各含碳微粒按浓度由大到小的顺序排列______ 。
(1)上述五种物质中沸点最低物质的结构式为
(2)请将Na、Al、O的原子半径和简单离子的半径分别按由小到大的顺序排列:
(3)①在上述混合物的组成元素中,与铝元素同周期的另一元素的原子共有
②已知AlN的熔点2200℃,AlCl3的熔点194℃,二者常温下均为固体,其熔点差异较大的原因是
(4)NaHCO3溶液中各含碳微粒按浓度由大到小的顺序排列
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】写出下列盐的三大守恒:
(1)Na2C2O4溶液中,1电荷守恒___________ 。2物料守恒___________ 。3质子守恒___________ 。
(2)Na2CO3溶液中,1电荷守恒___________ 。2物料守恒___________ 。3质子守恒___________ 。
(3)将足量的AgCl(s)分别添加到下述四种溶液中,所得溶液c(Ag+)由大到小的顺序是___________ 。
A.10 mL 0.4mol•L-1的盐酸 B.10 mL 0.3mol•L-1 MgCl2溶液
C.10 mL 0.5mol•L-1 NaCl溶液 D.10 mL 0.1mol•L-1 AlCl3溶液
(1)Na2C2O4溶液中,1电荷守恒
(2)Na2CO3溶液中,1电荷守恒
(3)将足量的AgCl(s)分别添加到下述四种溶液中,所得溶液c(Ag+)由大到小的顺序是
A.10 mL 0.4mol•L-1的盐酸 B.10 mL 0.3mol•L-1 MgCl2溶液
C.10 mL 0.5mol•L-1 NaCl溶液 D.10 mL 0.1mol•L-1 AlCl3溶液
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】请回答下列问题(25 ℃时):
⑴若向0.1 mol·L-1氨水中加入少量硫酸铵固体,此时溶液中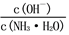
________ (填“增大”、“减小”或“不变”)。
⑵若向0.1 mol·L-1氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:_______________________________ ;所得溶液的pH______ 7(填“>”、“<”或“=”),用离子方程式表示其原因_____________________________________ 。
⑶若向0.1 mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH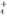 )=a mol·L-1,则c(SO
)=a mol·L-1,则c(SO )为
)为__________________ 。
⑷若向0.1 mol·L-1氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是____________________________ 。
⑸将足量的AgCl固体分别放入:①5 mL水,②10 mL 0.2 mol·L-1 MgCl2溶液,③20 mL 0.5 mol·L-1 NaCl溶液,④40 mL 0.1 mol·L-1盐酸中溶解至溶液饱和,各溶液中Ag+的物质的量浓度分别为a、b、c、d,它们由大到小的排列顺序是____________________ 。
⑴若向0.1 mol·L-1氨水中加入少量硫酸铵固体,此时溶液中
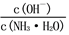
⑵若向0.1 mol·L-1氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:
⑶若向0.1 mol·L-1氨水中加入稀硫酸至溶液的pH=7,此时c(NH
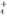 )=a mol·L-1,则c(SO
)=a mol·L-1,则c(SO )为
)为⑷若向0.1 mol·L-1氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是
⑸将足量的AgCl固体分别放入:①5 mL水,②10 mL 0.2 mol·L-1 MgCl2溶液,③20 mL 0.5 mol·L-1 NaCl溶液,④40 mL 0.1 mol·L-1盐酸中溶解至溶液饱和,各溶液中Ag+的物质的量浓度分别为a、b、c、d,它们由大到小的排列顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】沉淀溶解平衡
(1)概念
在一定温度下,当沉淀和溶解的速率_______________ 时,形成_______________ ,达到平衡状态,把这种平衡称为沉淀溶解平衡.
(2)沉淀溶解平衡的影响因素
(1)概念
在一定温度下,当沉淀和溶解的速率
(2)沉淀溶解平衡的影响因素
| 内因 | 难溶电解质 | |
| 外因 | 温度 | 升温,大多数溶解平衡向 |
| 浓度 | 加水稀释,平衡向 | |
| 相同离子 | 加入与难溶电解质含有相同离子的物质,平衡向 | |
| 反应离子 | 加入能消耗难溶电解质中所含离子的物质,平衡向 | |
您最近一年使用:0次



