Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为________ ;
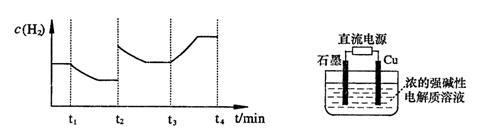
②一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
2H2O(g)=2H2(g)+O2(g)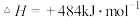 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=_________________ ;该温度下,反应的平衡常数表达式K=_________________ ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为______ ,t2时改变的条件可能为______________ ;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为________________ ;
(2)已知: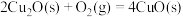 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1
 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式________ ;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为________ 。
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为

②一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
2H2O(g)=2H2(g)+O2(g)
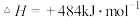 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)=(2)已知:
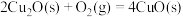 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为
2011·江西赣州·一模 查看更多[1]
(已下线)2011届江西省赣县中学高三适应性考试(理科)化学部分
更新时间:2011-05-30 15:18:13
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】生产钡盐的主要原料是重晶石(BaSO4)。在高温下,重晶石与石墨存在如下反应:
①: BaSO4(s)+4C(s,石墨) 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
②: BaSO4(s)+4CO(g) 4CO2(g)+BaS(s) ΔH2=-118.8 kJ/mol
4CO2(g)+BaS(s) ΔH2=-118.8 kJ/mol
回答下列问题:
(1)反应①在一定条件下能够自发的原因:_______________ ;
(2)已知:C(s,石墨)+O2(g)=CO2(g) ΔH3=-393.5 kJ/mol;
求CO的标准燃烧热ΔH4=_______ kJ/mol;
(3)图1为1200K下,恒容密闭容器中重晶石与石墨反应时,c(CO)随时间变化曲线图。 请分析图1曲线c(CO)在0-t2区间变化的原因:_________________ ;

(4)图2为实验测得不同温度下,反应体系中初始浓度比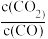 与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有
与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有________ ;
A.提高BaSO4 的投料量,可提高BaS的产率
B.恒温恒容时,当混合气体的密度不变,反应①、②均达到化学平衡状态
C.减小初始浓度比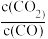 ,有利于增大BaSO4的转化率
,有利于增大BaSO4的转化率
D.适当升高温度,反应②的平衡左移,对生成BaS不利
(5)图1中,t2 时刻将容器体积减小为一半,t3时刻达到新的平衡,请在图1中画出t2-t3区间c(CO)的变化曲线________________ 。
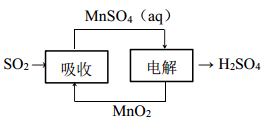
(6)工业生产中产生的SO2 废气可用如图方法获得H2SO4。写出电解的阳极反应式_________ 。
①: BaSO4(s)+4C(s,石墨)
 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol②: BaSO4(s)+4CO(g)
 4CO2(g)+BaS(s) ΔH2=-118.8 kJ/mol
4CO2(g)+BaS(s) ΔH2=-118.8 kJ/mol回答下列问题:
(1)反应①在一定条件下能够自发的原因:
(2)已知:C(s,石墨)+O2(g)=CO2(g) ΔH3=-393.5 kJ/mol;
求CO的标准燃烧热ΔH4=
(3)图1为1200K下,恒容密闭容器中重晶石与石墨反应时,c(CO)随时间变化曲线图。 请分析图1曲线c(CO)在0-t2区间变化的原因:

(4)图2为实验测得不同温度下,反应体系中初始浓度比
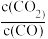 与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有
与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有A.提高BaSO4 的投料量,可提高BaS的产率
B.恒温恒容时,当混合气体的密度不变,反应①、②均达到化学平衡状态
C.减小初始浓度比
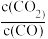 ,有利于增大BaSO4的转化率
,有利于增大BaSO4的转化率D.适当升高温度,反应②的平衡左移,对生成BaS不利
(5)图1中,t2 时刻将容器体积减小为一半,t3时刻达到新的平衡,请在图1中画出t2-t3区间c(CO)的变化曲线
(6)工业生产中产生的SO2 废气可用如图方法获得H2SO4。写出电解的阳极反应式

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。
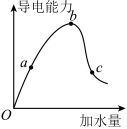
(1)“O”点为什么不导电___________________ 。
(2)a、b、c三点的氢离子浓度由小到大的顺序为____________ 。
(3)a、b、c三点中,醋酸的电离程度最大的一点是_________ 。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________ 。
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒G.加MgO固体H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是______________ 。
A.c(H+) B.H+个数C.CH3COOH分子数D.c(H+)/c(CH3COOH)

(1)“O”点为什么不导电
(2)a、b、c三点的氢离子浓度由小到大的顺序为
(3)a、b、c三点中,醋酸的电离程度最大的一点是
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水
E.加固体CH3COONa F.加Zn粒G.加MgO固体H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是
A.c(H+) B.H+个数C.CH3COOH分子数D.c(H+)/c(CH3COOH)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】硫化钠广泛应用于染料工业。请完成下列各题:
(1) 的核外电子排布式
的核外电子排布式_______________ ,其核外有_______ 种不同运动状态的电子。写出Na2O的电子式___________ ,比较Na2O和Na2S的熔点高低:Na2O______ Na2S。
(2)O、S属于同主族元素,其单质的氧化性不同,用一反应的化学方程式表示:_____________ ,O、S、 半径从大到小的顺序是
半径从大到小的顺序是_________________ 。
II.1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应: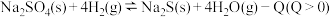 并达到平衡。
并达到平衡。
(1)上述平衡的平衡常数表达式
_____________ 。欲使 值变大,可采取的措施是
值变大,可采取的措施是__________________________ 。平衡后,向容器中充入1mol H2,平衡向__________ (填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率______ (填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)_________ 判断该反应已经达到平衡状态。若初始时加入的Na2SO4为2.84g,10分钟后达到平衡时Na2SO4的转化率为45%,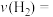
________ 。
(1)
 的核外电子排布式
的核外电子排布式(2)O、S属于同主族元素,其单质的氧化性不同,用一反应的化学方程式表示:
 半径从大到小的顺序是
半径从大到小的顺序是II.1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应:
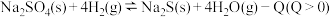 并达到平衡。
并达到平衡。(1)上述平衡的平衡常数表达式

 值变大,可采取的措施是
值变大,可采取的措施是(2)若混合气体的密度不变,(填“能”或“不能”)
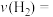
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。下表列出了一些化学键的键能E:
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应为________ (填“吸热”或“放热”)反应,其中ΔH=__________ (用含有a、b的关系式表示)。

(2)若图示中表示反应H2(g)+ O2(g)= H2O(g)ΔH=-241.8kJ·mol-1,则b=
O2(g)= H2O(g)ΔH=-241.8kJ·mol-1,则b=_____ kJ·mol-1,x=________ 。
(3)已知:①Al2O3(s)+3C(s)= 2Al(s)+3CO(g)ΔH1=+1344.1kJ·mol-1
②2AlCl3(g)= 2Al(s)+3Cl2(g)ΔH2=+1169.2kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为__________ 。
| 化学键 | H-H | O=O | O-H |
| E/kJ·mol-1 | 436 | x | 463 |
(1)如图表示某反应的能量变化关系,则此反应为

(2)若图示中表示反应H2(g)+
 O2(g)= H2O(g)ΔH=-241.8kJ·mol-1,则b=
O2(g)= H2O(g)ΔH=-241.8kJ·mol-1,则b=(3)已知:①Al2O3(s)+3C(s)= 2Al(s)+3CO(g)ΔH1=+1344.1kJ·mol-1
②2AlCl3(g)= 2Al(s)+3Cl2(g)ΔH2=+1169.2kJ·mol-1
由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】控制和治理SO2、NOx是减少酸雨和光化学烟雾的有效途径。
(1)烟气脱硫是大气污染防治研究的热点。脱硫过程涉及的反应如下:
SO2(g)+H2O(l)+HClO(aq) H2SO4(aq)+HCl(aq) △H=a kJ•mol-1;
H2SO4(aq)+HCl(aq) △H=a kJ•mol-1;
Ca(ClO)2(aq)+H2SO4(aq) CaSO4(s)+2HClO(aq) △H=b kJ•mol-1。
CaSO4(s)+2HClO(aq) △H=b kJ•mol-1。
则脱硫反应:Ca(ClO)2(aq)+ 2SO2(g) + 2H2O(l) CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=
CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=______ (用含a、b的代数式表示) kJ•mol-1。
(2)100℃时,向一个1 L的恒容密闭容器中充入0.2 mol NO2,发生反应:2NO2(g) N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
①在0~t3时间段内,N2O4的平均反应速率为______ mol•L-1•min-1,NO2的平衡转化率为________ 。
②100℃时,该反应的平衡常数K=____________ 。
(1)烟气脱硫是大气污染防治研究的热点。脱硫过程涉及的反应如下:
SO2(g)+H2O(l)+HClO(aq)
 H2SO4(aq)+HCl(aq) △H=a kJ•mol-1;
H2SO4(aq)+HCl(aq) △H=a kJ•mol-1;Ca(ClO)2(aq)+H2SO4(aq)
 CaSO4(s)+2HClO(aq) △H=b kJ•mol-1。
CaSO4(s)+2HClO(aq) △H=b kJ•mol-1。则脱硫反应:Ca(ClO)2(aq)+ 2SO2(g) + 2H2O(l)
 CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=
CaSO4(s)+ H2SO4(aq) + 2HClO(aq)的△H=(2)100℃时,向一个1 L的恒容密闭容器中充入0.2 mol NO2,发生反应:2NO2(g)
 N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。
N2O4(g) △H<0。测得不同时间时容器中NO2的浓度如下表所示。| 时间/min | 0 | t1 | t2 | t3 | t4 |
| c(NO2)/mol·L-1 | 0.2 | 0.16 | 0.13 | 0.12 | 0.12 |
①在0~t3时间段内,N2O4的平均反应速率为
②100℃时,该反应的平衡常数K=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
从上表可推断,反应①是________ (填“放”或“吸”)热反应。
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3的平衡常数为K3
CO(g)+H2O(g) ΔH=Q3的平衡常数为K3
Ⅰ.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=________ 。根据反应①与②推导出K1、K2、K3的关系式K3=____________ ;可推断反应③是________ (填“放”或“吸”)热反应。
Ⅱ.要使反应③在一定条件下建立的平衡右移,可采取的措施有________ 。
A.缩小容器体积
B.降低温度
C.使用合适的催化剂
D.设法减少CO的量
E.升高温度
 FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH=Q1的平衡常数为K1,反应②Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g) ΔH=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:| 温度(T) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
从上表可推断,反应①是
(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g) ΔH=Q3的平衡常数为K3
CO(g)+H2O(g) ΔH=Q3的平衡常数为K3Ⅰ.根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
Ⅱ.要使反应③在一定条件下建立的平衡右移,可采取的措施有
A.缩小容器体积
B.降低温度
C.使用合适的催化剂
D.设法减少CO的量
E.升高温度
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】根据题给信息,回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图: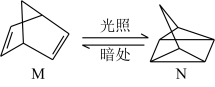
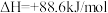 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是_______ (用“M”或“N”)。
(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,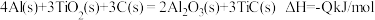 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为_______ kJ。
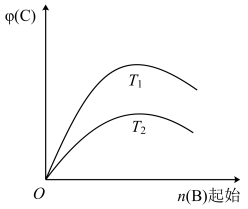
(3)已知反应: ,分析图像(T表示温度,n表示物质的量,
,分析图像(T表示温度,n表示物质的量, 表示体积分数),可知
表示体积分数),可知
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)将 溶液加热蒸干并灼烧,最后得到物质的化学式
溶液加热蒸干并灼烧,最后得到物质的化学式_______ 。
(5)已知 ,常温下要除去废水中的
,常温下要除去废水中的 可以通过调节
可以通过调节 至
至_______ 时,锌离子刚好完全沉淀除去(离子浓度小于 时,即可认为该离子沉淀完全)。
时,即可认为该离子沉淀完全)。
(1)有机物M经过太阳光光照可转化成N,转化过程如图:

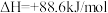 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是(2)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,
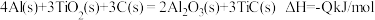 ,则反应过程中,每转移
,则反应过程中,每转移 电子放出的热量为
电子放出的热量为(3)已知反应:
 ,分析图像(T表示温度,n表示物质的量,
,分析图像(T表示温度,n表示物质的量, 表示体积分数),可知
表示体积分数),可知
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(4)将
 溶液加热蒸干并灼烧,最后得到物质的化学式
溶液加热蒸干并灼烧,最后得到物质的化学式(5)已知
 ,常温下要除去废水中的
,常温下要除去废水中的 可以通过调节
可以通过调节 至
至 时,即可认为该离子沉淀完全)。
时,即可认为该离子沉淀完全)。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】以 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
I.

II.
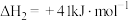
III.

回答下列问题:
(1)在 下,按照
下,按照 投料,假设只发生反应I和II,平衡时,
投料,假设只发生反应I和II,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图: 的曲线为
的曲线为___________ (填“m”或“n”)。
②解释 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因___________ 。
③下列说法正确的是___________ (填字母)。
A.温度越高,越有利于工业生产
B.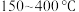 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大
C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:I.


II.

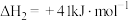
III.


回答下列问题:
(1)在
 下,按照
下,按照 投料,假设只发生反应I和II,平衡时,
投料,假设只发生反应I和II,平衡时, 和
和 在含碳产物物质的量分数及
在含碳产物物质的量分数及 的转化率随温度的变化如图:
的转化率随温度的变化如图:
 的曲线为
的曲线为②解释
 范围内
范围内 转化率随温度升高而降低的原因
转化率随温度升高而降低的原因③下列说法正确的是
A.温度越高,越有利于工业生产

B.
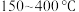 范围内,温度升高,
范围内,温度升高, 的平衡产量先减小后增大
的平衡产量先减小后增大C.随着温度逐渐升高,混合气体的平均相对分子质量几乎又变回起始的状态
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】尿素(H2NCONH2)是一种非常重要的高氮化肥,氨基甲酸铵(NH2COONH4)是尿素合成过程的中间体,某研究小组在实验室进行氨基甲酸铵分解反应平衡常数和分解反应速率的测定。
(1)工业上合成尿素的反应:2NH3(g)+CO2(g) H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
①上述可逆反应的逆反应为_______ (填“放热”或“吸热”)反应
②下列措施中有利于提高尿素产率的是_______ (填字母)。
A.采用高压 B.采用高温 C.寻找更高效的催化剂
(2)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g) ΔH。
2NH3(g)+CO2(g) ΔH。
实验测得不同温度下的平衡数据列于下表:
①ΔH_______ (填“>”或“<”)
②根据表中数据,计算25.0℃时氨基甲酸铵分解反应的平衡常数K=_______ (mol·L-1)3。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下分解应达到平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加“减少”或“不变”)。
(1)工业上合成尿素的反应:2NH3(g)+CO2(g)
 H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1①上述可逆反应的逆反应为
②下列措施中有利于提高尿素产率的是
A.采用高压 B.采用高温 C.寻找更高效的催化剂
(2)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g) ΔH。
2NH3(g)+CO2(g) ΔH。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/(mol/L) | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
②根据表中数据,计算25.0℃时氨基甲酸铵分解反应的平衡常数K=
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下分解应达到平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g) CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
(1)K的表达式为:___ ;
(2)该反应的正反应为__ 反应(“吸热”或“放热”);
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
此时上述的反应中正、逆反应速率的关系式是__ (填代号)。
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率___ (“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其原因___ 。
 CO(g) +H2O(g)其平衡常数K和温度t的关系如下:
CO(g) +H2O(g)其平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:
(2)该反应的正反应为
(3)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是
A.υ(正)>υ(逆) B.υ(正)<υ(逆) C.υ(正)=υ(逆) D.无法判断
(4)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知化学反应①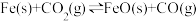 ,其平衡常数为K1;
,其平衡常数为K1;
化学反应② ,其平衡常数为K2。
,其平衡常数为K2。
在温度973 K和1173 K情况下, K1、K2的值分别如下:
(1)通过表格中的数值可以推断:①反应是___________ (填“吸热”或“放热”)反应。
(2)现有反应③ ,请你写出该反应的平衡常数K3的表达式:K3=
,请你写出该反应的平衡常数K3的表达式:K3=___________ 。
(3)根据反应①与②可推导出K3, K1、K2与K3之间的关系式___________ 。据此关系及上表数据,也能推断出反应③是___________ (填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有___________ (填写序号)。
A.扩大反应容器容积 B.升高温度
C.使用合适的催化剂 D.设法减少CO的量
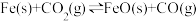 ,其平衡常数为K1;
,其平衡常数为K1;化学反应②
 ,其平衡常数为K2。
,其平衡常数为K2。在温度973 K和1173 K情况下, K1、K2的值分别如下:
| 温度 | K1 | K2 |
| T1=973K | 1.47 | 2.38 |
| T2=1173K | 2.15 | 1.67 |
(2)现有反应③
 ,请你写出该反应的平衡常数K3的表达式:K3=
,请你写出该反应的平衡常数K3的表达式:K3=(3)根据反应①与②可推导出K3, K1、K2与K3之间的关系式
A.扩大反应容器容积 B.升高温度
C.使用合适的催化剂 D.设法减少CO的量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在一定体积的密闭容器中进行化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________ 。
(2)该反应为____________ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为____________ ℃。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应____________ (填“正向”或“逆向”)进行。
 CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数和温度的关系如下表所示:| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)某温度下,平衡浓度符合下式c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2 mol·L-1,c(H2)=1.5 mol·L-1,c(CO)=1 mol·L-1,c(H2O)=3 mol·L-1,则下一时刻,反应
您最近一年使用:0次



