推理是化学学习中常用的思维方法,下列推理合理的是
| A.NaOH和CaCl2都是离子化合物,所以二者化学键类型相同 |
| B.可逆反应达平衡时,体系中各组分的浓度不再变化,可推知正、逆反应停止了 |
| C.原电池加快某些反应的速率,所以用锌与稀硫酸反应制取氢气常加入少量硫酸铜 |
| D.同条件下反应物浓度越大反应越快,所以铁在浓硝酸中比在稀硝酸中溶解得快 |
更新时间:2018-06-20 20:59:07
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法正确的是
| A.增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增加 |
| B.升高温度能使化学反应速率增大,主要原因是增大了活化分子的数目 |
| C.有气体参加的化学反应,若增大压强(缩小容器体积),可增大活化分子的百分数 |
| D.催化剂能减小反应的活化能,但不能增大单位体积内活化分子的百分数 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】运用相关化学知识进行判断,下列结论正确的是
| A.需要加热或高温的条件才能发生的反应一定是吸热反应 |
| B.对于正向吸热的可逆反应,其他条件不变时,升高温度可以使正反应速率增大,逆反应速率减小 |
| C.为了减小稀盐酸与过量石灰石反应的速率,可向反应体系中加入适量的蒸馏水 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】某温度下,在一恒容密闭容器中进行反应:A(g)+3B(g) 2C(g),下列情况一定能说明反应已达到平衡的是
2C(g),下列情况一定能说明反应已达到平衡的是
①单位时间内,有3molB反应,同时有2molC生成
②容器内压强不随时间而变化
③单位时间内,有2molC生成,同时有lmolA生成
④用A、B、C表示的该反应的化学反应速率之比为1∶3∶2
⑤气体的平均摩尔质量不随时间而变化
⑥气体的密度不随时间而变化
 2C(g),下列情况一定能说明反应已达到平衡的是
2C(g),下列情况一定能说明反应已达到平衡的是①单位时间内,有3molB反应,同时有2molC生成
②容器内压强不随时间而变化
③单位时间内,有2molC生成,同时有lmolA生成
④用A、B、C表示的该反应的化学反应速率之比为1∶3∶2
⑤气体的平均摩尔质量不随时间而变化
⑥气体的密度不随时间而变化
| A.③④⑤⑥ | B.①②③ | C.②④⑥ | D.②③⑤ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
| A.①③⑥ | B.①②③ | C.①②⑤⑥ | D.①②③④⑤⑥ |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
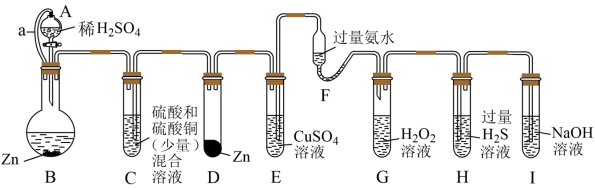
【推荐1】“化学多米诺实验”(如图所示)即只需控制第一个反应,利用反应中气体产生的压力和虹吸作用原理,使若干化学实验依次发生。已知: (该反应产物可作为
(该反应产物可作为 的催化剂)。下列有关分析错误的是
的催化剂)。下列有关分析错误的是
 (该反应产物可作为
(该反应产物可作为 的催化剂)。下列有关分析错误的是
的催化剂)。下列有关分析错误的是
| A.该实验成功的重要条件是整套装置气密性良好 |
| B.H中出现浅黄色浑浊,证明O非金属性强于S |
C. 中存在极性共价键和配位键,N原子的杂化类型为 中存在极性共价键和配位键,N原子的杂化类型为 杂化 杂化 |
| D.若硫酸浓度及锌片大小表面积等均相同,则B中产生氢气速率大于D中速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列叙述不正确的是
| A.NaHCO3、Fe(OH)3、FeCl2均可通过化合反应生成 |
| B.电离、电解、电泳、电镀、电化学腐蚀均需要通电才可进行 |
| C.锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
| D.电镀时,应把镀件置于电解槽的阴极 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列物质属于离子化合物的是
| A.H2O2 | B.NH4Cl | C.HCl | D.H2SO4 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列说法中正确的是( )
A.CO2的分子结构模型: |
| B.NaF、H2SO4中所含化学键类型相同 |
| C.F2、Cl2、Br2、I2熔沸点逐渐升高 |
| D.HCI气体溶于水和NaOH熔化破坏的化学键类型相同 |
您最近一年使用:0次

 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)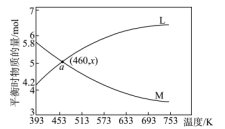
 ,将等质量的两份锌粉分别加入两个烧杯中,同时向a中加入少量
,将等质量的两份锌粉分别加入两个烧杯中,同时向a中加入少量 溶液,下列产生氢气的体积(V)与时间(t)的关系正确的是
溶液,下列产生氢气的体积(V)与时间(t)的关系正确的是



 ,5种元素可形成配位化合物
,5种元素可形成配位化合物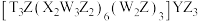 。下列说法不正确的是
。下列说法不正确的是

