亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN废液为主要原料制备黄血盐的流程如下:
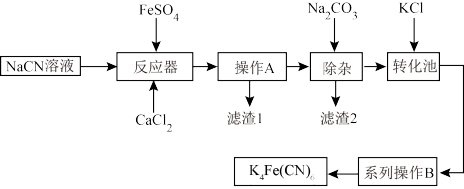
请回答下列问题:
(1)常温下,HCN的电离常数Ka=5.0×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是_____ 。
②浓度均为0.5mol·L−1的NaCN和HCN的混合溶液显___ (填“酸”“碱”或“中”)性,通过计算说明:____ 。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_____ 。
(3)系列操作B为_______ 。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:_____ 。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。①K+移向催化剂______ (填“a”或“b”)。②催化剂a表面发生的反应为_______ 。


请回答下列问题:
(1)常温下,HCN的电离常数Ka=5.0×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是
②浓度均为0.5mol·L−1的NaCN和HCN的混合溶液显
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:
(3)系列操作B为
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。①K+移向催化剂

更新时间:2018-08-20 22:27:19
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】碱式碳酸钴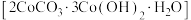 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:

(1)还原时使用的装置如图所示。 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:___________ 。
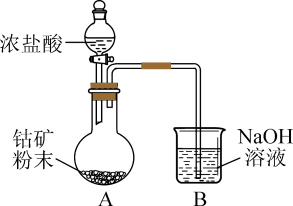
(2)为控制装置A中应加入盐酸的量,需测定钴矿中 的含量。准确称取
的含量。准确称取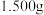 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。
①滴定终点的现象是___________ ;
②计算钴矿中 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程___________ 。
(3)补充完整由装置A反应后的溶液提取 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应;___________ ,得到 溶液。
溶液。
[已知:①在浓 溶液中会发生反应:
溶液中会发生反应: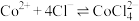 ;②
;② 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
(4)沉钴步骤中的试剂是 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。
①适宜的加料方式为___________ 。
A.将 溶液加入到
溶液加入到 溶液中
溶液中
B.将 溶液加入到
溶液加入到 溶液中
溶液中
②写出沉钴时生成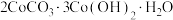 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:___________ 。
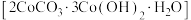 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:
(1)还原时使用的装置如图所示。
 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:
(2)为控制装置A中应加入盐酸的量,需测定钴矿中
 的含量。准确称取
的含量。准确称取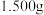 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。①滴定终点的现象是
②计算钴矿中
 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程(3)补充完整由装置A反应后的溶液提取
 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应; 溶液。
溶液。[已知:①在浓
 溶液中会发生反应:
溶液中会发生反应: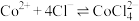 ;②
;② 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水](4)沉钴步骤中的试剂是
 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。①适宜的加料方式为
A.将
 溶液加入到
溶液加入到 溶液中
溶液中B.将
 溶液加入到
溶液加入到 溶液中
溶液中②写出沉钴时生成
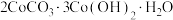 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
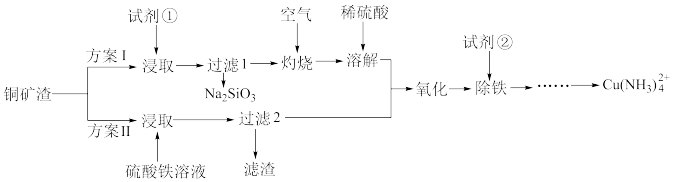
【推荐2】铜氨溶液在纤维工业有广泛应用。实验室模拟用废弃辉铜矿渣(主要含Cu2S,还含有少量FeS、SiO2)为原料制备Cu(NH3) 的流程如图:
的流程如图:
已知:常温下,Ksp[Cu(OH)2]=2×10-20,Cu2++4NH3 Cu(NH3)
Cu(NH3) K=1×1013
K=1×1013
回答下列问题:
(1)实验前将矿渣粉碎的目的是________ ,方案I中试剂①是________ 。
(2)方案II中,“过滤2”所得滤渣的主要成分除S外,还有________ (填化学式)。Cu2S和硫酸铁溶液反应的离子方程式是________ 。
(3)“除铁”前,“氧化”的目的是________ ,试剂②最好选用________ (填化学式)。如何证明铁元素被完全除尽?________ 。
(4)从环保角度看,两种方案更优的是________ 。
(5)常温下,向CuSO4溶液中加入浓氨水,生成Cu(OH)2沉淀,继续加入浓氨水,沉淀溶解生成Cu(NH3) 。沉淀开始溶解时溶液的pH为10,则
。沉淀开始溶解时溶液的pH为10,则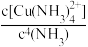 =
=________ 。
 的流程如图:
的流程如图:
已知:常温下,Ksp[Cu(OH)2]=2×10-20,Cu2++4NH3
 Cu(NH3)
Cu(NH3) K=1×1013
K=1×1013回答下列问题:
(1)实验前将矿渣粉碎的目的是
(2)方案II中,“过滤2”所得滤渣的主要成分除S外,还有
(3)“除铁”前,“氧化”的目的是
(4)从环保角度看,两种方案更优的是
(5)常温下,向CuSO4溶液中加入浓氨水,生成Cu(OH)2沉淀,继续加入浓氨水,沉淀溶解生成Cu(NH3)
 。沉淀开始溶解时溶液的pH为10,则
。沉淀开始溶解时溶液的pH为10,则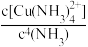 =
=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂。实验室制备四碘化锡的主要步骤如下:
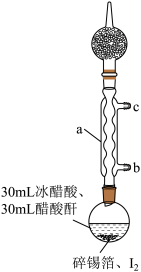
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。
实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;
步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。回答下列问题:
(1)图中仪器a的名称为________ ;冷却水从________ (填“b”或“c”)进入。
(2)仪器a上连接装有无水CaCl2的干燥管的目的是________ ;锡箔需剪碎的目的是________ ;加入醋酸酐的目的是________ 。
(3)烧瓶中发生反应的化学方程式为________ ;单质碘需过量的主要目的是________ 。
(4)反应已到终点的现象是________ 。
(5)步骤3和步骤4的目的是________ 。
步骤1:在干燥的圆底烧瓶中加入少量碎锡箔和稍过量的I2,再加入30mL冰醋酸和30mL醋酸酐[(CH3CO)2O]。
实验装置如图所示,组装好后用煤气灯加热至沸腾约1-1.5h,至反应完成;

步骤2:冷却结晶,过滤得到四碘化锡粗品;
步骤3:粗品中加入30mL氯仿,水浴加热回流溶解后,趁热过滤;
步骤4:将滤液倒入蒸发皿中,置于通风橱内,待氯仿全部挥发后得到四碘化锡晶体。回答下列问题:
(1)图中仪器a的名称为
(2)仪器a上连接装有无水CaCl2的干燥管的目的是
(3)烧瓶中发生反应的化学方程式为
(4)反应已到终点的现象是
(5)步骤3和步骤4的目的是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】水体中氮含量过高会对水中生物构成安全威胁,氨氮硝氮是氮的主要存在形态。
(1)某工业氨氮废水的处理流程如下图所示:
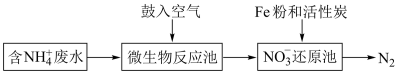
①写出“微生物反应池”中反应的离子方程式:___________ 。
②“NO 还原池”通过形成铁碳原电池对废水中的NO
还原池”通过形成铁碳原电池对废水中的NO 等进行处理,写出NO
等进行处理,写出NO 在正极发生的电极反应:
在正极发生的电极反应:___________ 。
(2)向氨氮废水中加入NaClO,可以将NH 最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
i.ClO—+H2O OH-+HClO
OH-+HClO
ii.NH +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
ii.NH3·H2O+HClO=NH2Cl+2H2O
iv.……
v.H++OH—=H2O
①写出反应iv的离子方程式:___________ 。
②废水中氨氮去除率与初始pH有关。保持其他条件不变,随初始pH的升高,溶液中c(HClO)___________ (填“增大”“不变”或“减小”,下同),c(NH3·H2O)___________ 。
③研究发现,保持其他条件相同,废水中氨氮去除率随温度的升高先升高后降低。当温度>35℃时,氨氮去除率随溶液温度升高而降低的原因可能是___________ (答一条)。
(3)利用双离子交换膜电解法可以处理含NH4NO3的工业废水,并获得氨水和硝酸,原理如图所示:
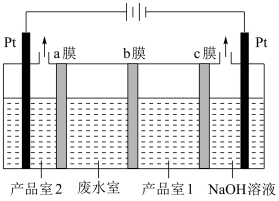
b膜属于___________ (填“阴”或“阳”)离子交换膜;为增强溶液的导电性,电解前产品室2中的溶液应是___________ 。
(1)某工业氨氮废水的处理流程如下图所示:

①写出“微生物反应池”中反应的离子方程式:
②“NO
 还原池”通过形成铁碳原电池对废水中的NO
还原池”通过形成铁碳原电池对废水中的NO 等进行处理,写出NO
等进行处理,写出NO 在正极发生的电极反应:
在正极发生的电极反应:(2)向氨氮废水中加入NaClO,可以将NH
 最终氧化为N2。NaClO除去水中氨氮的反应过程如下:
最终氧化为N2。NaClO除去水中氨氮的反应过程如下:i.ClO—+H2O
 OH-+HClO
OH-+HClOii.NH
 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+ii.NH3·H2O+HClO=NH2Cl+2H2O
iv.……
v.H++OH—=H2O
①写出反应iv的离子方程式:
②废水中氨氮去除率与初始pH有关。保持其他条件不变,随初始pH的升高,溶液中c(HClO)
③研究发现,保持其他条件相同,废水中氨氮去除率随温度的升高先升高后降低。当温度>35℃时,氨氮去除率随溶液温度升高而降低的原因可能是
(3)利用双离子交换膜电解法可以处理含NH4NO3的工业废水,并获得氨水和硝酸,原理如图所示:

b膜属于
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】利用油脂厂废弃镍(Ni)催化剂(主要含有Ni,还含少量Al、Fe、NiO、Al2O3、Fe2O3)制备NiSO4·6H2O的工艺流程如下:

回答下列问题:
(1)为了加快“碱浸”的速率可以采取的措施是___________ (任写一条);
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式____________ 。
(3)“滤液2” 中含金属阳离子有______________ 。
(4)①“氧化”中反应的离子反应方程式是_________________________________ ;
②“氧化”中可以代替H2O2的最佳物质是_________________ (填标号)
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O Fe(OH)3+3H+平衡, X物质可以为下列的
Fe(OH)3+3H+平衡, X物质可以为下列的______________ 。
a.H2SO4 b.NaOH c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法_____________ ;
③结晶:将滤液蒸发、降温至稍高于_______ ℃结晶,过滤即获得产品,硫酸镍晶体溶解度曲线图如图所示:


回答下列问题:
(1)为了加快“碱浸”的速率可以采取的措施是
(2)向滤液1中通入足量CO2可以将其中的金属元素沉淀,写出该反应的离子反应方程式
(3)“滤液2” 中含金属阳离子有
(4)①“氧化”中反应的离子反应方程式是
②“氧化”中可以代替H2O2的最佳物质是
a.Cl2 b.O2 c.Fe
(5)根据除铁及系列操作,回答以下问题:
①已知溶液中存在Fe3++3H2O
 Fe(OH)3+3H+平衡, X物质可以为下列的
Fe(OH)3+3H+平衡, X物质可以为下列的a.H2SO4 b.NaOH c.Ni(OH)2 d.CO2
②边搅拌边向滤液中加入X至pH=4,加热、过滤、洗涤,检验沉淀是否洗涤干净的方法
③结晶:将滤液蒸发、降温至稍高于

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】金属及其化合物在生产中用途广泛。
Ⅰ.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
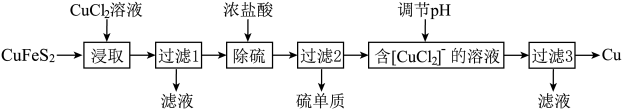
已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为___________ 。
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为___________ 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是___________ 。(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有____________ ,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为____________ 。
Ⅱ.利用生产硼砂的废渣——硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:
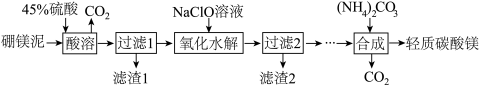
(5)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式_____________________ 。
(6)滤渣2的主要成分有MnO2和_____________ ,写出生成MnO2的离子方程式____________________ 。
(7)“合成”时需通蒸汽至80 ℃,边加热边搅拌,温度控制在80 ℃的原因是________________________ (只需写出相应的化学方程式)。
Ⅰ.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)过滤3所得滤液中可以循环使用的物质有
Ⅱ.利用生产硼砂的废渣——硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:

(5)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式
(6)滤渣2的主要成分有MnO2和
(7)“合成”时需通蒸汽至80 ℃,边加热边搅拌,温度控制在80 ℃的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】废旧铅蓄电池的铅膏中主要含有 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为________ ,用沉淀溶解平衡原理解释选择 的原因
的原因________ 。
(2)在“脱硫”中,加入 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是________ 。
(3)在“酸浸”中,除加入醋酸( ),还要加入
),还要加入 。
。
(ⅰ)能被 氧化的离子是
氧化的离子是________ ;
(ⅱ) 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为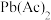 ,其化学方程式为
,其化学方程式为________ ;
(ⅲ) 也能使
也能使 转化为
转化为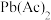 ,
, 的作用是
的作用是________ 。
 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。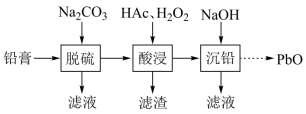
| 难溶电解质 |  |  |  |  |
 | 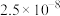 | 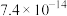 | 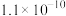 |  |
 如下表:
如下表:| 金属氢氧化物 |  |  |  | 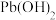 |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中
 转化反应的离子方程式为
转化反应的离子方程式为 的原因
的原因(2)在“脱硫”中,加入
 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是(3)在“酸浸”中,除加入醋酸(
 ),还要加入
),还要加入 。
。(ⅰ)能被
 氧化的离子是
氧化的离子是(ⅱ)
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为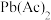 ,其化学方程式为
,其化学方程式为(ⅲ)
 也能使
也能使 转化为
转化为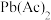 ,
, 的作用是
的作用是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】综合处理炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4],实现变废为宝得到多种产品,进一步利用镓盐可制备具有优异光电性能的氮化镓GaN(Ga与Al同主族),部分工艺流程如图:
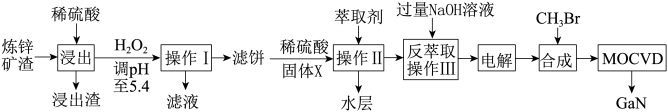
已知:①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表:
②当溶液中剩余离子的浓度小于10-5mol·L-1时,视为沉淀完全。
③MOCVD:化学气相沉积,以合成的三甲基镓为原料,使其与NH3反应得到GaN。
请回答下列问题:
(1)已知铁酸锌可以用ZnO·Fe2O3表示,写出浸出时铁酸锌参加反应的化学方程式____ 。
(2)浸出后调节pH至5.4的目的是____ 。
(3)固体X最佳选择为____ ,电解过程可得粗镓,则得到金属镓的电极反应式为____ 。
(4)三甲基镓与NH3反应得到GaN的同时获得的副产物为____ 。
(5)滤液中残留的镓离子的浓度为____ mol·L-1。由滤液可制备ZnC2O4·2H2O,再通过热分解探究其产物,制备ZnC2O4·2H2O时,为提高晶体的纯度,Na2C2O4溶液和滤液混合时应将____ 加入到____ 中,已知ZnC2O4·2H2O的TG-DTA(热重分析一差热分析)曲线如图所示。

则ZnC2O4·2H2O分解是____ 反应(填“放热”或“吸热”),分解的总化学方程式为____ 。

已知:①常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表:
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
③MOCVD:化学气相沉积,以合成的三甲基镓为原料,使其与NH3反应得到GaN。
请回答下列问题:
(1)已知铁酸锌可以用ZnO·Fe2O3表示,写出浸出时铁酸锌参加反应的化学方程式
(2)浸出后调节pH至5.4的目的是
(3)固体X最佳选择为
(4)三甲基镓与NH3反应得到GaN的同时获得的副产物为
(5)滤液中残留的镓离子的浓度为

则ZnC2O4·2H2O分解是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】国家规定,排放的废水中氟的含量不得超过10.0mg·L-1,砷的含量不得超过0.5mg·L-1。硫酸工厂废水中除含有稀硫酸外,还含有H3AsO3、H2SiF6等物质。工业上常通过化学沉淀和氧化、吸附沉降处理废水,实现水体达标排放。
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主]、过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO3)2。
①CaSO4中阴离子的空间构型为____ 。
②写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:____ 。
③充分沉淀后测得废水中F-的含量为19.0mg·L-1,此时SO 的浓度为
的浓度为____ mol·L-1。[已知:Ksp(CaSO4)=5.0×10-5、Ksp(CaF2)=5.0×10-9]
(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。已知:
ⅰ.NaClO能将As(III)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ⅱ.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
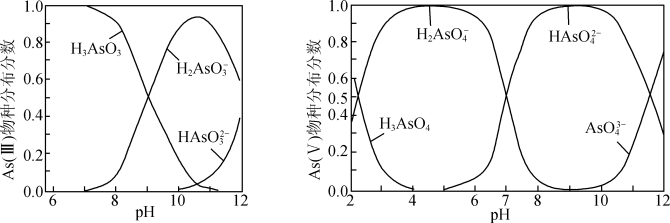
①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:____ 。
②其他条件相同的情况下,用以下两种方式向废水样中添加NaClO和FeSO4溶液。方式I:先加NaClO溶液,再加FeSO4溶液;方式II:先加FeSO4溶液,再加NaClO溶液。反应相同时间,测得As(III)的氧化效果方式II不如方式I,原因是____
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主]、过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO3)2。
①CaSO4中阴离子的空间构型为
②写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:
③充分沉淀后测得废水中F-的含量为19.0mg·L-1,此时SO
 的浓度为
的浓度为(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。已知:
ⅰ.NaClO能将As(III)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ⅱ.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:
②其他条件相同的情况下,用以下两种方式向废水样中添加NaClO和FeSO4溶液。方式I:先加NaClO溶液,再加FeSO4溶液;方式II:先加FeSO4溶液,再加NaClO溶液。反应相同时间,测得As(III)的氧化效果方式II不如方式I,原因是
您最近一年使用:0次
【推荐1】碳的氧化物对环境的影响较大,研究和开发碳的氧化物的应用对发展低碳经济,构建生态文明社会具有重要的意义。
(1)已知:①甲醇的燃烧热ΔH=-726.4 kJ·mol-1;
②H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为_____________ 。
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与 的关系如图所示:
的关系如图所示:

①当起始 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=______ 。若此刻再向容器中加入CO(g)和CH3OH(g)各0.4mol,达到新平衡时H2的转化率将________ (填“增大”“减小”或“不变”)。
②当 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的________ (填“D”“E”或“F”)点。
(3)已知由CO2生成CO的化学方程式为CO2(g)+O(g)⇌CO(g)+O2(g),其正反应速率为v正=k正·c(CO2)·c(O),逆反应速率为v逆=k逆·c(CO)·c(O2),k为速率常数。2500 K时,k逆=1.21×105L·s-1·mol-1,k正=3.02×105L·s-1·mol-1,则该温度下该反应的平衡常数K为________ 。(保留小数点后一位小数)
(4)CH3OH—O2在新型聚合物催化下可发生原电池反应,其装置如图:
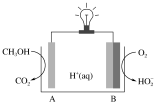
①外电路中每转移3mol电子,溶液中生成_______ molH+
②写出电极B的电极反应式:__________ 。
(1)已知:①甲醇的燃烧热ΔH=-726.4 kJ·mol-1;
②H2(g)+
 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则二氧化碳和氢气合成液态甲醇、生成气态水的热化学方程式为
(2)在T1时,向体积为2L的恒容容器中充入物质的量之和为3mol的CO和H2,发生反应CO(g)+2H2(g)⇌CH3OH(g),反应达到平衡时CH3OH(g)的体积分数(φ)与
 的关系如图所示:
的关系如图所示:
①当起始
 =2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=
=2时,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率v(H2)=②当
 =3.5时,达到平衡后,CH3OH的体积分数可能是图象中的
=3.5时,达到平衡后,CH3OH的体积分数可能是图象中的(3)已知由CO2生成CO的化学方程式为CO2(g)+O(g)⇌CO(g)+O2(g),其正反应速率为v正=k正·c(CO2)·c(O),逆反应速率为v逆=k逆·c(CO)·c(O2),k为速率常数。2500 K时,k逆=1.21×105L·s-1·mol-1,k正=3.02×105L·s-1·mol-1,则该温度下该反应的平衡常数K为
(4)CH3OH—O2在新型聚合物催化下可发生原电池反应,其装置如图:

①外电路中每转移3mol电子,溶液中生成
②写出电极B的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】我国提出2060年前实现碳中和,降低大气中 含量是当今世界重要科研课题之一,以
含量是当今世界重要科研课题之一,以 为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
(1) 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:

副反应:

①已知
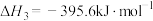 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式

___________ 。
②500℃时,向 恒容密闭容器中充入
恒容密闭容器中充入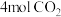 和
和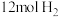 ,主、副反应都达到平衡状态时,测得
,主、副反应都达到平衡状态时,测得 %,副反应的平衡常数
%,副反应的平衡常数 ,主反应的平衡常数
,主反应的平衡常数
___________ ,平衡时 选择性=
选择性=___________ ( 选择性=
选择性= ×100%,保留两位有效数字)。
×100%,保留两位有效数字)。
(2)某研究小组采用双合金团簇催化甲烷干法重整法(DRM)取得了良好的效果。通过大量的研究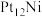 、
、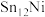 、
、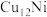 三种双金属合金团簇可用于催化DRM反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2:
三种双金属合金团簇可用于催化DRM反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2: 的活化(包括直接活化和氢诱导活化),过程3:
的活化(包括直接活化和氢诱导活化),过程3: 和
和 的氧化,过程4:扩散吸附反应。其反应机理如图所示。
的氧化,过程4:扩散吸附反应。其反应机理如图所示。

则过程3的最终产物为___________ ,过程4发生扩散吸附反应的微粒为___________ 。
(3)甲醇也是新能源的重要组成部分,以 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:
Ⅰ.
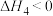
Ⅱ.

Ⅲ.
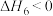
在不同压强下、按照 进行投料,在器容中发生上述3个反应,平衡时,CO和
进行投料,在器容中发生上述3个反应,平衡时,CO和 在含碳产物(即
在含碳产物(即 和CO)中物质的量分数及
和CO)中物质的量分数及 的转化率随温度的变化如图,压强
的转化率随温度的变化如图,压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ,曲线___________ (填“m”或“n”)代表 在含碳产物中物质的量分数。
在含碳产物中物质的量分数。

(4)光催化 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。

光催化原理与电解原理类似,写出高能导带的电极反应式:___________ 。
 含量是当今世界重要科研课题之一,以
含量是当今世界重要科研课题之一,以 为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:
为原料制备甲烷、甲醇等能源物质具有较好的发展前景。回答下列问题:(1)
 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:主反应:


副反应:


①已知

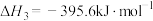 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式

②500℃时,向
 恒容密闭容器中充入
恒容密闭容器中充入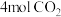 和
和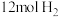 ,主、副反应都达到平衡状态时,测得
,主、副反应都达到平衡状态时,测得 %,副反应的平衡常数
%,副反应的平衡常数 ,主反应的平衡常数
,主反应的平衡常数
 选择性=
选择性= 选择性=
选择性= ×100%,保留两位有效数字)。
×100%,保留两位有效数字)。(2)某研究小组采用双合金团簇催化甲烷干法重整法(DRM)取得了良好的效果。通过大量的研究
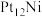 、
、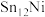 、
、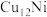 三种双金属合金团簇可用于催化DRM反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2:
三种双金属合金团簇可用于催化DRM反应,在催化剂表面涉及多个基元反应,分别为过程1:甲烷逐步脱氢,过程2: 的活化(包括直接活化和氢诱导活化),过程3:
的活化(包括直接活化和氢诱导活化),过程3: 和
和 的氧化,过程4:扩散吸附反应。其反应机理如图所示。
的氧化,过程4:扩散吸附反应。其反应机理如图所示。
则过程3的最终产物为
(3)甲醇也是新能源的重要组成部分,以
 、
、 为原料合成
为原料合成 涉及的反应如下:
涉及的反应如下:Ⅰ.

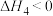
Ⅱ.


Ⅲ.

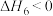
在不同压强下、按照
 进行投料,在器容中发生上述3个反应,平衡时,CO和
进行投料,在器容中发生上述3个反应,平衡时,CO和 在含碳产物(即
在含碳产物(即 和CO)中物质的量分数及
和CO)中物质的量分数及 的转化率随温度的变化如图,压强
的转化率随温度的变化如图,压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为 在含碳产物中物质的量分数。
在含碳产物中物质的量分数。
(4)光催化
 制甲醇技术也是研究热点。铜基纳米光催化材料还原
制甲醇技术也是研究热点。铜基纳米光催化材料还原 的机理为:光照时,低能价带失去电子并产生空穴(
的机理为:光照时,低能价带失去电子并产生空穴( ,具有强氧化性)。
,具有强氧化性)。
光催化原理与电解原理类似,写出高能导带的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】“低碳经济”备受关注, 的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
(1)已知某反应的平衡常数表达式为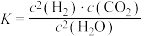 ,所对应的化学反应方程式为
,所对应的化学反应方程式为___________ 。
(2)科学家提出由 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。

①工艺过程中的能量转化形式为___________ 。
②已知“重整系统”发生的反应中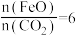 ,则
,则 的化学式为
的化学式为___________ ,“热分解系统”中每转移2mol电子,需消耗
___________ mol。
(3)业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:



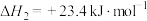
①反应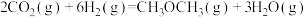

___________
②在某压强下,合成二甲醚的反应在不同温度、不同投料比时, 的转化率如图所示。
的转化率如图所示。 温度下,将4mol
温度下,将4mol  和8mol
和8mol  充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
___________ ; 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为___________ 。

③利用二甲醚设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨作电极,该电池的负极反应式为___________ 。
 的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:
的产生及有效开发利用成为科学家研究的重要课题。回答下列问题:(1)已知某反应的平衡常数表达式为
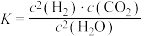 ,所对应的化学反应方程式为
,所对应的化学反应方程式为(2)科学家提出由
 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
①工艺过程中的能量转化形式为
②已知“重整系统”发生的反应中
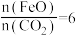 ,则
,则 的化学式为
的化学式为
(3)业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:


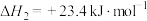
①反应
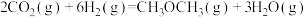

②在某压强下,合成二甲醚的反应在不同温度、不同投料比时,
 的转化率如图所示。
的转化率如图所示。 温度下,将4mol
温度下,将4mol  和8mol
和8mol  充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
充入2L的密闭容器中,10min后反应达到平衡状态,则平衡时
 、
、 、
、 三者之间的大小关系为
三者之间的大小关系为
③利用二甲醚设计一个燃料电池,用KOH溶液作电解质溶液,多孔石墨作电极,该电池的负极反应式为
您最近一年使用:0次



