(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B溶液中水的电离程度相同,A、C溶液的pH相同。则B是_____________ ,C是_____________ 。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
a. c(Cl-)>c(NH4+)>c(H+)>c(OH-) b. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c. c(NH4+)>c(Cl-)>c(OH-)>c(H+) d. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:
①上述关系一定不正确的是____________ 填序号)。
②溶液中只有一种溶质,则该溶液中离子浓度的大小关系为____________ 填序号)。
③若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显______________________ (填“酸性”“碱性”或“中性”)。
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
a. c(Cl-)>c(NH4+)>c(H+)>c(OH-) b. c(Cl-)>c(NH4+)>c(OH-)>c(H+)
c. c(NH4+)>c(Cl-)>c(OH-)>c(H+) d. c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:
①上述关系一定不正确的是
②溶液中只有一种溶质,则该溶液中离子浓度的大小关系为
③若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显
更新时间:2018-12-03 06:37:26
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】物质在水中可能存在电离平衡、盐的水解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、OH-、___ 。(填写微粒符号)
(2)碳酸钠溶液呈碱性的原因是(用离子方程式表示)___ ;为证明你的上述观点,请设计一个简单的实验,简述实验过程___ 。
(3)实验室在配制的FeCl3溶液时,常将FeCl3固体先溶于较浓的___ 中,然后再用蒸馏水稀释到所需的浓度,把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___ 。
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4、溶液中c(NH4+)从大到小的顺序为:___ (填序号)。
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、OH-、
(2)碳酸钠溶液呈碱性的原因是(用离子方程式表示)
(3)实验室在配制的FeCl3溶液时,常将FeCl3固体先溶于较浓的
(4)常温下,物质的量浓度相同的下列溶液 :①NH4Cl②NH4HSO4③NH3·H2O④CH3COONH4、溶液中c(NH4+)从大到小的顺序为:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】食醋是烹饪美食的调味品,能改善调节人体的新陈代谢,其有效成分为 ,为一元弱酸,回答下列问题:
,为一元弱酸,回答下列问题:
(1)25℃时, 的醋酸溶液中,由水电离出的
的醋酸溶液中,由水电离出的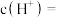
___________  。
。
(2)已知 的
的 ,
, 的
的 ,则
,则 的浓溶液呈
的浓溶液呈___________ 性(酸性、中性或碱性),试解释原因___________ (用文字和方程式说明)。
(3)设计实验证明 为弱酸
为弱酸___________ 。
(4) (醋酸钡晶体)是一种媒染剂。向醋酸溶液中加入
(醋酸钡晶体)是一种媒染剂。向醋酸溶液中加入 溶液,通过一系列操作可以制得
溶液,通过一系列操作可以制得 。
。
①在25℃时,若向醋酸溶液中加入 溶液至溶液的
溶液至溶液的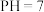 ,此时溶液中
,此时溶液中 ,则溶液中
,则溶液中
_______ 。
②下列有关 醋酸钡溶液中粒子浓度的比较错误的是
醋酸钡溶液中粒子浓度的比较错误的是_______ 。
A.
B.
C.
D.
(5)根据Ka可以判断弱酸的酸性强弱,写出一种无机弱酸及其用途_______ 。
 ,为一元弱酸,回答下列问题:
,为一元弱酸,回答下列问题:(1)25℃时,
 的醋酸溶液中,由水电离出的
的醋酸溶液中,由水电离出的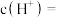
 。
。(2)已知
 的
的 ,
, 的
的 ,则
,则 的浓溶液呈
的浓溶液呈(3)设计实验证明
 为弱酸
为弱酸(4)
 (醋酸钡晶体)是一种媒染剂。向醋酸溶液中加入
(醋酸钡晶体)是一种媒染剂。向醋酸溶液中加入 溶液,通过一系列操作可以制得
溶液,通过一系列操作可以制得 。
。①在25℃时,若向醋酸溶液中加入
 溶液至溶液的
溶液至溶液的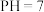 ,此时溶液中
,此时溶液中 ,则溶液中
,则溶液中
②下列有关
 醋酸钡溶液中粒子浓度的比较错误的是
醋酸钡溶液中粒子浓度的比较错误的是A.

B.

C.

D.

(5)根据Ka可以判断弱酸的酸性强弱,写出一种无机弱酸及其用途
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,浓度均为0.1mol·L-1的下列六种溶液的pH如表:
①上述盐溶液中的阴离子,结合质子能力最强的是____ 。
②据表数据,请你判断下列反应不能成立的是____ (填编号)。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____ 。
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将浓度为2×10-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度____ mol/L。
(1)常温下,浓度均为0.1mol·L-1的下列六种溶液的pH如表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②据表数据,请你判断下列反应不能成立的是
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其Ksp=2.8×10-9。现将浓度为2×10-4mol/LNa2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】根据下表数据回答问题:
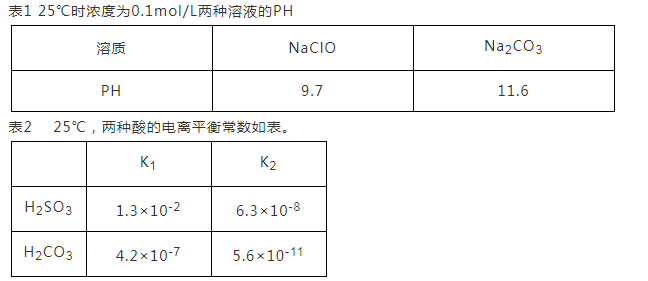
(1)根据表1能不能判断出H2CO3与HClO酸性强弱?_________ (填“能”或“不能”)。
(2)0.10mol·L-lNa2SO3溶液中离子浓度由大到小的顺序为___________________________
(3)H2SO3溶液和 NaHCO3溶液反应的离子方程式为________________________________
(4)常温下,NaHSO3溶液呈酸性,请用计算数据说明:__________________________________

(1)根据表1能不能判断出H2CO3与HClO酸性强弱?
(2)0.10mol·L-lNa2SO3溶液中离子浓度由大到小的顺序为
(3)H2SO3溶液和 NaHCO3溶液反应的离子方程式为
(4)常温下,NaHSO3溶液呈酸性,请用计算数据说明:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
(1)已知亚磷酸(H3PO3)为二元弱酸,则(Na2HPO3)溶液中,各离子浓度的大小关系为___________
(2)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示 的是曲线
的是曲线___________ (填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=___________

(3)常温时,0.1 mol/LNH4Al(SO4)2溶液的pH=3。
①
___________ mol/L。
②80℃时, 溶液的pH小于3,请从平衡移动的角度分析导致pH随温度变化的原因是
溶液的pH小于3,请从平衡移动的角度分析导致pH随温度变化的原因是___________ 。
(4)常温时,向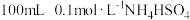 溶液中滴加
溶液中滴加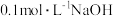 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
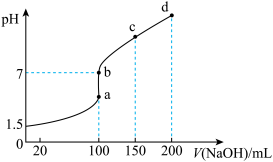
①向 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为___________ 。
②图中a、b、c、d点中水的电离程度最小的是___________ 。
(1)已知亚磷酸(H3PO3)为二元弱酸,则(Na2HPO3)溶液中,各离子浓度的大小关系为
(2)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示
 的是曲线
的是曲线
(3)常温时,0.1 mol/LNH4Al(SO4)2溶液的pH=3。
①

②80℃时,
 溶液的pH小于3,请从平衡移动的角度分析导致pH随温度变化的原因是
溶液的pH小于3,请从平衡移动的角度分析导致pH随温度变化的原因是(4)常温时,向
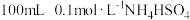 溶液中滴加
溶液中滴加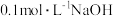 溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。①向
 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为②图中a、b、c、d点中水的电离程度最小的是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】水的离子积常数Kw与温度T(℃)的关系如图D3-5所示:
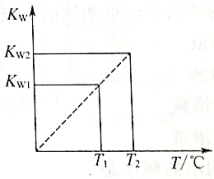
(1)若T1=25℃,则Kw1=_____________ ;若T2=100℃时,Kw2=10-12,则此时0.05mol/L的Ba(OH)2溶液的pH=_____________ 。
(2)已知25℃时,0.1L 0.1mol/L的NaA溶液的pH=10,则NaA溶液中存在的平衡有_______________________________________________ 。
溶液中各离子的物质的量浓度由大到小的顺序为__________________________ 。
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=9,则NaOH溶液与硫酸溶液的体积比为_____________ 。

(1)若T1=25℃,则Kw1=
(2)已知25℃时,0.1L 0.1mol/L的NaA溶液的pH=10,则NaA溶液中存在的平衡有
溶液中各离子的物质的量浓度由大到小的顺序为
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液的pH=9,则NaOH溶液与硫酸溶液的体积比为
您最近一年使用:0次



