(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为________ 。
②1 mol CH2=CH-CH2OH含___ molσ键,烯丙醇分子中碳原子的杂化类型为___ 。
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为_____ 。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为_______ 。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________ 。
①基态镍原子的价电子排布式为
②1 mol CH2=CH-CH2OH含
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是
更新时间:2019-05-10 17:15:19
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】请回答下列问题
(1)某元素的原子序数为33,则:此元素原子的电子总数是______ ;有_____ 个不同运动状态的电子,有____ 个电子层,____ 个能级;简化的电子排布式为__________ 。
(2)1s22s22p63s23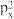 违背了
违背了____________ 。核电荷数为24的元素,其价电子排布的轨道表示式______ ,其原子的最外层电子数和未成对电子数分别为_____ 和_____ 。
(3)电子排布式为1s22s22p63s23p6某微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是________ , 原子核外电子云有________ 种不同的伸展方向。
(1)某元素的原子序数为33,则:此元素原子的电子总数是
(2)1s22s22p63s23
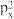 违背了
违背了(3)电子排布式为1s22s22p63s23p6某微粒的盐溶液能使溴水褪色,并出现浑浊,这种微粒的符号是
您最近一年使用:0次
【推荐2】物质结构揭示物质构成的奥秘,请回答以下问题:
(1)元素A含有8个质子,10个中子的核素,用核素符号表示为______ 。元素B被科学家称“防癌之王”,与元素A同主族位于第四周期,元素B的名称为______ ,A和B的氢化物,沸点较高的是_____ (填化学式)。
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为______ 。
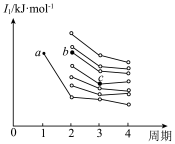
(3)如图是前四周期主族元素第一电离能梯度图,图中a点对应的元素为氢,则b点对应元素的未成对电子数为______ ,c点对应元素基态原子价电子排布式为_______ 。
(4)FeC13晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因是____ 。
(5)水果中含有不同的果酸,其中柠檬、柑橘等水果中含有柠檬酸,柠檬酸的结构如下图。柠檬酸的晶体类型为_____ ,碳原子的杂化轨道类型为_____ ;柠檬酸晶体中含有的作用力有___________ 。

(1)元素A含有8个质子,10个中子的核素,用核素符号表示为
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为
(3)如图是前四周期主族元素第一电离能梯度图,图中a点对应的元素为氢,则b点对应元素的未成对电子数为

(4)FeC13晶体易溶于水、乙醇,用酒精灯加热即可气化,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因是
(5)水果中含有不同的果酸,其中柠檬、柑橘等水果中含有柠檬酸,柠檬酸的结构如下图。柠檬酸的晶体类型为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】科学家开发出了多种太阳能电池,除晶体硅太阳能电池外,还有GaAs太阳能电池、铜铟镓硒薄膜太阳能电池等。
(1)基态Ga原子的电子排布式为________ 。
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因________________ 。
(3)H2Se分子的键角_______ H2O分子的键角(选填“>”、“=”或“<”)。写出与SeO3互为等电子体的一种阴离子_____________ (写化学式)。
(4) AsF3分子的立体构型为__________ ;AsF3是极性分子,理由是_________________ 。
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有__________________ 。
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:
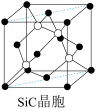
金刚砂中硅原子的杂化轨道类型为_______ ,沿晶胞图中虚线方向的切面图为__________ (填标号)。

(1)基态Ga原子的电子排布式为
(2)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因
(3)H2Se分子的键角
(4) AsF3分子的立体构型为
(5)Ga(OH)3与NaOH溶液反应生成Na[Ga(OH)4]。Na[Ga(OH)4]溶液中含有的化学键有
A.共价键 B.离子键 C.金属键 D.配位键 E.氢键
(6)金刚砂(SiC)晶胞如图所示:

金刚砂中硅原子的杂化轨道类型为

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H—N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为N2H4+HNO2=2H2O+HN3。HN3的酸性和醋酸相近,可微弱电离出H+和N3-。试回答下列问题:
(1)下列有关说法正确的是___ (填序号)。
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显___ 价;根据价层电子对互斥理论判断SO42-的空间构型为___ 。
(3)与N3-互为等电子体的分子有___ (写两种即可)。
(1)下列有关说法正确的是
A.HN3中含有5个σ键
B.HN3中的三个氮原子均采用sp2杂化
C.HN3、HNO2、H2O、N2H4都是极性分子
D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键
(2)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,在该配合物中钴显
(3)与N3-互为等电子体的分子有
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】第四周期中的18种元素具有重要的用途。
(1)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为_______ ,中心原子的杂化类型为_______ 。
(2)第四周期VA-ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示)_______ 。
(3)金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni (NH3)6]2+等。写出一种与配体CO互为等电子体的阴离子_______ ;配体NH3分子的空间构型为_______ 。
(4)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为_______ ,第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但Ga的第一电离能却明显低于Zn,原因是_______ 。
(1)已知四溴化锗是电子工业中的一种常用试剂,其熔点为26.1℃,沸点为186℃,则GeBr4晶体类型为
(2)第四周期VA-ⅦA族的元素中,电负性由大到小的顺序为(用元素符号表示)
(3)金属镍在材料科学上也有重要作用,它易形成配合物,如:Ni(CO)4、[Ni (NH3)6]2+等。写出一种与配体CO互为等电子体的阴离子
(4)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价电子排布式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子中,电子填充的能量最高的能级符号为_______ 。
(2)在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是:
,从电子排布的角度分析,其主要原因是:_______ 。
(3)铁氰化钾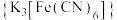 溶液是检验
溶液是检验 常用的试剂。lmol
常用的试剂。lmol 含σ键的数目为
含σ键的数目为_______ 。
(4) 的一种配离子
的一种配离子 中,
中, 的配位数是
的配位数是_______ 。配体 中心原子的杂化类型为
中心原子的杂化类型为_______ 。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO的熔点较高的原因_______ 。
(1)基态Fe原子中,电子填充的能量最高的能级符号为
(2)在空气中FeO稳定性小于
 ,从电子排布的角度分析,其主要原因是:
,从电子排布的角度分析,其主要原因是:(3)铁氰化钾
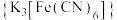 溶液是检验
溶液是检验 常用的试剂。lmol
常用的试剂。lmol 含σ键的数目为
含σ键的数目为(4)
 的一种配离子
的一种配离子 中,
中, 的配位数是
的配位数是 中心原子的杂化类型为
中心原子的杂化类型为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】[化学——选修3:物质结构与性质]X、Y、Z、W、R五种短周期非金属元素原子序数依次增大,X、Y、Z、W为同周期元素且未成对电子数之比为1:2:3:2,R和Z同主族。请回答下列问题:
(1)Z的基态原子的价层电子排布图为______________________________ 。
(2)Z、W、R 三种元素的电负性由大到小的顺序为_____________ (用元素符号表示)。
(3)W的常见氢化物的氢键的键能小于HF氢键的键能,但W的常见氢化物常温下为液态而HF常温下为气态的原因是_______________________________ 。
(4)某种分子式为Y4Z4W8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为_________________________ 。
(5)XR是一种耐磨材料,可由X的三溴化物和R的三溴化物于高温下在氧气的氛围中合成。
①X的三溴化物分子中X原子的杂化方式为_______________ ,R的三溴化物分子的空间构型的名称为_____________________ 。
②合成XR的化学方程式为_____________________ 。
(6)Y与W形成的某种常见化合物的晶胞如图, 该晶体中分子的配位数为
该晶体中分子的配位数为__________________ ,若晶胞的棱长为a nm,阿伏伽德罗常数的值为NA,晶体的密度为______ g/cm3。
(1)Z的基态原子的价层电子排布图为
(2)Z、W、R 三种元素的电负性由大到小的顺序为
(3)W的常见氢化物的氢键的键能小于HF氢键的键能,但W的常见氢化物常温下为液态而HF常温下为气态的原因是
(4)某种分子式为Y4Z4W8的物质(该物质中同种原子的化学环境完全相同,不含碳碳双键)是一种威力极强的炸药,则可推知其结构简式为
(5)XR是一种耐磨材料,可由X的三溴化物和R的三溴化物于高温下在氧气的氛围中合成。
①X的三溴化物分子中X原子的杂化方式为
②合成XR的化学方程式为
(6)Y与W形成的某种常见化合物的晶胞如图,
 该晶体中分子的配位数为
该晶体中分子的配位数为
您最近一年使用:0次



