(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________ 。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________ 。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
下列说法正确的是___________ 。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________ 。
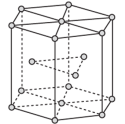
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________ (填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________ (填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________ ;Al晶体的密度为__________ g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。
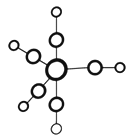
①Fe(CO)5晶体类型属于__________ 晶体。
②关于Fe(CO)5,下列说法正确的是_____ 。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
| 元素 | C1 | Br | I | O | O- |
| 电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是
③冰晶石溶液中不存在的微粒间作用力有
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏伽德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于
②关于Fe(CO)5,下列说法正确的是
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
2019·山东·一模 查看更多[6]
山东省青岛市平度市2020届高三3月高考模拟化学试卷(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编山东省青岛市莱西第一中学2020届高三下学期质量检测化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(三)四川省泸县第五中学2020届高三上学期开学考试理综化学试题【校级联考】山东省实验中学、淄博实验中学、烟台一中、莱芜一中四校2019届高三下学期第一次联合模拟考试理科综合化学试题
更新时间:2019-05-13 17:35:33
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】实验室常利用“棕色环”现象检验 离子。其方法为:取含有
离子。其方法为:取含有 的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
(1)形成“棕色环”主要发生如下反应:
3[Fe(H2O)6]2++ +4H+=3[Fe(H2O)6]3++NO↑+2H2O
+4H+=3[Fe(H2O)6]3++NO↑+2H2O
[Fe(H2O)6]2++NO=[Fe(NO)(H2O)5]2+(棕色)+H2O
[Fe(NO)(H2O)5]2+中,配位数为___________ 。
(2)与 互为等电子体的微粒是
互为等电子体的微粒是___________ (任写一例)。
(3) 的空间构型是
的空间构型是___________ ,其中N原子的杂化方式是___________ 。
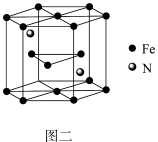
(4)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①γ-铁的原子堆积方式为___________ 。α-Fe、δ-Fe晶胞中铁原子个数比为___________ 。
②已知γ-铁晶体密度为dg/cm3,则Fe原子的半径为___________ nm(用含d、NA的式子表示)。
 离子。其方法为:取含有
离子。其方法为:取含有 的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:
的溶液于试管中,加入FeSO4溶液振荡,然后沿着试管内壁加入浓H2SO4,在溶液的界面上出现“棕色环”。回答下列问题:(1)形成“棕色环”主要发生如下反应:
3[Fe(H2O)6]2++
 +4H+=3[Fe(H2O)6]3++NO↑+2H2O
+4H+=3[Fe(H2O)6]3++NO↑+2H2O[Fe(H2O)6]2++NO=[Fe(NO)(H2O)5]2+(棕色)+H2O
[Fe(NO)(H2O)5]2+中,配位数为
(2)与
 互为等电子体的微粒是
互为等电子体的微粒是(3)
 的空间构型是
的空间构型是(4)铁原子在不同温度下排列构成不同晶体结构,在912℃以下排列构成的晶体叫做α-铁;在912℃至1394℃之间排列构成的晶体叫做γ-铁;在1394℃以上排列构成的晶体,叫做δ-铁。晶胞剖面结构如图所示:

①γ-铁的原子堆积方式为
②已知γ-铁晶体密度为dg/cm3,则Fe原子的半径为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】多尺度复杂化学系统模型可以用量子化学计算小区间内(如生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①乙炔是__________ (填“非极性”或“极性”)分子。
②碳负离子CH3-的立体构型为____________ 。
③根据等电子原理,NO+的电子式为________________ 。
(2)钒可用于合成电池电极,也可用于人工合成二价的钒固氮酶(结构如图a)。

①V2+基态时核外电子排布式为____________________________________________ 。
②钒固氮酶中钒的配位原子有_____________________________ (填元素符号)。
(3)烟酰胺(结构如图b)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有_______________________ ,1 mol该分子中含σ键的数目为________ 。
(4)12 g石墨烯(结构如图c)中含有的正六边形数目约为________ ;请你预测硅是否容易形成类似石墨烯的结构,并说明理由:___________________________________ 。
(1)固氮酶有铁蛋白和钼铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①乙炔是
②碳负离子CH3-的立体构型为
③根据等电子原理,NO+的电子式为
(2)钒可用于合成电池电极,也可用于人工合成二价的钒固氮酶(结构如图a)。

①V2+基态时核外电子排布式为
②钒固氮酶中钒的配位原子有
(3)烟酰胺(结构如图b)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有
(4)12 g石墨烯(结构如图c)中含有的正六边形数目约为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】明朝《天工开物》中有世界上最早的“火法”炼锌技术的记载。锌及其化合物在生产、生活中有着重要的用途。锌是生命体必需的微量元素,被称为“生命之花”。
(1)基态Zn原子核外电子共有____ 种空间运动状态。
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是____ (填字母)。
(3)锌在潮湿的空气中极易生成一层紧密的碱式碳酸锌[ZnCO3·3Zn(OH)2]薄膜,使其具有抗腐蚀性。其中CO 的空间构型为
的空间构型为____ (用文字描述)。与CO 互为等电子体的分子是
互为等电子体的分子是____ (写一种即可)。
(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为____ ,其中C原子的杂化方式为____ 。
②1mol葡萄糖酸分子中含有____ molσ键。葡萄糖酸的熔点小于葡萄糖酸锌的熔点原因是____ 。
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的____ 空隙中;
②六方ZnS的晶体密度为____ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)基态Zn原子核外电子共有
(2)锌与铜在周期表中的位置相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10失去1个电子需要的能量由大到小排序是
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |
 的空间构型为
的空间构型为 互为等电子体的分子是
互为等电子体的分子是(4)葡萄糖酸锌为有机锌补剂,对胃黏膜刺激小,在人体中吸收率高。如图是葡萄糖酸锌的结构简式。

①葡萄糖酸锌组成元素中电负性最大的元素为
②1mol葡萄糖酸分子中含有
(5)ZnS是一种性能优异的荧光材料,在自然界中有立方ZnS和六方ZnS两种晶型,其晶胞结构如图所示:

①立方ZnS中,Zn2+填充在S2—形成的
②六方ZnS的晶体密度为
您最近一年使用:0次
【推荐1】氨基酸微量元素螯合物在饲料生产应用、解决过量添加无机盐造成环境污染等方面有重要应用。该类螯合物通常以蛋氨酸、赖氨酸、甘氨酸等为配位体,以铜、铁、锌、锰、铬、钴等元素为中心离子。
(1)甘氨酸中共有_____ 个σ键,所含元素的电负性由大到小的顺序为______ ,官能团中C原子的杂化方式为_______ 。
(2)上述金属元素中,基态原子有五个未成对电子的原子的核外电子排布式为______ 。
(3)蛋氨酸铜的结构式如下图。该螯合物中含有的化学键类型有_________ (填序号)。
a.配位键 b.极性键 c.离子键 d.非极性键

(4)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。某化合物的化学式为Na3CrO8,其阴离子结构可表示为 ,则Cr的化合价为
,则Cr的化合价为______ 。 呈四面体构型,结构为
呈四面体构型,结构为 ,
, 由两个
由两个 四面体组成,这两个
四面体组成,这两个 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为 。则由n(n>1)个
。则由n(n>1)个 通过顶角氧原子连结的链式结构的化学式为
通过顶角氧原子连结的链式结构的化学式为____ 。
(5)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是____ ;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的 结构如下图所示(K+未画出),则一个晶胞中的K+个数为
结构如下图所示(K+未画出),则一个晶胞中的K+个数为____ 。

(1)甘氨酸中共有
(2)上述金属元素中,基态原子有五个未成对电子的原子的核外电子排布式为
(3)蛋氨酸铜的结构式如下图。该螯合物中含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键

(4)Cr是周期表中第ⅥB族元素,化合价可以是0~+6的整数价态。某化合物的化学式为Na3CrO8,其阴离子结构可表示为
 ,则Cr的化合价为
,则Cr的化合价为 呈四面体构型,结构为
呈四面体构型,结构为 ,
, 由两个
由两个 四面体组成,这两个
四面体组成,这两个 四面体通过共用一个顶角氧原子彼此连接,结构为
四面体通过共用一个顶角氧原子彼此连接,结构为 。则由n(n>1)个
。则由n(n>1)个 通过顶角氧原子连结的链式结构的化学式为
通过顶角氧原子连结的链式结构的化学式为(5)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3 与KSCN溶液混合,可得到配位数为5的配合物的化学式是
 结构如下图所示(K+未画出),则一个晶胞中的K+个数为
结构如下图所示(K+未画出),则一个晶胞中的K+个数为
您最近一年使用:0次
【推荐2】钛有“生物金属”和“未来金属”之称,钛及其化合物的应用正越来越受到人们的关注。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,固态T'iCl4属于________ 晶体。
②LiBH4中BH4-的空间构型是_________ ,B原子的杂化轨道类型是________ 。
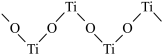
(2)硫酸氧钛晶体中阳离子为链状聚合形式的离子,部分结构如图所示。该阳离子Ti与O的原子个数之比为________ ,其化学式为_____________________ 。
(3)钛与卤素形成的化合物的熔、沸点如表所示,分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定规律的原因:______________________________ 。
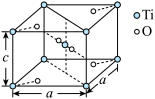
(4)TiO2晶胞是典型的四方系结构,其晶胞结构如图所示,晶胞参数为a nm和c nm,设NA为阿伏加 德罗常数的值,该晶体的密度为___________ (写出表达式)g·cm-3。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃,固态T'iCl4属于
②LiBH4中BH4-的空间构型是
(2)硫酸氧钛晶体中阳离子为链状聚合形式的离子,部分结构如图所示。该阳离子Ti与O的原子个数之比为

(3)钛与卤素形成的化合物的熔、沸点如表所示,分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定规律的原因:
熔点/℃ | 沸点/℃ | |
TiCl4 | -25 | 136. 5 |
TiBr4 | 39 | 230 |
TiI4 | 150 | 377 |

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】铁、钴均为第四周期第Ⅷ族元素,它们的单质及化合物具有广泛用途。回答下列问题:
(1)基态Co2+中的未成对电子数为___ ;Fe和Co的第四电离能I4(Fe)___ I4(Co)(填“>”、“<”或“=”)。
(2)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为___ ;已知孤电子对与成键电子的排斥作用大于成键电子对与成键电子的排斥作用,试判断NH3分子与钴离子形成配合物后H—N—H键角___ (填“变大”、“变小”或“不变”)。
(3)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
①丙酮(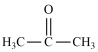 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是___ ,1mol丙酮分子中含有σ键的数目为___ 。
②C、H、O三种元素的电负性由小到大的顺序为___ 。
③乙醇的沸点高于丙酮,这是因为___ 。
(4)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。
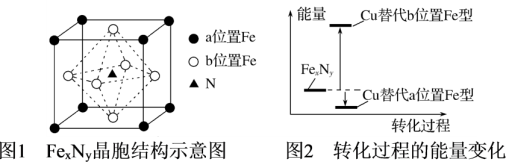
①该结构中单纯分析铁的堆积,其堆积方式为___ 。
②其中更稳定的Cu替代型产物的化学式为____ 。
③若更稳定的Cu替代型产物的密度为ρg/cm3,则该晶胞中相邻的两个Fe原子的距离为___ nm。
(1)基态Co2+中的未成对电子数为
(2)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为
(3)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
①丙酮(
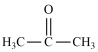 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是②C、H、O三种元素的电负性由小到大的顺序为
③乙醇的沸点高于丙酮,这是因为
(4)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。

①该结构中单纯分析铁的堆积,其堆积方式为
②其中更稳定的Cu替代型产物的化学式为
③若更稳定的Cu替代型产物的密度为ρg/cm3,则该晶胞中相邻的两个Fe原子的距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】磷及其化合物在工业生产中起着重要的作用。
(1)磷在元素周期表中的位置是______ ;基态磷原子价电子排布式______ 。
(2)磷元素有白磷、黑磷等常见的单质。
①白磷(P4)是分子晶体,易溶于CS2,难溶于水,可能原因是______ 。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是______ (填字母序号)。

a.黑磷与白磷互为同分异构体 b.黑磷属于混合型晶体
c.黑磷能导电 d.黑磷中磷原子采取sp2杂化
(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-,此配离子中______ (填写化学式)是中心离子,PO 空间构型是
空间构型是______ 。
(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟的熔点分别为2000℃、1070℃,从结构角度说明其熔点差异的原因______ 。
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是______ 。

(1)磷在元素周期表中的位置是
(2)磷元素有白磷、黑磷等常见的单质。
①白磷(P4)是分子晶体,易溶于CS2,难溶于水,可能原因是
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是

a.黑磷与白磷互为同分异构体 b.黑磷属于混合型晶体
c.黑磷能导电 d.黑磷中磷原子采取sp2杂化
(3)Fe3+与水会形成黄色的配离子[Fe(OH)]2+,为避免颜色干扰,常在Fe3+溶液中加入H3PO4形成无色的[Fe(PO4)2]3-,此配离子中
 空间构型是
空间构型是(4)第IIIA族磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①实验测定磷化铝和磷化铟的熔点分别为2000℃、1070℃,从结构角度说明其熔点差异的原因
②磷化硼是一种半导体材料,晶胞结构如图所示,磷化硼的化学式是

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硅元素广泛应用于半导体、光伏、塑料工业。回答下列问题:
(1)同周期元素中,成对电子数比硅多的元素有___________ 种。
(2)晶体硅和碳化硅的熔点相比,较高的是________ (填化学式),原因是_______ 。
(3)由于硅的价层有d轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物 (平面形)和
(平面形)和 中,更易形成配合物的是
中,更易形成配合物的是_______ (填化学式);下列划线原子与 中N原子杂化类型相同的是
中N原子杂化类型相同的是_________ (填序号)。
A.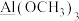 B.
B. C.
C.
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a ,侧面棱长为c
,侧面棱长为c ),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。

① 原子构成正四面体,则A原子的分数坐标为
原子构成正四面体,则A原子的分数坐标为___________ 。
②该新型材料的化学式为___________ ,已知该新型材料的摩尔质量为M ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则密度为
表示,则密度为___________  (用含a、c、M、
(用含a、c、M、 的计算式表示)。
的计算式表示)。
(1)同周期元素中,成对电子数比硅多的元素有
(2)晶体硅和碳化硅的熔点相比,较高的是
(3)由于硅的价层有d轨道可以利用,而碳没有,因此化合物的结构具有较大差异:化合物
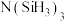 (平面形)和
(平面形)和 中,更易形成配合物的是
中,更易形成配合物的是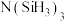 中N原子杂化类型相同的是
中N原子杂化类型相同的是A.
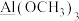 B.
B. C.
C.
(4)一种钛硅碳新型材料可用作高铁车体与供电网的连接材料。该材料的晶胞属于六方晶系(x、y方向的夹角为120°,z方向垂直于x、y方向,底面棱长均为a
 ,侧面棱长为c
,侧面棱长为c ),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
),其晶胞结构如图乙所示,晶胞中碳原子的投影位置如图甲所示。
①
 原子构成正四面体,则A原子的分数坐标为
原子构成正四面体,则A原子的分数坐标为②该新型材料的化学式为
 ,阿伏加德罗常数的值用
,阿伏加德罗常数的值用 表示,则密度为
表示,则密度为 (用含a、c、M、
(用含a、c、M、 的计算式表示)。
的计算式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】一水合甘氨酸锌是一种饲料添加剂,结构简式如图所示:

回答下列问题:
(1)基态Zn原子价电子排布图为______ ;一水合甘氨酸锌中Zn2+的配位数为______ 。
(2)甘氨酸(H2N—CH2—COOH)易溶于水,其原因为______ 。
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:ZnO+2NH3+2NH =[Zn(NH3)4]2++H2O。NH
=[Zn(NH3)4]2++H2O。NH 的空间构型为
的空间构型为______ ,与NH 互为等电子体的分子为
互为等电子体的分子为______ (写出1种即可)。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为 ,则1molIMI中含有
,则1molIMI中含有______ molσ键,IMI的某种衍生物与甘氨酸形成的离子晶体 熔点较低,其原因是
熔点较低,其原因是______ 。
(5)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,则Zn的密度为______ g·cm-3(列出计算式)。

回答下列问题:
(1)基态Zn原子价电子排布图为
(2)甘氨酸(H2N—CH2—COOH)易溶于水,其原因为
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:ZnO+2NH3+2NH
 =[Zn(NH3)4]2++H2O。NH
=[Zn(NH3)4]2++H2O。NH 的空间构型为
的空间构型为 互为等电子体的分子为
互为等电子体的分子为(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为
 ,则1molIMI中含有
,则1molIMI中含有 熔点较低,其原因是
熔点较低,其原因是(5)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,则Zn的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】我国科学家团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破。请根据材料回答以下问题:
(1)基态N原子的价电子占据的能量最高的能级是___ ,价电子在该能级上的排布遵循的原则是__ 。
(2)除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等物质。而高聚氮结构具有空间网状结构,如图一所示,则N70的沸点___  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 高聚氮的沸点,原因是
高聚氮的沸点,原因是___ ;
(3)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。与全氮阴离子互为等电子体的一种非极性分子的结构式为___ 。叠氮化物能形成多种配合物,在[CO(N3)(NH3)5]SO4,其中钴原子的配体是___ ,SO42-的立体构型为___ 。
(4)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是____ 。
A.酸性:HNO2>HNO3
B.N2H4分子中N原子均采取sp3杂化
C.NaN3的晶格能大于KN3的晶格能
D.纯叠氮酸HN3在常温下是一种液体,是因为分子中存在一种特殊的化学键-氢键
(5)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V形,每个氮原子均达到8电子稳定结构,则阳离子的电子式为___ 。
(6)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加 德罗常数的值,则该晶体的密度为__ 。
(1)基态N原子的价电子占据的能量最高的能级是
(2)除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等物质。而高聚氮结构具有空间网状结构,如图一所示,则N70的沸点
 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 高聚氮的沸点,原因是
高聚氮的沸点,原因是
(3)叠氮化物是研究较早的含全氮阴离子的化合物,如:氢叠氮酸(HN3)、叠氮化钠(NaN3)等。与全氮阴离子互为等电子体的一种非极性分子的结构式为
(4)HN3是一种全氮阴离子酸,可由肼(N2H4)被HNO2氧化制得。下列说法正确的是
A.酸性:HNO2>HNO3
B.N2H4分子中N原子均采取sp3杂化
C.NaN3的晶格能大于KN3的晶格能
D.纯叠氮酸HN3在常温下是一种液体,是因为分子中存在一种特殊的化学键-氢键
(5)N8是一种由全氮阳离子和全氮阴离子构成的特殊物质,已知阳离子由5个氮原子排列成V形,每个氮原子均达到8电子稳定结构,则阳离子的电子式为
(6)一种氮铁化合物的结构如图二所示,若图中六棱柱的体积为Vcm3,用NA表示阿伏加 德罗常数的值,则该晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】钛被视为继铁、铝之后的第三金属,也有人说“21世纪将是钛的世纪”,钛和钛的化合物在航天、化工、建筑、医疗中都有着广泛的用途。回答下列问题:
(1)基态钛原子核外有___________ 种能量不同的电子, 的电子排布式为
的电子排布式为___________ 。
(2)钛与卤素形成的化合物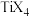 熔点如下表
熔点如下表
它们熔点差异的原因___________ 。
(3) 是一种储氢材料,可由
是一种储氢材料,可由 和
和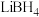 反应制得。
反应制得。
① 与
与 互为等电子体,
互为等电子体, 的空间构型为
的空间构型为______ 。
②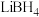 由
由 和
和 构成,
构成, 中B原子的杂化类型是
中B原子的杂化类型是______ ,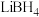 所含元素电负性由小到大的顺序为
所含元素电负性由小到大的顺序为______
③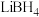 中存在的作用力为
中存在的作用力为______ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(4)有一种氮化钛晶体的晶胞与 晶胞相似,该晶体的晶胞参数为
晶胞相似,该晶体的晶胞参数为 ,其晶体密度的计算表达式为
,其晶体密度的计算表达式为_______  。用
。用 掺杂
掺杂 后,其晶胞结构如下图所示,距离
后,其晶胞结构如下图所示,距离 最近的
最近的 有
有______ 个。( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

(1)基态钛原子核外有
 的电子排布式为
的电子排布式为(2)钛与卤素形成的化合物
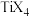 熔点如下表
熔点如下表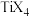 |  |  | 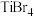 |  |
| 熔点℃ | 377 |  | 38.3 | 153 |
(3)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和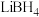 反应制得。
反应制得。①
 与
与 互为等电子体,
互为等电子体, 的空间构型为
的空间构型为②
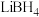 由
由 和
和 构成,
构成, 中B原子的杂化类型是
中B原子的杂化类型是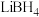 所含元素电负性由小到大的顺序为
所含元素电负性由小到大的顺序为③
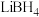 中存在的作用力为
中存在的作用力为A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(4)有一种氮化钛晶体的晶胞与
 晶胞相似,该晶体的晶胞参数为
晶胞相似,该晶体的晶胞参数为 ,其晶体密度的计算表达式为
,其晶体密度的计算表达式为 。用
。用 掺杂
掺杂 后,其晶胞结构如下图所示,距离
后,其晶胞结构如下图所示,距离 最近的
最近的 有
有 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】铜是应用广泛的金属单质。硫酸铜晶体(CuSO4•5H2O),俗称蓝矾、胆矾,具有催吐、解毒作用,同时也是一种重要的化工原料,具有十分广泛的应用。
(1)Cu的价电子排布式为____ 。
(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是____ 。
(3)已知CuSO4在碱性条件下加入双缩脲HN(CONH2)2中,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。

①该-2价的配位阴离子中sp3杂化的原子与sp2杂化的原子个数之比为____ (不考虑羰基氧的杂化)。
②该-2价的配位阴离子中Cu的配位数为____ 。
(4)卤化亚铜的熔点如表所示,CuF熔点高于其他三种卤化物,自CuCl至CuI熔点依次升高,原因是____ ;CuI的晶体类型为____ 。
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。

①原子B的坐标参数为____ 。
②若该晶体的密度为dg•cm-3,晶胞参数为anm,则阿伏加德罗常数值NA=____ (用含a、d的代数式表示)。
(1)Cu的价电子排布式为
(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是
(3)已知CuSO4在碱性条件下加入双缩脲HN(CONH2)2中,会得到紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。

①该-2价的配位阴离子中sp3杂化的原子与sp2杂化的原子个数之比为
②该-2价的配位阴离子中Cu的配位数为
(4)卤化亚铜的熔点如表所示,CuF熔点高于其他三种卤化物,自CuCl至CuI熔点依次升高,原因是
| 化合物 | CuF | CuCl | CuBr | CuI |
| 熔点/℃ | 908 | 426 | 498 | 605 |

①原子B的坐标参数为
②若该晶体的密度为dg•cm-3,晶胞参数为anm,则阿伏加德罗常数值NA=
您最近一年使用:0次



