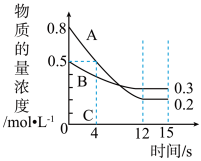
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L−1·s−1;乙:v(B)=0.12 mol·L−1·s−1;丙:v(C)=9.6 mol·L−1·min−1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题。
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5 mL 5% H2O2溶液,各滴入1~2 滴1 mol/L FeCl3溶液。待试管中均有适量气泡出现时,将试管A放入盛有5 ℃左右冷水的烧杯中;将试管B放入盛有40 ℃左右热水的烧杯中 | 试管A中不再产生气泡试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入5 mL 5% H2O2溶液和5 mL 10% H2O2溶液 | 试管A、B中均未见气泡产生 |
(4)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是
相似题推荐
(1)写出盐酸与大理石反应的化学方程式
(2)请完成以下实验设计表,并把实验中空缺处补充完整:
| 实验 编号 | 温度 (℃) | 大理石 规格 | HCl浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.50 | (I)实验①和②探究温度对反应速率的影响; (II)实验①和③探究浓度对反应速率的影响; (III)实验①和④探究 |
| ② | 粗颗粒 | 2.50 | ||
| ③ | 25 | 粗颗粒 | ||
| ④ | 25 | 细颗粒 | 2.50 |
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H1=- 890.3 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
C(s)+O2(g)=CO2(g) △H3=- 393.5 kJ/mol
C(s)+2H2(g)=CH4(g) △H=
(2) CH4制备合成气的原理是CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。①下列叙述不能表示该反应在恒温恒容条件下达到平衡状态的是
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中CO2、CO的物质的量的比值不再发生变化
d.混合气体的平均相对分子质量不再发生变化
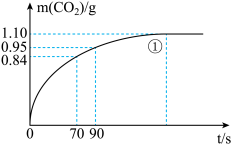
②若1 g CH4(g)完全反应吸收热量为15.5 kJ。在恒容密闭容器中充入1 mol CH4和1 mol CO2在一定条件下反应,体系吸收热量随着时间变化如图所示。在该条件下,甲烷的最大转化率(a)为

(3)在密闭容器中只发生反应:2NO+H2=N2+2H2O,其反应速率与浓度关系式为v=kcm(NO)·cn(H2)。(k为常数,只与温度有关,m、n为反应级数,取正整数),在某温度下测得有关数据如表所示。
序数 | c(NO)/(mol/L) | c(H2)/(mol/L) | v/mol/(L·min ) |
I | 0.10 | 0.10 | 0.414 |
Ⅱ | 0.20 | 0.20 | 3.312 |
Ⅲ | 0.10 | 0.20 | 0.828 |
总反应分两步进行:第i步,2NO+H2=N2+H2O2(很慢);
第ii 步,H2O2+H2=2H2O (很快)。在上述温度下,当c(NO)=c(H2)=0.50 mol/L 时v=
(4)在2 L恒容密闭容器中充入3 mol NO(g)和3 mol CO(g),发生反应: 2NO(g)+2CO(g)
 N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol/L。则该条件下平衡常数K值为
N2(g)+2CO2(g),在一定温度下达到平衡,测得平衡体系中c(N2)=0.5 mol/L。则该条件下平衡常数K值为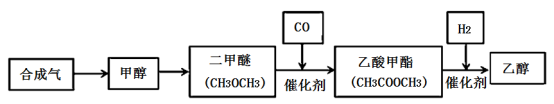
(1)制备甲醇的原理为CO(g)+2H2(g)
 CH3OH(g),反应过程中物质能量变能化如图所示,生产中为同时提高甲醇的产率和反应速率,可采取措施是
CH3OH(g),反应过程中物质能量变能化如图所示,生产中为同时提高甲醇的产率和反应速率,可采取措施是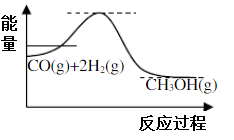
(2)若该反应加入催化剂,请在答题纸图中画出反应过程中物质能量变化曲线
(3)制备二甲醚的原理为2CH3OH(g)= CH3OCH3(g)+H2O(g)。写出该反应的化学平衡常数表达式为
(4)CH3COOCH3和H2制备乙醇的反应中,还有另一产物生成,该物质在上述转化路线中循环使用,其分子式为
(5)设计实验证明乙醇中是否含有CH3COOCH3
(1)NH3催化还原NOx是目前应用最广泛的烟气氮氧化物脱除技术。已知
①4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H1
2N2(g)+6H2O(g) △H1②N2(g)+O2(g)
 2NO(g) △H2
2NO(g) △H2③H2O(g)=H2O(l) △H3
则反应4NH3(g)+6NO(g)
 5N2(g)+6H2O(l) △H=
5N2(g)+6H2O(l) △H=(2)科学家用活性炭还原法可以消除NO的污染,发生的反应为C(s)+2NO(g)
 N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。
N2(g)+CO2(g)。1 mol NO和足量的活性炭在T℃、1 L恒容密闭容器中反应,10 min后达到平衡,测得NO的物质的量为0.5 mol。①10 min内,v(N2)=
②在恒容绝热条件下,下列能判断该反应一定达到化学平衡状态的是
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)已知:25℃时,HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.8×10-5 mol·L-1.实验室可用NaOH溶液吸收NO2,生成NaNO3和NaNO2。
①已知溶液甲为0.1 mol·L-1 NaNO3和0.1 mol·L-1 NaNO2的混合溶液,溶液乙为0.1 mol·L-1的CH3COONa溶液,则两溶液中c(
 )、c(
)、c( )和c(CH3COO-)由大到小的顺序为
)和c(CH3COO-)由大到小的顺序为a.向溶液甲中加适量NaOH b.向溶液甲中加适量水
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
②一定温度下,等体积、等物质的量浓度CH3COONa和NaNO2两溶液中阴离子的总物质的量分别为n1、n2,则n1
 是一种新型硝化剂,氧化剂。在化工生产中有重要的意义。
是一种新型硝化剂,氧化剂。在化工生产中有重要的意义。(1)已知
 在一定温度下新会分解,反应方程式如下:
在一定温度下新会分解,反应方程式如下: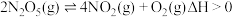 。
。①后应达平衡后,其他条件不变时,升高温度,则
 的转化率将
的转化率将②下表为反应在
 温度下的部分实转数据:
温度下的部分实转数据:| t/min | 0 | 2 | 5 |
 | 5.00 | 3.52 | 2.68 |
 的平均及应速率
的平均及应速率(2)工业上常用
 与
与 来制取
来制取 ,方程式为:
,方程式为: 。在
。在 温度下将1mol
温度下将1mol 与2mol
与2mol 充入到10L密闭容器中,测得
充入到10L密闭容器中,测得 的物质的量随时间变化如下图。
的物质的量随时间变化如下图。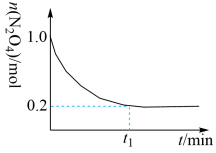
在
 温度下,且起始
温度下,且起始 ,欲缩短到平衡所需时间,可采取的措施有
,欲缩短到平衡所需时间,可采取的措施有(3)
 有毒,常用氨处理,已知1g气态
有毒,常用氨处理,已知1g气态 与氨反应生成氮气和气态水,放出akj(a>0)的热量,写出该反应的热化学方程式
与氨反应生成氮气和气态水,放出akj(a>0)的热量,写出该反应的热化学方程式 、
、 浓度对化学反应速率的影响。
浓度对化学反应速率的影响。已知:
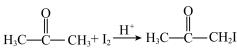 +2HI
+2HI| 编号 | 丙酮溶液(4mol/L) |  溶液(0.0025mol/L) 溶液(0.0025mol/L) | 盐酸(2mol/L) | 蒸馏水 | 溶液褪色时间(s) |
| ① | 2mL | 2mL | 2mL | 0mL |  |
| ② | 1mL | 2mL | 2mL | 1mL |  |
| ③ | 2mL | 1mL | 2mL | 1mL |  |
| ④ | 2mL | 2mL | a_mL | 1mL |  |
(1)研究丙酮浓度对反应速率的影响,应选择的实验组为
(2)实验④中,

 ,加
,加 蒸馏水的目的是
蒸馏水的目的是(3)计算实验③中,以
 表示的反应速率为
表示的反应速率为 (列出表达式)。
(列出表达式)。(4)通过计算发现规律:丙酮碘化反应的速率与丙酮和
 的浓度有关,而与
的浓度有关,而与 的浓度无关,查阅资料发现丙酮碘化反应的历程为:
的浓度无关,查阅资料发现丙酮碘化反应的历程为: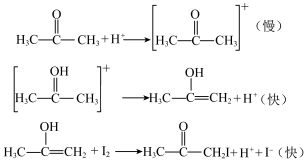
请依据反应历程,解释丙酮碘化反应速率与
 浓度无关的原因
浓度无关的原因(5)温度升高至100℃时,纯水的pH=6,此时溶液呈
 NaOH溶液的pH=
NaOH溶液的pH=【推荐1】(1)3.2g硫完全燃烧生成稳定的氧化物放出297.2kJ,写出硫燃烧热的热化学方程式:
(2)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g) 2NH3(g)△H;已知每破坏1mol有关化学键需要的能量如下表:
2NH3(g)△H;已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
则△H=
(3)在某一容积为2L的恒容密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化曲线如图所示。回答下列问题:
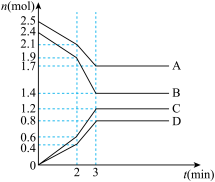
①该反应的化学方程式为
②在2min时,图像发生改变的原因可能是
A.增大B的物质的量B.降低温度
C.加入催化剂D.减小A的物质的量
③不同条件下的该反应的速率:①v(A)=1.0mol·L-1·s-1,②v(B)=1.0 mol·L-1·s-1,③v(C)=1.2 mol·L-1·s-1,④v(D)=1.2mol·L-1·s-1。其中反应速率最快的是
 x C(g) +2D(g),2 min时反应达到平衡状态,此时剩余1. 2 mol B,并测得C的浓度为1.2 mol/L。
x C(g) +2D(g),2 min时反应达到平衡状态,此时剩余1. 2 mol B,并测得C的浓度为1.2 mol/L。(1)从开始反应至达到平衡状态,生成D的平均反应速率为
(2)x=
(3)A的转化率与B的转化率之比为
(4)保持容器内气体压强不变,向其中加入a mol He,则该反应的正反应速率
 CH3OH+H2O,在120℃时22gCO2发生上述反应,其反应过程的能量变化如图所示(单位为kJ·mol-1)。
CH3OH+H2O,在120℃时22gCO2发生上述反应,其反应过程的能量变化如图所示(单位为kJ·mol-1)。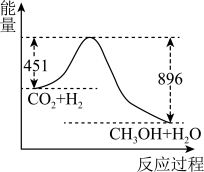
①该反应的热化学方程式为
②该反应平衡常数K的表达式为
③在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2反应,测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到达到化学平衡,v(H2)=
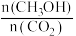 增大的有
增大的有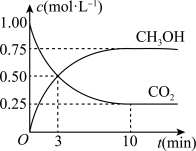
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.再充入3 mol H2 E.充入He(g),使体系总压强增大
(2)工业上常利用“隔膜电解法”处理高浓度乙醛废水。其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O=CH3CH2OH+CH3COOH。实验室按右图所示装置来模拟乙醛废水的处理(以一定浓度的乙醛和Na2SO4溶液为电解质溶液)。
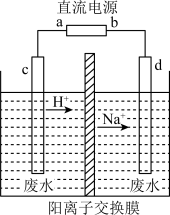
①若以甲醇碱性燃料电池为直流电源,则燃料电池中b极应通入
②电解池阳极区的电极反应式为
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入乙醛含量为3g/L的废水1 m3,可得到乙醇
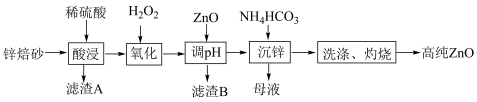
已知:相关金属离子c(Mn+)=0.1mol·L-1生成氢氧化物沉淀的pH如下表所示:
| Fe2+ | Fe3+ | Al3+ | Zn2+ | |
| 开始沉淀 | 6.5 | 2.7 | 3.4 | 6.5 |
| 沉淀完全 | 9.7 | 3.7 | 4.7 | 8.5 |
(1)“酸浸”时为了提高浸取速率,可以采取的措施是
(2)“氧化”步骤中发生的离子方程式为
(3)滤渣B的主要成分为
(4)“沉锌”反应中,往滤液加入NH4HCO3溶液,生成ZnCO3·Zn(OH)2及CO2,写出相应的离子方程式

已知:“水浸”后滤液中的阴离子主要是
 、
、 、
、 、
、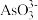 和
和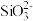 。
。(1)“焙烧”前需要将黑钨矿进行粉碎,其目的是
(2)写出“氧化”时发生反应的离子方程式:
(3)“滤渣2”主要是
(4)“操作X”是
(5)已知钨酸钙(CaWO4)微溶于水,钨酸难溶于水,请结合平衡移动原理解释利用盐酸进行“酸解”的原因:
(6)在实验室利用碘量法测定产品2中WCl6 [(易溶于CS2)的纯度,实验如下:
①将足量CS2(易挥发)加入干燥的称量瓶中,盖紧称量为ag;开盖并计时1min,盖紧称量为bg;再开盖加入待测样品并计时1min,盖紧称量为cg,则样品的质量为
②先将上面称量好的样品中的WCl6转化为可溶的Na2WO4通过
 离子交换柱发生反应:
离子交换柱发生反应: +Ba(IO3)2=BaWO4+2
+Ba(IO3)2=BaWO4+2 ;交换结束后,向所得含
;交换结束后,向所得含 的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2
的溶液中加入足量酸化的KI溶液,反应完全后用x mol·L-1 Na2S2O3标准溶液滴定,发生反应:I2+2 =2I-+
=2I-+ 。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为
。滴定终点时平均消耗Na2S2O3标准溶液的体积为VmL,则样品中WCl6的质量分数为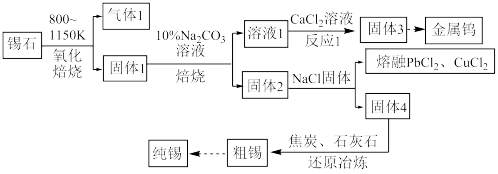
通过查阅资料,获得如下信息:
a.SnO2难溶于稀盐酸;b.CaWO4难溶于水。
请回答下列问题:
(1)氧化熔烧时加快反应速率的方法有
(2)工业中常用过量氨水吸收SO2尾气,涉及的化学方程式为
(3)下图是模拟电解精炼锡的装置图,请写出方框中相应物质
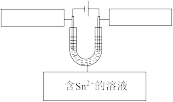
(4)通过下列过程可以测定金属锡样品的纯度:将试样溶于盐酸中,加入过量的FeCl3溶液将Sn2+氧化为Sn4+,再用已知浓度的K2Cr2O7溶液滴定生成的Fe2+。现有金属锡样品0.613g,经上述各步反应后,共用去0.100 mol•L-1 K2Cr2O7溶液16.00 mL,则该样品中锡的质量分数为

 N
N

