室温下,1 L含0.1 mol CH3COOH和0.1 mol CH3COONa的溶液a及加入一定量强酸或强碱后溶液的pH如下表(加入前后溶液体积不变):
像溶液a这样,加入少量强酸或强碱后pH变化不大的溶液称为缓冲溶液。
下列说法不正确 的是
| 溶液a | 通入0.01 mol HCl | 加入0.01 mol NaOH | |
| pH | 4.76 | 4.67 | 4.85 |
下列说法
| A.溶液a和 0.1 mol·L−1 CH3COOH溶液中CH3COOH的电离程度前者小于后者 |
| B.向溶液a中通入0.01 mol HCl时,CH3COO−结合H+生成CH3COOH,pH变化不大 |
| C.向溶液a中加入0.1 mol NaOH固体,pH基本不变 |
| D.含0.1 mol·L−1 NH3·H2O与0.1 mol·L−1 NH4Cl的混合溶液也可做缓冲溶液 |
20-21高三上·北京西城·期末 查看更多[13]
北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京首都师范大学附属中学2023届高三3月月考化学试题辽宁省朝阳市建平县实验中学2022-2023学年高二上学期月考化学试题北京市北京师范大学附属实验中学2022-2023学年高二上学期期中考试化学试题(已下线)北京市第四中学2021-2022学年高二上学期期末考试化学试题北京师范大学附属中学2021-2022学年高二上学期期末考试化学试题辽宁省葫芦岛市2021届高三上学期期末考试化学试题北京市第十二中学2020-2021学年高二上学期12月月考化学试题山东省济宁市嘉祥县第一中学2020届高三下学期第三模拟考试化学试题山东省临沂市临沂商城实验学校2020届高三新高考第七次阶段性模拟测试化学试题山东省济宁市第一中学2020届高三下学期二轮质量检测化学试题2020届高三化学二轮复习 化学反应速率 化学平衡(专题训练)北京市西城区2020届高三上学期期末考试化学试题
更新时间:2020-01-12 17:44:32
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列微粒不影响氢氟酸电离平衡的是
| A.H2O | B.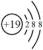 | C.HI | D. |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】在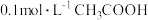 溶液中存在电离平衡:
溶液中存在电离平衡: ,关于该电离平衡的叙述正确的是
,关于该电离平衡的叙述正确的是
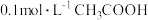 溶液中存在电离平衡:
溶液中存在电离平衡: ,关于该电离平衡的叙述正确的是
,关于该电离平衡的叙述正确的是A.加入少量纯 ,平衡正向移动,醋酸的电离程度增大 ,平衡正向移动,醋酸的电离程度增大 |
B.加入少量 溶液,平衡正向移动,电离平衡常数增大 溶液,平衡正向移动,电离平衡常数增大 |
C.加入少量 盐酸,平衡逆向移动,溶液中 盐酸,平衡逆向移动,溶液中 减小 减小 |
D.加热时,平衡正向移动,溶液 减小,电离平衡常数增大 减小,电离平衡常数增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】室温下,向 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,溶液中
溶液,溶液中 与
与 的关系如图所示(已知:
的关系如图所示(已知: 的
的 分别为
分别为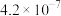 、
、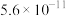 ;
; 的
的 为
为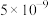 )。下列说法正确的是
)。下列说法正确的是

 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液,溶液中
溶液,溶液中 与
与 的关系如图所示(已知:
的关系如图所示(已知: 的
的 分别为
分别为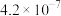 、
、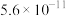 ;
; 的
的 为
为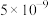 )。下列说法正确的是
)。下列说法正确的是
| A.a对应溶液中水的电离程度小于b |
B.b对应溶液的 |
C.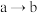 的过程中,溶液中 的过程中,溶液中 一直增大 一直增大 |
D.a对应的溶液中一定存在: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
A.浓度为0.1 mol·L-1 CH3COOH溶液,加水稀释,则 减小 减小 |
| B.浓度为0.1 mol·L-1 CH3COOH溶液,升高温度,Ka(CH3COOH)不变,但醋酸的电离程度增大 |
| C.浓度为0.1 mol·L-1 HA溶液c(H+)=10-4 mol·L-1,则HA为弱电解质 |
| D.CH3COOH的浓度越大,CH3COOH的电离程度越大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】在0.10mol·L-1氨水中存在下列电离平衡:NH3·H2O NH
NH +OH-,对于该平衡,下列叙述正确的是
+OH-,对于该平衡,下列叙述正确的是
 NH
NH +OH-,对于该平衡,下列叙述正确的是
+OH-,对于该平衡,下列叙述正确的是| A.加入水时,平衡向逆反应方向移动 |
| B.加入少量浓盐酸,平衡向正反应方向移动 |
| C.加入少量0.1mol·L-1 NaOH溶液,溶液中c(OH-)不变 |
| D.加入少量NH4Cl固体,平衡向正反应方向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某浓度的氨水中存在下列平衡:NH3•H2O
 +OH-,若想增大
+OH-,若想增大 的浓度,而不增加OH-的浓度,应采取的措施是
的浓度,而不增加OH-的浓度,应采取的措施是
①适当升高温度②加入NH4Cl固体③通入NH3 ④通入少量氯化氢气体

 +OH-,若想增大
+OH-,若想增大 的浓度,而不增加OH-的浓度,应采取的措施是
的浓度,而不增加OH-的浓度,应采取的措施是①适当升高温度②加入NH4Cl固体③通入NH3 ④通入少量氯化氢气体
| A.①② | B.②④ | C.③④ | D.②③ |
您最近一年使用:0次

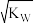 的溶液一定是中性溶液
的溶液一定是中性溶液

