硫代硫酸钠晶体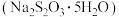 又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置
又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置 略去部分加持仪器
略去部分加持仪器 模拟生成过程。
模拟生成过程。
(1)实验室可利用 晶体和质量分数为
晶体和质量分数为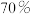 的硫酸制备
的硫酸制备 气体,该反应中硫酸浓度不能太大的原因是
气体,该反应中硫酸浓度不能太大的原因是_________________________ 。
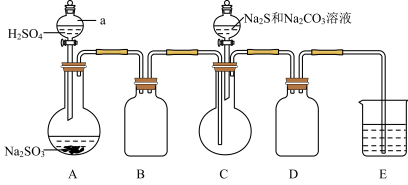
(2)在C中制取硫代硫酸钠晶体时,先向C中烧瓶加入 和
和 混合溶液,再向A中烧瓶滴加
混合溶液,再向A中烧瓶滴加 。则装置C中发生反应生成
。则装置C中发生反应生成 的化学方程式为
的化学方程式为_________
(3)实验中,为使 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是_____________ 。装置D的作用是_______________ 。装置E中为__________ 溶液。
(4)继续通入 气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是
气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是______________ 。反应终止后,烧瓶C中除析出 ,其中可能含有
,其中可能含有 杂质。为减少杂质
杂质。为减少杂质 的量,第
的量,第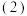 步操作应稍作改动,具体操作是
步操作应稍作改动,具体操作是___________________
(5) 的溶解度随温度升高显著增大,所得粗产品通过
的溶解度随温度升高显著增大,所得粗产品通过_____________ 方法提纯。海波可用于摄影上的定影剂,因为它能与卤化银起化学反应,生成易溶于水的银络合物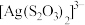 ,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为
,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为__________
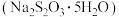 又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置
又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置 略去部分加持仪器
略去部分加持仪器 模拟生成过程。
模拟生成过程。
(1)实验室可利用
 晶体和质量分数为
晶体和质量分数为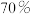 的硫酸制备
的硫酸制备 气体,该反应中硫酸浓度不能太大的原因是
气体,该反应中硫酸浓度不能太大的原因是(2)在C中制取硫代硫酸钠晶体时,先向C中烧瓶加入
 和
和 混合溶液,再向A中烧瓶滴加
混合溶液,再向A中烧瓶滴加 。则装置C中发生反应生成
。则装置C中发生反应生成 的化学方程式为
的化学方程式为(3)实验中,为使
 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是(4)继续通入
 气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是
气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是 ,其中可能含有
,其中可能含有 杂质。为减少杂质
杂质。为减少杂质 的量,第
的量,第 步操作应稍作改动,具体操作是
步操作应稍作改动,具体操作是(5)
 的溶解度随温度升高显著增大,所得粗产品通过
的溶解度随温度升高显著增大,所得粗产品通过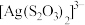 ,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为
,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为
更新时间:2020-02-04 17:48:47
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】氯化亚砜(SOCl2)是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,(已知SCl2的沸点为50℃),回答以下问题:
(1)下列四种制备SO2的方案中最佳选择是__ 。
(2)以MnO2和浓盐酸为原料制备Cl2的离子方程式为__ 。
(3)仪器f的作用是__ 。
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是__ 。
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是__ 。
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加__ 或__ 溶液,证明脱水过程发生了氧化还原反应。

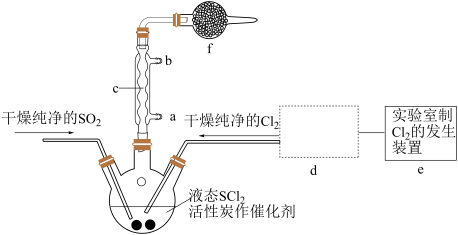
(1)下列四种制备SO2的方案中最佳选择是
| 方案 | A | B | C | D |
| 发生装置 | 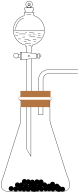 |  | 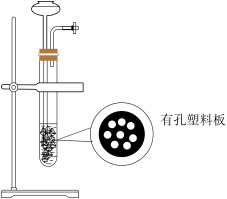 |  |
| 所选试剂 | 70%H2SO4+K2SO3 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO3 | NaHSO3固体 |
(3)仪器f的作用是
(4)d的虚线框内隐含两个装置,按气流方向顺序这两个装置的药品分别是
(5)实验结束后,将三颈烧瓶混合物中产品分离出来的方法是
(6)若用SOCl2作FeCl3·6H2O的脱水剂,设计实验证明脱水时发生了氧化还原反应。取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡,往试管中加水溶解,滴加
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。
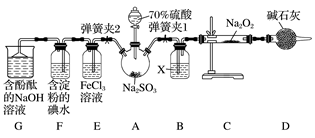
请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_______________ 。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________ ,装置D中碱石灰的作用是_______________________________________________ 。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________ 。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________ 。发生反应的离子方程式是_______________ 。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________ (填“合理”或“不合理”),原因是________ 。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生,实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
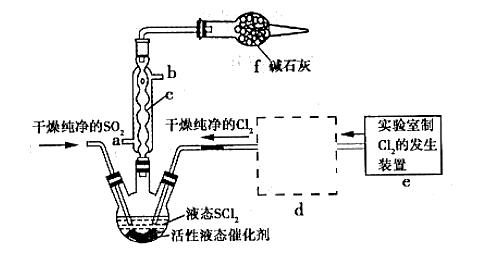
请回答下列问题:
(1)装置f的作用是____________
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为____________ 。
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:_______________________________________________________
(4)下列四种制备SO2的方案中最佳选择是____ 。
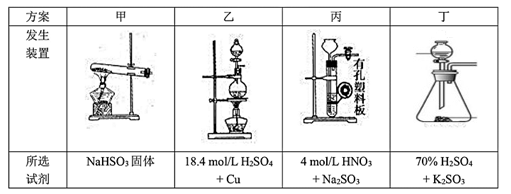
(5)装置e中产生的Cl2经过装置d后进入三颈烧瓶,d中所用的试剂为_______ 。(按气流方向)
(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是________ (已知SCl2的沸点为50℃)。若反应中消耗Cl2的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的SOCl24.76 g,则SOCl2的产率为__________ (保留三位有效数字)。
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是_______________________________

请回答下列问题:
(1)装置f的作用是
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为
(3)蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:
(4)下列四种制备SO2的方案中最佳选择是

(5)装置e中产生的Cl2经过装置d后进入三颈烧瓶,d中所用的试剂为
(6)实验结束后,将三颈烧瓶中混合物分离开的实验操作是
(7)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】直接排放含 的烟气会危害环境。利用工业废碱渣(主要成分
的烟气会危害环境。利用工业废碱渣(主要成分 )可吸收烟气中的
)可吸收烟气中的 并制备无水
并制备无水 ,其流程如图1。
,其流程如图1。
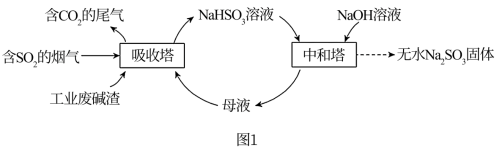
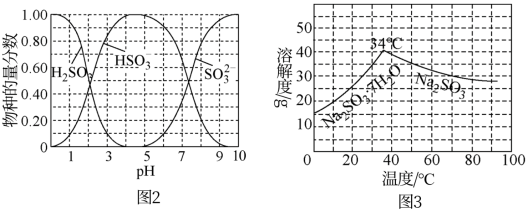
已知: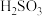 、HSO
、HSO 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,
在水溶液中的物质的量分数随pH的分布如图2, 和
和 的溶解度曲线如图3。
的溶解度曲线如图3。
(1) 溶液显碱性,用离子方程式解释其原因:
溶液显碱性,用离子方程式解释其原因:___________ 。
(2)吸收烟气
①为提高 的产率,应控制吸收塔中的pH范围为
的产率,应控制吸收塔中的pH范围为___________ 。
② 溶液中
溶液中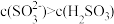 ,结合方程式解释其原因:
,结合方程式解释其原因:___________ 。
③吸收塔中的温度不宜过高,可能的原因是___________ (写出1个即可)。
(3)制备无水
将中和塔中得到的 溶液
溶液___________ (填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水 固体。
固体。
 的烟气会危害环境。利用工业废碱渣(主要成分
的烟气会危害环境。利用工业废碱渣(主要成分 )可吸收烟气中的
)可吸收烟气中的 并制备无水
并制备无水 ,其流程如图1。
,其流程如图1。
已知:
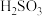 、HSO
、HSO 、SO
、SO 在水溶液中的物质的量分数随pH的分布如图2,
在水溶液中的物质的量分数随pH的分布如图2, 和
和 的溶解度曲线如图3。
的溶解度曲线如图3。
(1)
 溶液显碱性,用离子方程式解释其原因:
溶液显碱性,用离子方程式解释其原因:(2)吸收烟气
①为提高
 的产率,应控制吸收塔中的pH范围为
的产率,应控制吸收塔中的pH范围为②
 溶液中
溶液中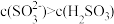 ,结合方程式解释其原因:
,结合方程式解释其原因:③吸收塔中的温度不宜过高,可能的原因是
(3)制备无水

将中和塔中得到的
 溶液
溶液 固体。
固体。
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
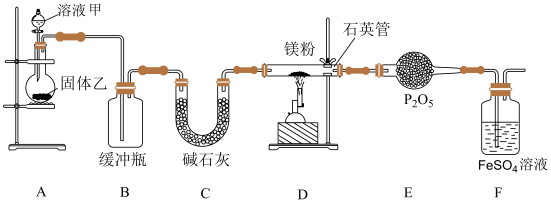
【推荐2】 可用于核燃料回收和半导体材料制备,
可用于核燃料回收和半导体材料制备, 易与水反应。实验室可利用Mg与
易与水反应。实验室可利用Mg与 加热到800℃制得,实验装置如下图所示:
加热到800℃制得,实验装置如下图所示:
请回答:
(1)装置E的仪器名称是___________ ,溶液甲是浓氨水,固体乙是___________ 。
(2)下列是实验室制取氨气的装置和选用的试剂,其中不正确的是___________ 。
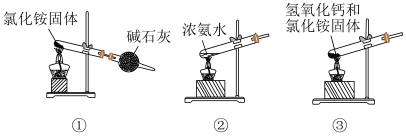
(3)写出Mg与 反应的化学方程式
反应的化学方程式___________ 。
(4)装置C的作用是___________ ,装置F的作用是___________ 。
(5)与传统工业的镁与氮气反应制备方法相比,此法最大的优点是产品纯度高(氧化镁含量低),可能的原因是___________ 。
 可用于核燃料回收和半导体材料制备,
可用于核燃料回收和半导体材料制备, 易与水反应。实验室可利用Mg与
易与水反应。实验室可利用Mg与 加热到800℃制得,实验装置如下图所示:
加热到800℃制得,实验装置如下图所示:
请回答:
(1)装置E的仪器名称是
(2)下列是实验室制取氨气的装置和选用的试剂,其中不正确的是

(3)写出Mg与
 反应的化学方程式
反应的化学方程式(4)装置C的作用是
(5)与传统工业的镁与氮气反应制备方法相比,此法最大的优点是产品纯度高(氧化镁含量低),可能的原因是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
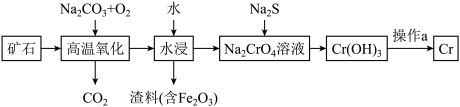
已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为______ 价。
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为_____________________ 。
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:_________________________ 。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:______________ 、____________ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:________________ 。
②若处理含1mol (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为___________ 。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

已知:Cr(OH)3是一种难溶于水的沉淀。
①Fe(CrO2)2中各元素化合价均为整数,则铬为
②高温氧化时生成产物除 Na2CrO4外还产生一种红棕色物质与一种无色无味的气体,则该反应的化学方程式为
③操作a分两步反应进行,第一步为Cr(OH)3加热分解:第二步将铝加入第一步产物中,高温下生成新的氧化物和金属单质。写出第二步反应的化学方程式:
(2)Cr(OH)3是两性氢氧化物,请写出其分别与 NaOH、稀硫酸反应的离子方程式:
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出
 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:②若处理含1mol
 (不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗 10mol FeSO4,则当铁铬氧体中n(Fe2+): n(Fe3+)=3:2时,铁铬氧体的化学式为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某研究性学习小组欲探究FeSO4·7H2O(绿矾)的主要化学性质和用途。
I.FeSO4·7H2O(绿矾)广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图:
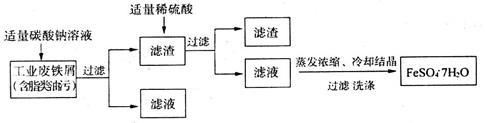
根据题意回答下列问题:
(1)碳酸钠溶液能除去脂类油污是因为_________________ (用必要的文字说明);
(2)废铁屑中含有少量的Fe2O3,在制备过程中无需除去,理由是___________________ (用必要的离子方程式说明)。
II.为测定某补血剂(有效成分为FeSO4·7H2O)中铁元素含量,设计实验流程如下,回答下列问题:
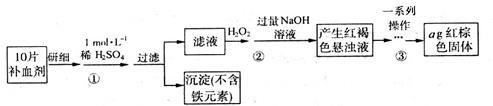
(1)步骤①需要用浓硫酸(质量分数为98.3 %)配制100 mL 1 mol·L-1的稀硫酸,所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管及____________ ;
(2)步骤③所表示的一系列操作依次是:
a.过滤
b.洗涤
c.__________
d.冷却
e.称量
f.重复c~e直至固体质量不变
操作f的目的是_________________________________________________________ ;
(3)假设实验过程中铁元素无损耗,则每片补血剂含铁元素为________ g(用含n的代数式表示)。
III.利用下图装置探究绿矾的热稳定性
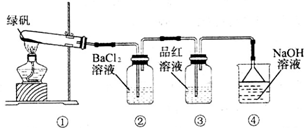
(1)实验过程中,观察到③中品红溶液褪色,据此推测FeSO4分解过程中最有可能被氧化的元素是___________ ,请写出④中反应的离子方程式:____________________ ;
(2)②中有白色沉淀生成,小组成员经过理论分析并结合(1)中的表述推测,绿矾分解的产物最有可能是下列各项中的______________ (填序号字母)。
a.Fe2O3、SO3、H2O
b.Fe2O3、SO2、SO3、H2O
c.FeO、SO2、SO3、H2O
I.FeSO4·7H2O(绿矾)广泛用于医药和工业领域,以下是FeSO4·7H2O的实验室制备流程图:

根据题意回答下列问题:
(1)碳酸钠溶液能除去脂类油污是因为
(2)废铁屑中含有少量的Fe2O3,在制备过程中无需除去,理由是
II.为测定某补血剂(有效成分为FeSO4·7H2O)中铁元素含量,设计实验流程如下,回答下列问题:

(1)步骤①需要用浓硫酸(质量分数为98.3 %)配制100 mL 1 mol·L-1的稀硫酸,所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管及
(2)步骤③所表示的一系列操作依次是:
a.过滤
b.洗涤
c.
d.冷却
e.称量
f.重复c~e直至固体质量不变
操作f的目的是
(3)假设实验过程中铁元素无损耗,则每片补血剂含铁元素为
III.利用下图装置探究绿矾的热稳定性

(1)实验过程中,观察到③中品红溶液褪色,据此推测FeSO4分解过程中最有可能被氧化的元素是
(2)②中有白色沉淀生成,小组成员经过理论分析并结合(1)中的表述推测,绿矾分解的产物最有可能是下列各项中的
a.Fe2O3、SO3、H2O
b.Fe2O3、SO2、SO3、H2O
c.FeO、SO2、SO3、H2O
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】以 为原料制备氧钒(Ⅳ)碱式碳酸铵
为原料制备氧钒(Ⅳ)碱式碳酸铵 过程如下:
过程如下:
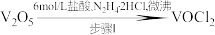 溶液
溶液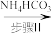 氧钒(Ⅳ)碱式碳酸铵粗产品
氧钒(Ⅳ)碱式碳酸铵粗产品
已知: 能被
能被 氧化。
氧化。
回答下列问题:
(1)步骤Ⅰ的反应装置如图(夹持及加热装置略去,下同)。_______ 。
②步骤Ⅰ生成 的同时,生成一种无色无污染的气体,该反应的化学方程式为
的同时,生成一种无色无污染的气体,该反应的化学方程式为_______ 。
(2)步骤Ⅱ可在下图装置中进行。
_______ 。
②实验开始时,先关闭 ,打开
,打开 ,当
,当_______ 时(写实验现象),再关闭 ,打开
,打开 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。
③C装置的作用是_______ 。
(3)测定产品纯度。
称取 样品用稀硫酸溶解后,加入过量的
样品用稀硫酸溶解后,加入过量的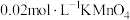 溶液,充分反应后加入过量的
溶液,充分反应后加入过量的 溶液,再加适量尿素除去
溶液,再加适量尿素除去 ,用
,用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为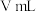 。(已知:
。(已知: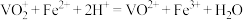 )
)
①样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为 )的质量分数为
)的质量分数为_______ 。
②下列情况会导致产品纯度偏大的是_______ (填标号)。
A.未加尿素,直接进行滴定
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡产生
 为原料制备氧钒(Ⅳ)碱式碳酸铵
为原料制备氧钒(Ⅳ)碱式碳酸铵 过程如下:
过程如下: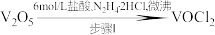 溶液
溶液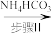 氧钒(Ⅳ)碱式碳酸铵粗产品
氧钒(Ⅳ)碱式碳酸铵粗产品已知:
 能被
能被 氧化。
氧化。回答下列问题:
(1)步骤Ⅰ的反应装置如图(夹持及加热装置略去,下同)。

②步骤Ⅰ生成
 的同时,生成一种无色无污染的气体,该反应的化学方程式为
的同时,生成一种无色无污染的气体,该反应的化学方程式为(2)步骤Ⅱ可在下图装置中进行。

②实验开始时,先关闭
 ,打开
,打开 ,当
,当 ,打开
,打开 ,充分反应,静置,得到固体。
,充分反应,静置,得到固体。③C装置的作用是
(3)测定产品纯度。
称取
 样品用稀硫酸溶解后,加入过量的
样品用稀硫酸溶解后,加入过量的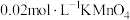 溶液,充分反应后加入过量的
溶液,充分反应后加入过量的 溶液,再加适量尿素除去
溶液,再加适量尿素除去 ,用
,用 标准溶液滴定达终点时,消耗体积为
标准溶液滴定达终点时,消耗体积为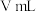 。(已知:
。(已知: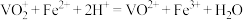 )
)①样品中氧钒(Ⅳ)碱式碳酸铵(摩尔质量为
 )的质量分数为
)的质量分数为②下列情况会导致产品纯度偏大的是
A.未加尿素,直接进行滴定
B.滴定达终点时,俯视刻度线读数
C.用标准液润洗滴定管后,液体从上口倒出
D.滴定达终点时,发现滴定管尖嘴内有气泡产生
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氯化铁是一种常用的试剂。
(1)配制一定物质的量浓度的 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是___________ 。
(2)蒸干 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是___________ (填化学式)。
(3)测定 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。
方案1:配合滴定法。
文献资料 已知:溶液中 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。
实验操作:称取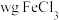 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用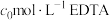 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。
①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为___________ (填字母)。
②达到滴定终点的标志是___________ 。该 样品的纯度为
样品的纯度为___________ %(用含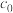 、V、w的代数式表示)。
、V、w的代数式表示)。
方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的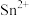 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: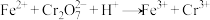 (未配平)。
(未配平)。
实验操作:称取一定量 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用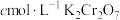 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
③应选择___________ 式滴定管盛放 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。
④上述氯化铁样品中含___________ 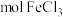 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。
⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果___________ (填“偏高”“偏低”或“无影响”)。
(1)配制一定物质的量浓度的
 溶液时,取一定量
溶液时,取一定量 溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是
溶于浓盐酸中,加水稀释至指定的浓度。盐酸的作用是(2)蒸干
 溶液并灼烧所得固体,最终得到的物质是
溶液并灼烧所得固体,最终得到的物质是(3)测定
 样品的纯度(杂质不参与反应)。
样品的纯度(杂质不参与反应)。方案1:配合滴定法。
文献资料 已知:溶液中
 与EDTA以物质的量之比
与EDTA以物质的量之比 形成稳定的配合物,
形成稳定的配合物, ,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在
,其溶液颜色为亮黄色。磺基水杨酸溶于水得到无色溶液,在 时与
时与 形成红色配合物,可用作滴定
形成红色配合物,可用作滴定 的指示剂。
的指示剂。实验操作:称取
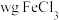 样品溶于盐酸中,稀释成
样品溶于盐酸中,稀释成 溶液,取
溶液,取 配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至
配制的溶液于锥形瓶中,滴几滴磺基水杨酸溶液,滴加稀硫酸至 左右,用
左右,用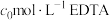 溶液滴定至终点,消耗EDTA溶液V mL。
溶液滴定至终点,消耗EDTA溶液V mL。①部分滴定操作如下:
A.用待装液润洗滴定管
B.检查滴定管是否漏水
C.加入反应液并排气
D.终点时读数
正确的先后排序为
②达到滴定终点的标志是
 样品的纯度为
样品的纯度为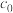 、V、w的代数式表示)。
、V、w的代数式表示)。方案2:氧化还原滴定法。
滴定原理:在甲基橙指示剂下,用
 溶液(过量)还原
溶液(过量)还原 :
: 。过量的
。过量的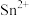 被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和
被甲基橙消除,同时甲基橙变色,且甲基橙的还原产物不和 反应:
反应: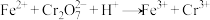 (未配平)。
(未配平)。实验操作:称取一定量
 样品溶于稀盐酸中,滴加几滴甲基橙,滴加
样品溶于稀盐酸中,滴加几滴甲基橙,滴加 溶液至甲基橙变色。用
溶液至甲基橙变色。用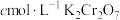 溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。
溶液继续滴定至终点,消耗滴定液x mL(在该条件下,滴定剂不氧化氯离子和甲基橙等)。③应选择
 溶液(填“酸”或“碱”)。
溶液(填“酸”或“碱”)。④上述氯化铁样品中含
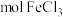 (用含c、x的代数式表示)。
(用含c、x的代数式表示)。⑤若其他操作均正确,滴定管起始时仰视读数,终点时俯视读数,则测得结果
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某化学兴趣小组用下图装置制取并探究氯气的性质。
A装置中发生反应的化学方程式: KMnO4+ HCl(浓) == KCl+ MnCl2 + Cl2↑+ H2O,____________

(1)制取氯气反应中MnCl2是__________ 产物(填“氧化”或“还原”)。
(2)实验进行一段时间后,可观察到______ (填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________ 。
(3)当氯气进入D装置后,可观察到溶液颜色变为_____________ ,写出相关反应的化学方程式___________________________________ 。
(4)写出E装置中反应的离子方程式___________________________ 。
(5)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_________ L氯气。被氧化的HCl的物质的量是___________ 。
(6)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液②NaHCO3溶液③KBr溶液④NaCl溶液,正确选择是______ (填序号)。
A装置中发生反应的化学方程式: KMnO4+ HCl(浓) == KCl+ MnCl2 + Cl2↑+ H2O,

(1)制取氯气反应中MnCl2是
(2)实验进行一段时间后,可观察到
(3)当氯气进入D装置后,可观察到溶液颜色变为
(4)写出E装置中反应的离子方程式
(5)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下
(6)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液②NaHCO3溶液③KBr溶液④NaCl溶液,正确选择是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上利用软锰矿(主要成分为MnO2,含少量SiO2、FeO和Fe2O3等杂质)和含SO2的烟气为主要原料,制备无水碳酸锰的工艺流程如图所示。
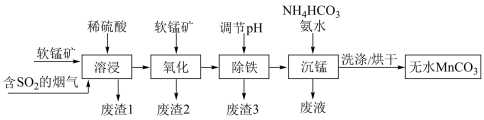
已知:
①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为Mn2O3。
②不同金属离子生成氢氧化物沉淀的pH如下表:
③Ksp(CaCO3)=8.7×10-9,Ksp(MnCO3)=1.8×10-11
回答下列问题:
(1)下列说法正确的是_______(填序号)。
(2)调节溶液的pH前,加入软锰矿发生“氧化”作用的离子方程式是_______ 。
(3)调节pH的方法是加入适量的熟石灰,调节pH=5.0充分反应后生成的沉淀有_______ 。如果没有“氧化”过程的进行,pH就需要调节到更大的数值,这样会造成_______ 的不良后果。
(4)“沉锰”过程中加入氨水的目的是_______ (从化学平衡移动的角度解释)。“沉锰”过程宜在较低温度下进行,可能原因是_______ (写1条即可)。“沉锰”时通过控制 的浓度,可以达到不产生CaCO3的目的,原因是
的浓度,可以达到不产生CaCO3的目的,原因是_______ 。
(5)Al还原Mn2O3制备Mn的化学方程式是_______ 。

已知:
①MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解,在空气中高温加热所得固体产物为Mn2O3。
②不同金属离子生成氢氧化物沉淀的pH如下表:
| 离子 | Fe3+ | Fe2+ | Mn2+ |
| 开始沉淀时pH | 2.7 | 7.5 | 7.8 |
| 完全沉淀时pH | 3.7 | 9.7 | 9.8 |
③Ksp(CaCO3)=8.7×10-9,Ksp(MnCO3)=1.8×10-11
回答下列问题:
(1)下列说法正确的是_______(填序号)。
| A.最好使用粉状软锰矿进行“溶浸” |
| B.废渣1的主要成分和“芯片”相同 |
| C.溶浸时不会发生氧化还原反应 |
| D.废液经处理可用于灌溉农作物 |
(3)调节pH的方法是加入适量的熟石灰,调节pH=5.0充分反应后生成的沉淀有
(4)“沉锰”过程中加入氨水的目的是
 的浓度,可以达到不产生CaCO3的目的,原因是
的浓度,可以达到不产生CaCO3的目的,原因是(5)Al还原Mn2O3制备Mn的化学方程式是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】铁及其化合物的制备与性质探究。
I.乳酸亚铁[CH3CH(OH)COO]2Fe是一种常见的补血剂,可由FeCO3与乳酸反应制得,实验室经常采用如下装置制备FeCO3(夹持装置略)。
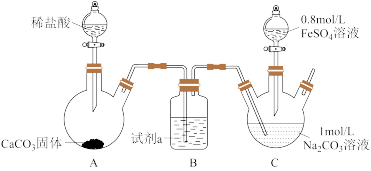
具体实验流程如下:装置C中,先通入CO2至pH约为7,滴加一定量FeSO4,将所得白色沉淀过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a为_______ 。
(2)写出整个实验过程中C中发生反应的离子方程式_______ 。
(3)某实验小组用酸性高锰酸钾标准液去测定补血剂中乳酸亚铁含量,从而计算乳酸亚铁的质量分数,经过反复多次测定乳酸亚铁的质量分数总是大于100%,其原因是_______ 。
II.无水FeCl3是一种常见的化工原料,实验室可采用下列装置制备。
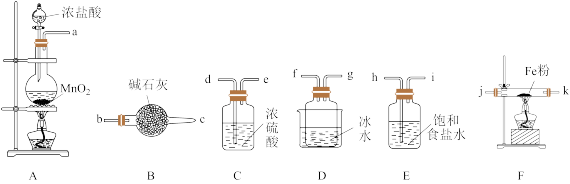
已知:①FeCl3极易水解;②FeCl3在300℃以上升华。
(4)装置的连接顺序为a→_______ →j→k→_______ (按气流方向,用小写字母表示)。
(5)将所得无水FeCl3溶于_______ 可得FeCl3溶液,FeCl3溶液是一种常用的创伤止血剂,其止血原理为_______ 。
(6)某兴趣小组在FeCl3溶液中通入SO2,观察到的主要现象为随着SO2的通入,溶液迅速由黄色变为红棕色,静置一小时后溶液变为浅绿色。通过查阅资料得知,溶液中主要有两种变化,第一种:Fe2+与SO2会生成一种络合物[Fe(SO2)6]3+(红棕色);第二种:Fe3+与SO2发生氧化还原反应。
①写出第二种情况下反应的离子方程式:_______ 。
②这两种反应平衡常数的大小关系为K1_______ K2(填“<”“>”或“=”)。
I.乳酸亚铁[CH3CH(OH)COO]2Fe是一种常见的补血剂,可由FeCO3与乳酸反应制得,实验室经常采用如下装置制备FeCO3(夹持装置略)。

具体实验流程如下:装置C中,先通入CO2至pH约为7,滴加一定量FeSO4,将所得白色沉淀过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a为
(2)写出整个实验过程中C中发生反应的离子方程式
(3)某实验小组用酸性高锰酸钾标准液去测定补血剂中乳酸亚铁含量,从而计算乳酸亚铁的质量分数,经过反复多次测定乳酸亚铁的质量分数总是大于100%,其原因是
II.无水FeCl3是一种常见的化工原料,实验室可采用下列装置制备。

已知:①FeCl3极易水解;②FeCl3在300℃以上升华。
(4)装置的连接顺序为a→
(5)将所得无水FeCl3溶于
(6)某兴趣小组在FeCl3溶液中通入SO2,观察到的主要现象为随着SO2的通入,溶液迅速由黄色变为红棕色,静置一小时后溶液变为浅绿色。通过查阅资料得知,溶液中主要有两种变化,第一种:Fe2+与SO2会生成一种络合物[Fe(SO2)6]3+(红棕色);第二种:Fe3+与SO2发生氧化还原反应。
①写出第二种情况下反应的离子方程式:
②这两种反应平衡常数的大小关系为K1
您最近半年使用:0次



