用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1 L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是
| A.c(H+)<c(OH-) |
| B.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1 |
| C.c(CH3COOH)>c(CH3COO-) |
| D.c(CH3COO-)+c(OH-)=0.2 mol·L-1 |
2011·四川内江·一模 查看更多[9]
湖南省衡阳市欧阳遇实验中学2018-2019学年高二下学期期末考试化学试题【全国百强校】吉林省延边市第二中学2018-2019学年高二下学期开学考试化学试题云南省中央民族大学附属中学芒市国际学校2017-2018学年高二上学期末考试化学试题吉林省汪清县第六中学2017-2018学年高二上学期期末考试化学试题辽宁省沈阳市东北育才学校2017-2018学年高二上学期期中考试化学试题(已下线)2011-2012学年湖南省望城县第一中学高二上学期期末质量检测化学试卷(已下线)2011届四川省内江六中高考前热身试题(理综)化学部分(已下线)2013-2014湖北省沙市中学高二上学期第七次周练化学试卷2016-2017学年天津市宝坻区高二11月联考化学试卷
更新时间:2016-12-09 02:47:47
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,向20mL0.1mol•L-1的HA溶液中逐滴加入0.1mol•L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是( )
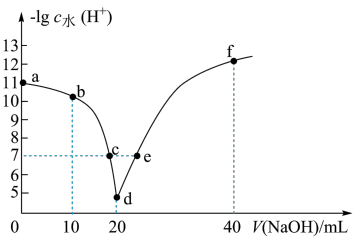

| A.从a到d,HA的电离始终受到促进 |
| B.c、e两点溶液对应的pH=7 |
| C.常温下,A-的水解平衡常数Kh约为1×10-9mol•L-1 |
| D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH随NaOH溶液体积的变化如图所示。下列说法不正确的是


A.b点处存在c(Na+)>c(SO )>c(NH )>c(NH )>c(OH-)=c(H+) )>c(OH-)=c(H+) |
B.a点处存在c(NH )+c(Na+)+c(H+)=c(SO )+c(Na+)+c(H+)=c(SO )+c(OH-) )+c(OH-) |
| C.图中a、b、c、d四个点,水的电离程度最大的是a点 |
D.由b到c发生反应的离子方程式为NH +OH-=NH3·H2O +OH-=NH3·H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下,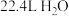 所含的分子数为 所含的分子数为 |
B.0.5mol雄黄分子( ,结构为 ,结构为 含有 含有 个S—S键 个S—S键 |
C.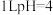 的 的 溶液中 溶液中 离子数为0.1 离子数为0.1 |
D.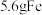 与足量稀硝酸完全反应,转移电子数目为0.3 与足量稀硝酸完全反应,转移电子数目为0.3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列有关电解质溶液的说法正确的是
| A.将0.1 mol·L-1 CH3COOH溶液从20 ℃升温至30 ℃,溶液中c(H+)/c(CH3COOH)减小 |
B.若NH4Cl溶液与NH4HSO4溶液的pH相等,则c(NH )也相等 )也相等 |
C.向盐酸中加入氨水至中性,溶液中 >1 >1 |
| D.常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】甲、乙、丙、丁是中学常见的物质,其中甲、乙、丙均含有同一种元素,在一定条件下的转化关系如图,下列说法正确的是


| A.若丁为用量最大,用途最广的金属单质,乙的溶液一定为FeCl3 |
B.若通常情况下甲、乙、丙、丁都是气体,且乙和丁为空气的主要成分,则反应①的化学方程式4NH3+5O2 4NO+6H2O 4NO+6H2O |
| C.若甲、乙、丙的溶液显碱性,丙可作为医疗上治疗胃酸过多症的药剂,将等物质的量的乙和丙溶于水形成混合溶液,溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)> c(H+) |
| D.若丁为化合物,且为氯碱工业的重要产品,则甲一定为含Al3+的盐 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】25℃,在25mL0.1mol•L-1HCl溶液中逐滴加入0.2mol•L-1NH3·H2O溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是


A.在A、B间有一点(不含A、B点),溶液中可能有c(Cl-)>c(NH )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
B.在B点,a>12.5,且有c(NH )=c(Cl-)=c(OH-)=c(H+) )=c(Cl-)=c(OH-)=c(H+) |
C.在C点,c(Cl-)>c(NH )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
D.在D点,c(NH )-c(NH3·H2O)=c(OH-)-c(H+) )-c(NH3·H2O)=c(OH-)-c(H+) |
您最近一年使用:0次



