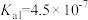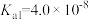等物质的量的NH4Cl和NH3·H2O的混合溶液
电荷守恒:________
物料守恒:________
质子守恒:________
电荷守恒:
物料守恒:
质子守恒:
更新时间:2020-02-18 16:43:23
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】按要求回答下列问题:
(1)向 醋酸溶液中加入少量水,
醋酸溶液中加入少量水,
_____ (填“增大”“减小”或“不变”,下同),
_____ 。
(2)500mL 醋酸溶液a、500mL
醋酸溶液a、500mL 盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a
盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a_____ b(填“<”“>”或“=”,下同),溶液的导电能力a_____ b;最终产生氢气的质量a_____ b.
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
以下说法不正确的是_____(填字母)。
(4)向NaCN溶液中通入过量 气体,发生反应的离子方程式是
气体,发生反应的离子方程式是_____ 。
(1)向
 醋酸溶液中加入少量水,
醋酸溶液中加入少量水,

(2)500mL
 醋酸溶液a、500mL
醋酸溶液a、500mL 盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a
盐酸溶液b分别与足量Zn粉充分反应,初始反应速率a(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 |  |  | HClO | HCN |
| 电离平衡常数 |  | 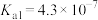  |  | 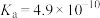 |
| A.向弱酸溶液中加入少量NaOH溶液,电离平衡常数变大 |
| B.多元弱酸的酸性主要由第一步电离决定 |
C.表中四种酸,酸性最强的是 |
D.向NaClO溶液中通入 气体,可以生成HClO 气体,可以生成HClO |
 气体,发生反应的离子方程式是
气体,发生反应的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】填空。Ⅰ、
(1)25℃时,0.1mol/L的HA溶液中 。HA是
。HA是____________ _(填“强电解质”或“弱电解质”)。
(2)将0.1mol/L的 加水稀释,随着水量的增加而减小的是
加水稀释,随着水量的增加而减小的是____________ (填字母)
a. b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度
b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度
(3)已知:HClO的电离常数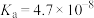 ;
;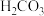 的电离常数
的电离常数 ,
, 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 气体,发生反应的离子方程式为
气体,发生反应的离子方程式为____________
(4)常温下,将pH均为3,体积均为 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随 的变化如图所示。a、b、c三点水的电离程度
的变化如图所示。a、b、c三点水的电离程度____________ (用“>”、“<”、“=”填空)
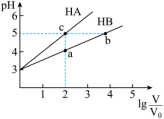
(5) 浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是
浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是____________ (填写序号)
①溶液中溶质的物质的量浓度 ②溶液中溶质的物质的量浓度
②溶液中溶质的物质的量浓度
③开始反应时的速率 ④开始反应时的速率
④开始反应时的速率
⑤HA溶液里有锌剩余 ⑥HB溶液里有锌剩余
II、已知: 时,三种酸的电离平衡常数如下表所示:
时,三种酸的电离平衡常数如下表所示:
回答下列问题:
(6) 的电离方程式为
的电离方程式为_______ 。
(7)上述三种酸分子的酸性由强到弱的顺序为_______ (用分子式填写)。
(8)用蒸馏水稀释 的
的 溶液,下列各式表示的数值随水量的增加而减小的是_______(填序号)。
溶液,下列各式表示的数值随水量的增加而减小的是_______(填序号)。
(9)向 的
的 溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的
溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的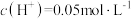 ,则溶液中
,则溶液中
_______  。
。
(1)25℃时,0.1mol/L的HA溶液中
 。HA是
。HA是(2)将0.1mol/L的
 加水稀释,随着水量的增加而减小的是
加水稀释,随着水量的增加而减小的是a.
 b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度
b.溶液中离子总数 c.溶液导电性 d.溶液中醋酸分子数 e.醋酸电离程度(3)已知:HClO的电离常数
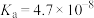 ;
;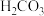 的电离常数
的电离常数 ,
, 。向NaClO溶液中通入少量
。向NaClO溶液中通入少量 气体,发生反应的离子方程式为
气体,发生反应的离子方程式为(4)常温下,将pH均为3,体积均为
 的HA和HB溶液,分别加水稀释至体积V,pH随
的HA和HB溶液,分别加水稀释至体积V,pH随 的变化如图所示。a、b、c三点水的电离程度
的变化如图所示。a、b、c三点水的电离程度
(5)
 浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是
浓度相同的等体积的两份上述溶液HA和HB,分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌,则下列说法正确的是①溶液中溶质的物质的量浓度
 ②溶液中溶质的物质的量浓度
②溶液中溶质的物质的量浓度
③开始反应时的速率
 ④开始反应时的速率
④开始反应时的速率
⑤HA溶液里有锌剩余 ⑥HB溶液里有锌剩余
II、已知:
 时,三种酸的电离平衡常数如下表所示:
时,三种酸的电离平衡常数如下表所示:化学式 |
|
|
|
电离平衡常数 |
|
|
|
回答下列问题:
(6)
 的电离方程式为
的电离方程式为(7)上述三种酸分子的酸性由强到弱的顺序为
(8)用蒸馏水稀释
 的
的 溶液,下列各式表示的数值随水量的增加而减小的是_______(填序号)。
溶液,下列各式表示的数值随水量的增加而减小的是_______(填序号)。A. | B. | C.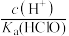 | D. |
 的
的 溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的
溶液中滴加等体积的一定浓度的稀硫酸,此时测得溶液中的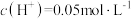 ,则溶液中
,则溶液中
 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】常温时,向体积均为V0、浓度均为1mol/L的HClO2和HBF4两种酸溶液中分别加水,稀释至体积为V,稀释过程中溶液pH随( )的变化如下图所示。
)的变化如下图所示。

回答下列问题:
(1)HBF4为___________ 酸(填“强”或“弱”)。
(2)HClO2的电离方程式为___________ 。
(3)b→c过程中,HBF4溶液被稀释了___________ 倍。
(4)中和等体积、pH均为3的这两种酸溶液,消耗NaOH的物质的量较多的是___________ (写出化学式)。
(5)依据a点,Ka(HClO2)=___________ (结果保留两位有效数字)。
 )的变化如下图所示。
)的变化如下图所示。
回答下列问题:
(1)HBF4为
(2)HClO2的电离方程式为
(3)b→c过程中,HBF4溶液被稀释了
(4)中和等体积、pH均为3的这两种酸溶液,消耗NaOH的物质的量较多的是
(5)依据a点,Ka(HClO2)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】某硫酸厂用以下几种方法处理SO2尾气。
(1)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为___________ ;其产物的溶液中离子浓度由大到小的排列顺序为___________ 。
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是___________ 。(填序号)
a.c(Na+)+c(H+)>c(SO )+c(HSO
)+c(HSO )+c(OH﹣)
)+c(OH﹣)
b.c(Na+)=c(SO )+c(HSO
)+c(HSO )+C(H2SO3)
)+C(H2SO3)
c.c(Na+)>c(SO )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
d.水电离出c(OH﹣)=1×l0﹣8 mol/L
③25℃时,H2SO3 HSO
HSO +H+的电离常数Ka=1×10﹣2mol•L﹣1,则该温度下NaHSO3水解反应的平衡常数Kh=
+H+的电离常数Ka=1×10﹣2mol•L﹣1,则该温度下NaHSO3水解反应的平衡常数Kh=___________ mol•L﹣1,若向NaHSO3溶液中加入少量的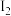 ,则溶液中
,则溶液中 将
将___________ (填“增大”、“减小”或“不变”)。
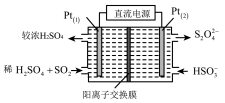
(2)电化学处理法
如图所示,Pt(1)电极的反应式为___________ ;碱性条件下,用Pt (2)电极排出的S2O 溶液吸收NO2,使其转化为N2,同时有SO
溶液吸收NO2,使其转化为N2,同时有SO 生成。若阳极 转移电子6mol,则理论上处理NO2气体
生成。若阳极 转移电子6mol,则理论上处理NO2气体___________ mol。
(1)亚硫酸钠吸收法
①Na2SO3溶液吸收SO2的离子方程式为
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是
a.c(Na+)+c(H+)>c(SO
 )+c(HSO
)+c(HSO )+c(OH﹣)
)+c(OH﹣)b.c(Na+)=c(SO
 )+c(HSO
)+c(HSO )+C(H2SO3)
)+C(H2SO3)c.c(Na+)>c(SO
 )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)d.水电离出c(OH﹣)=1×l0﹣8 mol/L
③25℃时,H2SO3
 HSO
HSO +H+的电离常数Ka=1×10﹣2mol•L﹣1,则该温度下NaHSO3水解反应的平衡常数Kh=
+H+的电离常数Ka=1×10﹣2mol•L﹣1,则该温度下NaHSO3水解反应的平衡常数Kh=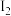 ,则溶液中
,则溶液中 将
将(2)电化学处理法
如图所示,Pt(1)电极的反应式为
 溶液吸收NO2,使其转化为N2,同时有SO
溶液吸收NO2,使其转化为N2,同时有SO 生成。若阳极 转移电子6mol,则理论上处理NO2气体
生成。若阳极 转移电子6mol,则理论上处理NO2气体
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)_______ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_______ (填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为_______ (填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______ 。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为_______ 。
Ⅱ.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
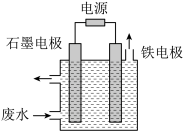
含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为_______ (填“阴极”或“阳极”),阳极产生的ClO-的电极反应为_______ ,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为_______ 。
| 醋酸 | 氢硫酸 | 氢氰酸 |
| Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为
Ⅱ.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(I)常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0. 5L混合溶液。
(1)溶液中共有________ 种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________ 。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________ mol。
(II)在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-)_________ 。
(2)若加入更多的AgI固体,则c(Ag+)_________
(3)若加入固体AgBr,c(I-)_________ 。
(1)溶液中共有
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=
(II)在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”)
(1)若加入AgNO3固体,c(I-)
(2)若加入更多的AgI固体,则c(Ag+)
(3)若加入固体AgBr,c(I-)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】醋酸是重要的一元酸,在有机和无机反应中都有应用。现有25 ℃时,pH=3的醋酸。请回答以下问题:
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中
________ (填“增大”“减小”或“不变”)。
(2)若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH________ (填“>”“<”或“=”)7,用离子方程式表示其原因_____________________________________ 。
(3)若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是___________________________________________ 。
(4)若向醋酸中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)______ c(CH3COO-)(填“>”、“<”或“=”)。
(5)若向醋酸中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中c(CH3COO-)-C(Na+)=________ mol/L(填写准确数据)。
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中

(2)若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH
(3)若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1∶1,则所得溶液中各离子的物质的量浓度由大到小的顺序是
(4)若向醋酸中加入NaOH溶液至溶液恰好呈中性,此时c(Na+)
(5)若向醋酸中加入一定量NaOH溶液,所得混合液pH=6,则此溶液中c(CH3COO-)-C(Na+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】现有HA、HB、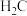 三种酸,室温下用
三种酸,室温下用 的
的 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的HA、HB两种酸的溶液,滴定过程中溶液的
的HA、HB两种酸的溶液,滴定过程中溶液的 随滴入的
随滴入的 溶液体积的变化如图所示:
溶液体积的变化如图所示:

(1)曲线I上的c点对应的溶液中各离子浓度的大小顺序为__________ ,b点对应的溶液中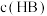
____ 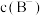 (填“>”“<”或“=”).
(填“>”“<”或“=”).
(2)a点时的溶液中由水电离出的
_______  ,
,
__________ .
(3)已知向 的
的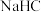 溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到
溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到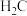 分子,则此溶液中
分子,则此溶液中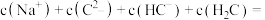
________ (填具体数据).
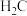 三种酸,室温下用
三种酸,室温下用 的
的 溶液分别滴定
溶液分别滴定 浓度均为
浓度均为 的HA、HB两种酸的溶液,滴定过程中溶液的
的HA、HB两种酸的溶液,滴定过程中溶液的 随滴入的
随滴入的 溶液体积的变化如图所示:
溶液体积的变化如图所示:
(1)曲线I上的c点对应的溶液中各离子浓度的大小顺序为
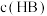
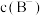 (填“>”“<”或“=”).
(填“>”“<”或“=”).(2)a点时的溶液中由水电离出的

 ,
,
(3)已知向
 的
的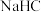 溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到
溶液中滴入几滴石蕊溶液后变成红色.若在此溶液中能检测到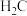 分子,则此溶液中
分子,则此溶液中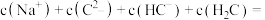
您最近一年使用:0次