CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2),还可制备甲醇、二甲醚、低碳烯烃等燃料产品。
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g) C(ads)+2H2(g) (慢反应)
C(ads)+2H2(g) (慢反应)
反应②:C(ads)+ CO2(g) 2CO(g) (快反应)
2CO(g) (快反应)
上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
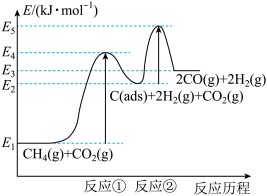
(1)CH4与CO2制备“合成气”的热化学方程式为_________ 。能量变化图中:E5+E1_________ E4+E2(填“>”、“<”或“=”)。
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g) CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+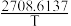 (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
(2)反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
此时正、逆反应速率的大小:v正____ v逆 (填“>”、 “<”或“=”)。
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_________ (填标号)。
A < B
B  C >
C > D 无法确定
D 无法确定
I.制合成气
科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)
 C(ads)+2H2(g) (慢反应)
C(ads)+2H2(g) (慢反应)反应②:C(ads)+ CO2(g)
 2CO(g) (快反应)
2CO(g) (快反应)上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

(1)CH4与CO2制备“合成气”的热化学方程式为
II.脱水制醚
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)
 CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+
CH3OCH3(g) + H2O(g) ΔH,其速率方程式为:v正= k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算式:lnKc = −2.205+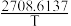 (Kc为化学平衡常数;T 为热力学温度,单位为K)。
(Kc为化学平衡常数;T 为热力学温度,单位为K)。(2)反应达到平衡后,仅升高温度,k正增大的倍数
(3)某温度下(该反应平衡常数Kc为200),在密闭容器中加入一定量 CH3OH,反应到某时刻测得各组分的物质的量如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量/mol | 0.4 | 0.4 | 0.4 |
此时正、逆反应速率的大小:v正
(4)500K下,在密闭容器中加入一定量甲醇 CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为
A <
 B
B  C >
C > D 无法确定
D 无法确定
更新时间:2020-03-13 16:44:59
|
相似题推荐
【推荐1】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:
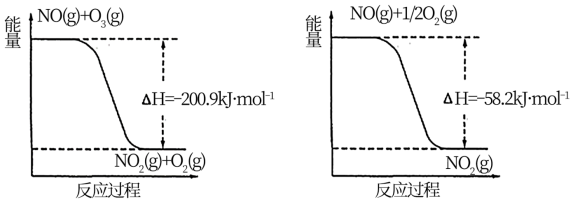
NO被O3氧化的总反应是化合反应,该反应的热化学方程式为________ 。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________ 。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________ 。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________ 。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx进行选择性反应:4NH3 + 4NO + O2 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
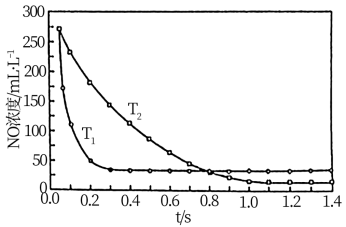
(5)判断该反应为________ (填“吸热”或“放热”)反应,说明理由:________ 。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:

NO被O3氧化的总反应是化合反应,该反应的热化学方程式为
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx进行选择性反应:4NH3 + 4NO + O2
 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
(5)判断该反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】氨在工农业生产中应用广泛。在压强为30 MPa时,合成氨平衡混合气体中NH3的体积分数如下:
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是__________________________________________________ 。
(2)根据下图,合成氨的热化学方程式是__________________________ 。
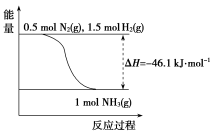
(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________ 92.2 kJ(填“大于”“等于”或“小于”),原因是________________________ ;若加入催化剂,ΔH________ (填“变大”“变小”或“不变”)。
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为________ kJ。
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为____________________ 。
| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是
(2)根据下图,合成氨的热化学方程式是

(3)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
(4)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为
(5)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1。
则:1 mol N2H4与NO2完全反应的热化学方程式为
您最近一年使用:0次
【推荐3】氯气是重要的化工原料,在工业生产中有广泛的应用:
(1)写出用惰性电极电解饱和食盐水制备氯气的离子反应方程式___________ 。
(2)工业制备1,2-二氯乙烷的主要方法之一为直接氯化法,主反应原理为: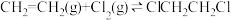 (1)
(1)
已知制备过程中还存在如下副反应:
Ⅰ.
Ⅱ.
①计算主反应的
___________  。
。
②该方法制备是低温氯化法,若反应温度较高造成的主要影响是___________ ,低温氯化法的主要不足之处是___________ 。
(3)Cl2也可以与NO反应: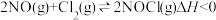 。一定温度下,用NO、Cl2和NOCl表示该反应的反应速率分别为
。一定温度下,用NO、Cl2和NOCl表示该反应的反应速率分别为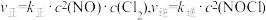 (
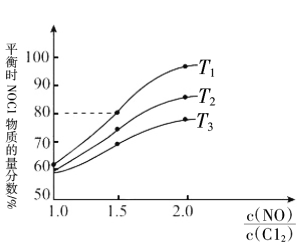
(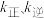 为速率常数)。向2 L密闭容器中充入1.5 mol NO和1 mol Cl2,测得平衡时NOCl的物质的量分数与温度的关系如图所示,T1、T2、T3大小关系为
为速率常数)。向2 L密闭容器中充入1.5 mol NO和1 mol Cl2,测得平衡时NOCl的物质的量分数与温度的关系如图所示,T1、T2、T3大小关系为___________ ,判断理由是___________ ,T1温度下,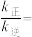
___________ 。
(1)写出用惰性电极电解饱和食盐水制备氯气的离子反应方程式
(2)工业制备1,2-二氯乙烷的主要方法之一为直接氯化法,主反应原理为:
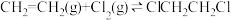 (1)
(1)已知制备过程中还存在如下副反应:
Ⅰ.

Ⅱ.

①计算主反应的

 。
。②该方法制备是低温氯化法,若反应温度较高造成的主要影响是
(3)Cl2也可以与NO反应:
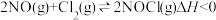 。一定温度下,用NO、Cl2和NOCl表示该反应的反应速率分别为
。一定温度下,用NO、Cl2和NOCl表示该反应的反应速率分别为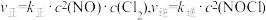 (
(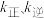 为速率常数)。向2 L密闭容器中充入1.5 mol NO和1 mol Cl2,测得平衡时NOCl的物质的量分数与温度的关系如图所示,T1、T2、T3大小关系为
为速率常数)。向2 L密闭容器中充入1.5 mol NO和1 mol Cl2,测得平衡时NOCl的物质的量分数与温度的关系如图所示,T1、T2、T3大小关系为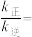

您最近一年使用:0次
【推荐1】T℃,在2L的密闭容器中,通入2molNH3和1molCO2,保持体积不变,发生反应2NH3(g)+CO2(g) 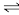 [CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
[CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
(1)NH3的平衡转化率为_______ 。
(2)能说明上述反应达到平衡状态的是_______(填标号)。
(3)一定温度下,某恒容密闭容器中发生反应2NH3(g)+CO2(g) 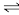 [CO(NH2)2](s)+H2O(g),若原料气中
[CO(NH2)2](s)+H2O(g),若原料气中 =m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
=m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
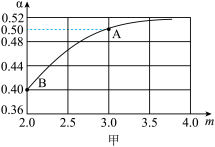
①若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数Kp=_______ (MPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质的量之比nA(NH3):nB(NH3)=_______ 。
 [CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:
[CO(NH2)2](s)+H2O(g),10min时反应刚好达到平衡。测得起始压强为平衡时压强的1.5倍,则:(1)NH3的平衡转化率为
(2)能说明上述反应达到平衡状态的是_______(填标号)。
| A.n(CO2):n(NH3)=1:2 |
| B.混合气体的密度不再发生变化 |
| C.单位时间内消耗2molNH3,同时生成1molH2O |
| D.CO2的体积分数在混合气体中保持不变 |
 [CO(NH2)2](s)+H2O(g),若原料气中
[CO(NH2)2](s)+H2O(g),若原料气中 =m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
=m,测得m与CO2的平衡转化率(α)的关系如图甲所示。
①若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数Kp=
②若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质的量之比nA(NH3):nB(NH3)=
您最近一年使用:0次
【推荐2】对CH4和CO2的高效利用不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。
(1)CH4临氧耦合CO2重整的反应体系中主要发生反应:
反应Ⅰ:2CH4(g)+O2(g) 2CO(g)+4H2(g)
2CO(g)+4H2(g)  =-71.4kJ/mol
=-71.4kJ/mol
反应Ⅱ:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)  =+247.0kJ/mol
=+247.0kJ/mol
写出表示CO燃烧热的热化学方程式___________ 。
(2)在两个体积均为1L的恒容密闭容器中,起始时按表中相应的量加入物质。在相同温度下进行反应Ⅱ:CH4(g)+CO2(g) 2CO(g)+2H2(g) (不发生其他反应),CO2的平衡转化率如下表所示。
2CO(g)+2H2(g) (不发生其他反应),CO2的平衡转化率如下表所示。
下列说法正确的是___________(填序号)。
(3)CO2还可以通过催化加氢合成乙醇:6H2(g)+2CO2(g) C2H5OH(g)+3H2O(g) ΔH<0。设m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH<0。设m为起始时的投料比,即m= 。通过实验得到下列图像:
。通过实验得到下列图像:
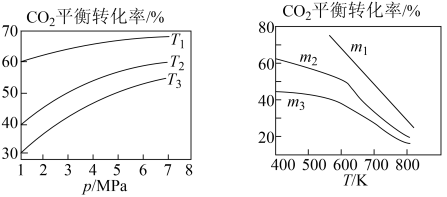
①若图1中m相同,则温度从低到高排序为___________ 。
②图2中m1、m2、m3从小到大的顺序为___________ 。
③当m=3时,保持温度不变,向一个2L的恒容密闭容器中充入1.8molH2,10s后反应达平衡,H2的物质的量为1.2mol,用H2O(g)表示的平均反应速率为___________ mol/(L·min),CO2的平衡转化率为___________ %(结果保留1位小数)。
(4)实验测得反应Ⅲ:2CH4(g) C2H2(g)+3H2(g)的速率方程为
C2H2(g)+3H2(g)的速率方程为 ,
,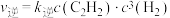 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。若T1°C下反应达到平衡时
分别为正、逆反应速率常数,只与温度、催化剂有关)。若T1°C下反应达到平衡时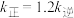 ,则T1°C时该反应的平衡常数
,则T1°C时该反应的平衡常数 =
=___________ ,已知升高温度后 增大的程度大于
增大的程度大于 增大的程度,则该反应的
增大的程度,则该反应的
___________ 0(填“>”或“<”)。
(1)CH4临氧耦合CO2重整的反应体系中主要发生反应:
反应Ⅰ:2CH4(g)+O2(g)
 2CO(g)+4H2(g)
2CO(g)+4H2(g)  =-71.4kJ/mol
=-71.4kJ/mol反应Ⅱ:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)  =+247.0kJ/mol
=+247.0kJ/mol写出表示CO燃烧热的热化学方程式
(2)在两个体积均为1L的恒容密闭容器中,起始时按表中相应的量加入物质。在相同温度下进行反应Ⅱ:CH4(g)+CO2(g)
 2CO(g)+2H2(g) (不发生其他反应),CO2的平衡转化率如下表所示。
2CO(g)+2H2(g) (不发生其他反应),CO2的平衡转化率如下表所示。| 容器 | 起始物质的量/mol | CO2的平衡转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| X | 0.1 | 0.1 | 0 | 0 | 40% |
| Y | 0.1 | 0.1 | 0.2 | 0.2 | ___________ |
| A.因为ΔS>0,所以该反应在任意温度下均能自发进行 |
B.容器内各物质的浓度满足 时,反应达到平衡状态 时,反应达到平衡状态 |
C.X、Y两容器内的平衡常数关系为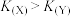 |
| D.断裂0.5molH-H同时断裂1molC-H,反应达到平衡状态 |
(3)CO2还可以通过催化加氢合成乙醇:6H2(g)+2CO2(g)
 C2H5OH(g)+3H2O(g) ΔH<0。设m为起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH<0。设m为起始时的投料比,即m= 。通过实验得到下列图像:
。通过实验得到下列图像:
①若图1中m相同,则温度从低到高排序为
②图2中m1、m2、m3从小到大的顺序为
③当m=3时,保持温度不变,向一个2L的恒容密闭容器中充入1.8molH2,10s后反应达平衡,H2的物质的量为1.2mol,用H2O(g)表示的平均反应速率为
(4)实验测得反应Ⅲ:2CH4(g)
 C2H2(g)+3H2(g)的速率方程为
C2H2(g)+3H2(g)的速率方程为 ,
,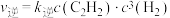 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。若T1°C下反应达到平衡时
分别为正、逆反应速率常数,只与温度、催化剂有关)。若T1°C下反应达到平衡时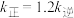 ,则T1°C时该反应的平衡常数
,则T1°C时该反应的平衡常数 =
= 增大的程度大于
增大的程度大于 增大的程度,则该反应的
增大的程度,则该反应的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】当今,世界多国相继规划了碳达峰、碳中和的时间节点,因此碳的利用、捕集和减排成了研究的重点。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.9kJ•mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
将CO2和H2按体积比1∶4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。________ v逆(a)(填“>”“=”或“<”)。
②Ru/TiO2催化剂在较低温度主要选择_______ (填“反应I”或“反应II”)。
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是_______ 。
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=_______ L2•mol-2。
(2)合成碳酸二甲酯的工作原理如图所示。_______ ,离子交换膜a为_______ (填“阳膜”、“阴膜”)。
(3)NaBH4在储氢材料、燃料电池等方面具有重要应用,合理使用可以减少碳排放。
①NaBH4中H元素的化合价为-1,具有强还原性。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH 与Fe2+反应生成纳米铁粉、H2和B(OH)
与Fe2+反应生成纳米铁粉、H2和B(OH) ,参加反应的BH
,参加反应的BH 与生成的纳米铁粉的物质的量之比为
与生成的纳米铁粉的物质的量之比为_______ 。
②NaBH4燃料电池中,NaBH4转化为NaBO2,电解NaBO2溶液又可制得NaBH4,实现物质的循环利用,电解装置示意图如图所示。_______ 。两电极区间使用阳离子交换膜,不允许阴离子通过的原因是_______ 。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
反应I:CO2(g)+4H2(g)=CH4(g)+2H2O(g) △H=-164.9kJ•mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41.2kJ•mol-1
将CO2和H2按体积比1∶4混合(n总=5mol),匀速通入装有Ru/TiO2催化剂的反应容器中发生反应I和反应II。反应相同时间,CO2转化率、CH4和CO选择性(选择性:转化的CO2中生成CH4或CO的百分比)随温度变化曲线分别如图所示。

②Ru/TiO2催化剂在较低温度主要选择
③350℃~400℃温度区间,CO2转化率呈现减小的变化趋势,其原因是
④350℃时,反应达到平衡时容器体积为5L,求该温度下反应I的平衡常数K=
(2)合成碳酸二甲酯的工作原理如图所示。

(3)NaBH4在储氢材料、燃料电池等方面具有重要应用,合理使用可以减少碳排放。
①NaBH4中H元素的化合价为-1,具有强还原性。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH
 与Fe2+反应生成纳米铁粉、H2和B(OH)
与Fe2+反应生成纳米铁粉、H2和B(OH) ,参加反应的BH
,参加反应的BH 与生成的纳米铁粉的物质的量之比为
与生成的纳米铁粉的物质的量之比为②NaBH4燃料电池中,NaBH4转化为NaBO2,电解NaBO2溶液又可制得NaBH4,实现物质的循环利用,电解装置示意图如图所示。

您最近一年使用:0次



